手性离子液体1-丁基-3-甲基-咪唑乳酸盐及其与水二元混合物的体积性质和表面性质
2014-03-09姜海超张丽喆李飞龙刘亚青胡永琪
姜海超,张丽喆,李飞龙,崔 蕊,刘亚青,胡永琪
(河北科技大学化学与制药工程学院,河北石家庄,050018)
作为新兴的绿色溶剂,离子液体具有一些独特的性质,例如挥发性低,热稳定性强,极性可控,以及对无机和有机物质具有良好的溶解性等[1]。因此,其在合成[2]、催化[3]、电化学[4]以及分离工程方面[5,6]具有巨大的应用潜能。所以,对离子液体的物理化学性质的研究,例如密度[7,8],表面张力[9],粘度[10,11],以及溶解性[12~16]等,就显得尤为重要。目前,大多数文献报道集中于常规离子液体,而手性离子液体的物化性质研究相对较少。由于手性离子液体同时具有离子液体的性质和手性,可应用于核磁共振(NMR)[17,18],近红外 (NIR)[19],不对称合成[20,21],聚合反应[22],以及气相色谱[23]等。常见的手性离子液体因其阳离子带有手性基团而具有手性;而对于阴离子具有手性的离子液体,其手性阴离子可以与传统的阳离子结合,使离子液体本身具有手性。例如,带有手性阴离子[L-lactate]-阴离子的咪唑类离子液体。
离子液体物理化学性质的研究对离子液体的设计和应用具有重要的指导作用,而对于离子液体与分子溶剂(例如水)的混合物性质研究将会揭示该类液体的新的应用。笔者在不同温度下测定带有手性阴离子的纯离子液体1-丁基-3-甲基-咪唑乳酸盐([bmim][L-lactate])及[bmim][L-lactate]+H2O 二元混合物的密度和表面张力,并对其体积性质和表面性质进行研究。以期进一步丰富手性离子液体与分子溶剂二元混合物的物理化学性质数据,为其应用提供更多的理论依据。
1 实验部分
1.1 药品
手性离子液体[bmim][L-lactate](质量分数>0.99)购于上海益江化学有限公司。为了除去样品中的水分,在使用前先将离子液体在80℃和真空状态下烘干至少48 h。样品的含水量由Karl Fisher滴定测得,其质量分数<0.000 2。
1.2 离子液体密度的测定
样品由Mettler AX-205天平称量(METTLER TOLEDO,上海),质量精度为1×10-4。为了防止样品吸水,在N2保护下采用Anton-Paar DMA4 500密度计测量样品密度。测定的温度范围为293.15~343.15 K。密度测量精度为±0.000 2 g/cm3,测量温度精度为±0.01 K。测量仪器使用二次蒸馏水校准,取3次重复性实验结果的平均值作为结果。
1.3 离子液体表面张力的测定
表面张力的测量采用白金板法,应用DCAT21(Dataphysics,Germany)表面张力仪进行测定。测定的温度范围为293.15~343.15 K。为了防止液体表面污染和吸水,表面张力的测量在N2保护下进行。样品放置于体积为40 cm3密闭的容器中进行测量,温度精度为±0.02 K。在进行测量前,白金板和容器在硝酸溶液中浸泡数小时后使用蒸馏水冲洗,烧干,再次用蒸馏水冲洗后进行干燥。取5次实验的平均值作为结果,精度为±0.15 mN/m。
2 结果与分析
2.1 [bm im][L-lactate]的体积性质
在293.15~343.15 K温度范围内,实验测得的离子液体[bmim][L-lactate]的密度随着温度的升高而减小(图1)。根据不同温度下的密度,可以得到[bmim][L-lactate]的热膨胀系数。实验测得的lnρ对T绘于图1,并对其进行了线性拟合,得到经验公式:

式中ρ为离子液体密度(单位:g·cm3),T为液体温度(单位:K),相关系数为0.999 7。离子液体的热膨胀系数通过下式获得:

式中α为热膨胀系数(单位:K-1),V为离子液体体积(单位:cm3),ρ为离子液体密度(单位:g·cm-3),T为离子液体温度(单位:K)。由拟合曲线得到[bmim][L-lactate]的热膨胀系数为8.31×10-4K-1,该值大于[emim][L-lactate]的热膨胀系数(8.0 ×10-4K-1)[24]。
根据实验测得的密度,可由下试计算出离子液体的分子体积:

式中Vm为离子液体的分子体积(单位:nm3),M为[bmim][L-lactate]的摩尔质量,228.29 g·mol-1;N 为阿伏伽德罗常数。在298.15 K,计算得到[bmim][L-lactate]的分子体积为 0.341 2 nm3。
根据Glasser[25]的理论,熵可由分子体积计算得到:

式中 So(298)为298 K 下离子液体的标准熵(单位:J·(mol·K)-1),298.15 K 时,[bmim][L-lactate]的标准熵为 454.8 J·(mol·K)-1。
晶格能(UPOT)可以反映出离子液体阴阳离子间的相互作用,而根据密度可以对晶格能进行估算,然后可以进一步计算热组成[26]。根据Glasser[25]提出的理论,晶格能可由下式计算得到:

式中 UPOT为晶格能(单位:kJ·mol-1),ρ为离子液体密度(单位:g·cm-3),M为[bmim][L-lactate]的摩尔质量,228.29 g·mol-1。计算得到的离子液体[bmim][L-lactate]的晶格能为 439.6 kJ·mol-1,比[emim][L-lactate]的晶格能小(457.7 kJ·mol-1)[24]。这说明[bmim][L-lactate]要比[emim][L-lactate]阴阳离子间的相互作用弱。
2.2 [bm im][L-lactate]的表面性质
在293.15~343.15 K温度范围内实验测得的离子液体[bmim][L-lactate]的表面张力值随温度的升高而减小(图2),并且得到表面张力的经验方程:

式中γ为离子液体的表面张力(单位:mN·m-1),T为离子液体温度(单位:K),a=58.92,b=0.053 5,相关系数为0.998 0。表面熵可由式(6)的斜率得到 Ss=b=-(∂γ/∂T)P,而表面焓在293.15~343.15 K 温度范围内为常数 Hs=a=γ - T(∂γ/∂T)P。[bmim][L-lactate]的表面熵为 0.053 5 m J·(K·m2)-1,表面焓为 58.92 mJ·m-2。

图1 离子液体[bmim][L-lactate]的lnρ对T;
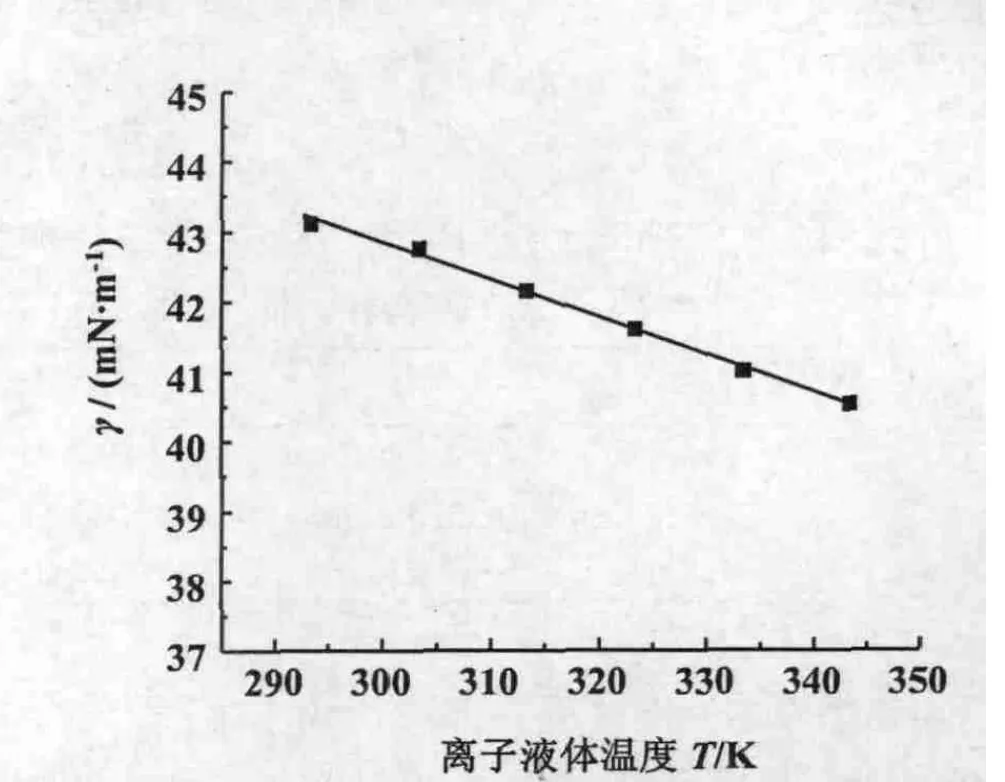
图2 离子液体[bmim][L-lactate]的 γ 对T;
离子液体的临界温度 (critical temperatures,Tc)是其重要的物理化学性质之一[1],然而离子液体本身的性质使得临界温度的实验值很难获得。因此,许多研究小组应用Guggenheim经验方程[27]来推测离子液体的临界温度[1,27]。该经验方程的形式为:

式中Tc为离子液体的临界温度(单位:K),T为离子液体温度(单位:K),γ为表面张力(单位:mN·m-1),K 为经验常数。该方程说明临界温度下表面张力值为0[1,27]。由式(7)估算的[bmim][L-lactate]的临界温度为1 169 K,比[emim][L-lactate]的临界温度高[24]。Rebelo 等[28]提出离子液体沸点温度可由Tb=0.6 Tc估算得到。计算得到的[bmim][L-lactate]的沸点温度为701 K。
离子液体的独特性质之一是其具有低蒸汽压,这可以用蒸发焓来体现。Zaitsau等[29]提出了一个经验方程可用来估算蒸发焓:

2.3 [bm im][L-lactate]+H2O二元混合物的体积性质
不同浓度下,实验测得的二元混合体系[bmim][L-lactate]+H2O在不同温度下的密度值随温度的增加而减小(图3);随着体系中离子液体摩尔分数的增加而增大;离子液体浓度低时密度增加较快,离子液体浓度高时密度增加缓慢。
在二元混合物中,过量摩尔体积对研究分子聚集的特性是非常重要的。过量摩尔体积VE可由下试得到:

式中 VE为过量摩尔体积(单位:cm3·mol-1),xIL为二元混合物中[bmim][L-lactate]的摩尔分率;ρ,ρ1,ρ2分别为混合物、纯离子液体[bmim][L-lactate]和 H2O 的密度(单位:g·cm-3);M1和 M2分别为[bmim][L-lactate]和 H2O 的摩尔质量(单位:g·mol-1)。二元混合物的过量性质应用 Redlich-Kister[31~33]方程进行拟合:

式中Z代表过量性质,xIL为二元混合物中[bmim][L-lactate]的摩尔分率,BP代表拟合参数,M为多项式的项数,采用Marquardt算法[34]进行优化。拟合参数BP值和标准偏差(σ)列于表1。标准偏差由下式计算得到:

式中zexp,zcal和ndat分别代表实验值、计算值和实验次数。
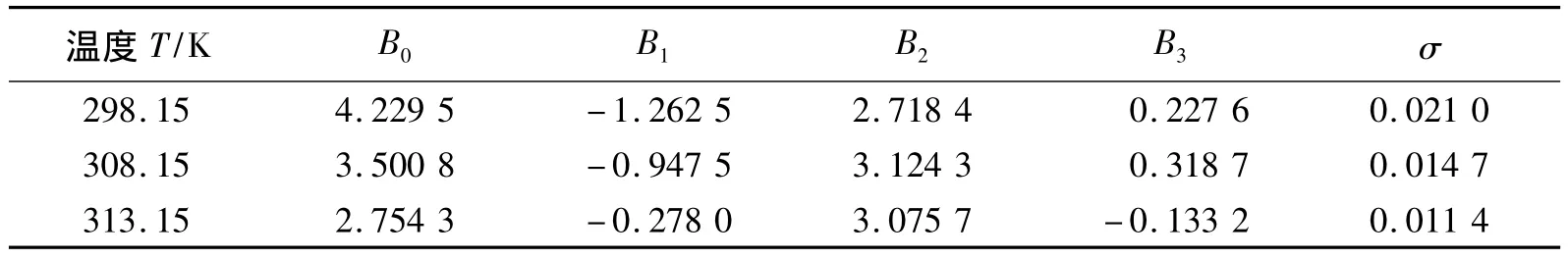
表1 二元混合物[bmim][L-lactate]+H2O的V E的拟合参数BP和均方偏差(σ)
在全摩尔浓度范围内,过量摩尔体积VE均为正值(图4)。当xIL<0.4时,VE随着离子液体[bmim][L-lactate]浓度的增加而增加,并在 xIL=0.4 处取得最大值,分别为 1.10,0.92,0.72 cm3·mol-1;然后VE随着[bmim][L-lactate]浓度的增加而减小,在离子液体高浓度区域和水的高浓度区域之间出现了峰值。这种现象与[emim][BF4]+H2O[35]和[bmim][BF4]+H2O[36,37]相似。VE的正值说明与理想混合相比具有正的偏差,并且温度越低,VE值越正。以上说明了在混合的过程中水分子减弱甚至破坏了离子液体阴阳离子间的强相互作用[36]。
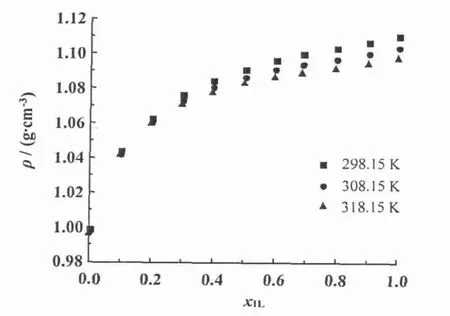
图3 不同温度下[bmim][L-lactate]+H2 O二元混合物密度比较

图4 [bmim][L-lactate]+H2 O二元混合物的过量摩尔体积:曲线,Redlich-Kister方程拟合曲线
混合物中离子液体和水的偏摩尔体积可分别由以下2式得到[38,39]:



式中VM为混合物的摩尔体积(单位:cm3·mol-1),MIL和MS分别为离子液体和溶剂水的摩尔质量(单位:g·mol-1),xIL为离子液体在混合物中的摩尔分率,ρ为混合物的密度(单位:g·cm-3)。
二元混合物中组份i的表观摩尔体积Vφi可由下式计算得到:

式中VM代表混合物的摩尔体积(单位:cm3·mol-1),xi代表组分i在混合物中的摩尔分率,VMj代表另一个组分j的摩尔体积(单位:cm3·mol-1)。结合式(9)和(17)可以得到本次研究混合物中的表观摩尔体积:


图5 [bmim][L-lactate]+H2 O二元混合物中IL过量偏摩尔体积
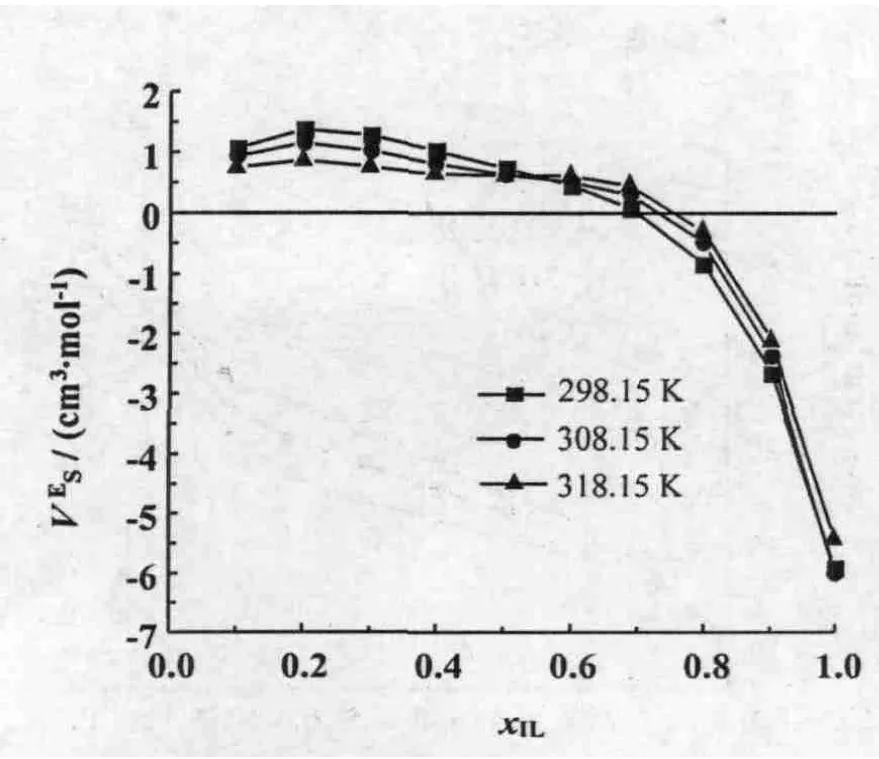
图6 [bmim][L-lactate]+H2O二元混合物中H2 O过量偏摩尔体积
离子液体和水的二元混合物中,离子液体的表现偏摩尔体积VφIL随着温度的升高而增大,并且在全摩尔浓度范围内随着离子液体浓度的增加而减小(图8);而水的表现偏摩尔体积VφS随着温度的升高而减小(图9),并且与VφIL具有相反的变化趋势。
2.4 [bm im][L-lactate]+H2O二元混合物的表面性质
不同浓度下,实验测得的二元混合体系[bmim][L-lactate]+H2O在不同温度下的表面张力见图10。表面张力偏差δγ可由下试得到:

式中γ和γi分表示混合物和组分i的表面张力(单位:mN·m-1),xi代表组分i的摩尔分率。可以看出,[bmim][L-lactate]+H2O二元混合物的表面张力偏差在全摩尔浓度范围内为负值。温度升高,混合物的表面张力值减小(图10)。在离子液体摩尔浓度低时(xIL<0.06),混合物的表面张力随着xIL的增加快速减小;而在高离子液体浓度区域,表面张力值几乎为一常数。说明[bmim][L-lactate]在水溶液中的行为接近表面活性剂,相似的性质出现在[emim][BF4],[bmim][BF4]和[hmim][BF4]的水溶液中[36,40,41]。而这个拐点(xIL≈0.06)称为聚集点 (aggregation onset,AO)[42]。[bmim][L-lactate]+H2O二元混合物的临界聚集浓度 (critical aggregation concentration,CAC)为2.06 mol/L,比[emim][L-lactate]+H2O 二元混合物[24]的临界聚集浓度(1.96 mol/L)要高。
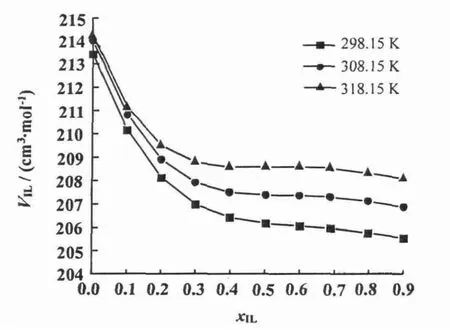
图7 [bmim][L-lactate]+H2O二元混合物中IL偏摩尔体积

图8 [bmim][L-lactate]+H2 O二元混合物中IL表观摩尔体积
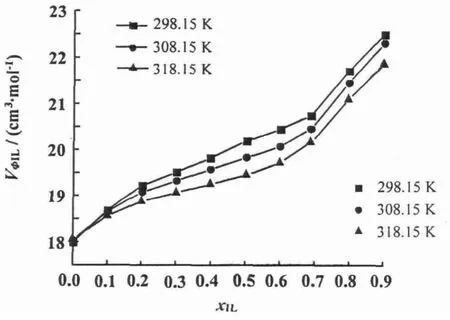
图9 [bmim][L-lactate]+H2O二元混合物中H2 O表观摩尔体积
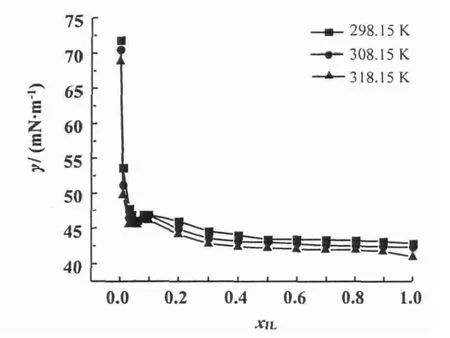
图10 [bmim][L-lactate]+H2 O二元混合物的表面张力
混合物的表面张力偏差(δγ)可以根据下式[40]进行拟合

拟合参数和均方偏差见表2。

表2 二元混合物[bmim][L-lactate]+H2 O拟合参数和均方偏差(σ)
3 结 论
本次研究测定了不同温度下手性离子液体[bmim][L-lactate]以及二元混合物[bmim][L-lactate]+H2O的密度和表面张力。结果表明,离子液体的密度和表面张力均随着温度的增加而减小;并且对纯离子液体的热膨胀系数、表面熵、表面焓以及其临界温度进行了计算。研究了二元混合物的体积性质(过量摩尔体积、偏摩尔体积、表观摩尔体积、过量偏摩尔体积)、表面性质,发现二元混合物的密度随温度的增加而减小;所研究的二元混合体系的密度均随着体系中离子液体摩尔分数的增加而增大;混合物中手性离子液体与分子溶剂间具有强的相互作用。
[1] Freire MG,Carvalho P J,Fernandes A M,et al.Surface tensions of imidazolium based ionic liquids:Anion,cation,temperature and water effect[J].JColloid Interface Sci,2007,314:621-630.
[2] Howarth J,James P,Ryan R.Sodium borohydride reduction of aldehydes and ketones in the recyclable ionic liquid[BMIM]PF6[J].Synth Commun,2001,31:2 935-2 942.
[3] Chen W,Xu L,Chatterton C,et al.Palladium catalysed allylation reactions in ionic liquids[J].Chem Commun,1999,13:1 247-1 248.
[4] Fuller J,Carlin R T,Osteryoung R A.The room temperature ionic liquid 1-ethyl-3-methylimidazolium tetrafluoroborate:electrochemical couples and physical properties[J].JElectrochem Soc,1997,144:3 881-3 885.
[5] Cserjési P,Nemestóthy N,Bélafi-BakóK.Gas separation properties of supported liquid membranes prepared with unconventional ionic liquids[J].JMembrane Sci,2010,349:6-11.
[6] Palgunadi J,Kim H S,Lee JM,et al.Ionic liquids for acetylene and ethylene separation:Material selection and solubility investigation[J].Chem Eng Process,2010,49:192-198.
[7] Fredlake C P,Crosthwaite JM,Hert D G,et al.Thermophysical properties of imidazolium-based ionic liquids[J].JChem Eng Data,2004,49:954-964.
[8] Gu Z,Brennecke JF.Volume expansivities and isothermal compressibilities of imidazolium and pyridinium-based ionic liquids[J].JChem Eng Data,2002,47:339-345.
[9] Law G,Watson P R.Surface tension measurements of N-alkylimidazolium ionic liquids[J].Langumir,2001,17:6 138-6 141.
[10] Zhang J,Wu W,Jiang T,et al.Conductivities and viscosities of the ionic liquid [bmim][PF6]+water+ethanol and[bmim][PF6]+water+acetone ternarymixtures[J].JChem Eng Data,2003,48:1 315-1 317.
[11] Bonhôte P,Dias A P,Papageogiou N,et al.Hydrophobic,highly conductive ambient-temperaturemolten salts[J].Inorg Chem,1996,35:1 168-1 178.
[12] Chaumont A,Engler E,Wipff G.Uranyl and strontium salt solvation in room-temperature ionic liquids.A molecular dynamics investigation[J].Inorg Chem,2003,42:5 348-5 356.
[13] Chaumont A,Wipff G.Solvation of uranyl(II),europium(III)and europium(II)cations in“basic”room-temperature ionic liquids:A theoretical study[J].Chem Eur J,2004,10:3 919-3 930.
[14] Chaumont A,Wipff G.Solvation of uranyl(II)and europium(III)cations and their chloro complexes in a room-temperature ionic liquid.A theoretical study of the effect of solvent“humidity”[J].Inorg Chem,2004,43:5 891-5 901.
[15] Chaumont A,Wipff G.Solvation ofM3+lanthanide cations in room-temperature ionic liquids.A molecular dynamics investigation[J].Phys Chem Chem Phys,2003,5:3 481-3 488.
[16] Hanke C G,Johansson A,Harper JB,etal.Why are aromatic compoundsmore soluble than aliphatic compounds in dimethylimidazolium ionic liquids?A simulation study[J].Chem Phys Lett,2003,374:85-90.
[17] Clavier H,Boulanger L,AudiN,etal.Design and synthesis of imidazolinium salts derived from(L)-valine.Investigation of their potential in chiralmolecular recognition[J].Chem Commun,2004:1 224-1 225.
[18] Levillain J,Dubant G,Abrunhos I,et al.Synthesis and properties of thiazoline based ionic liquids derived from the chiral pool[J].Chem Commun,2003:2 914-2 915.
[19] Tran C D,Oliveira D,Yu S.Ionic liquids as an attractive alternative solvent for thermal lens measurements[J].Anal Chem,2006,78:1 349-1 356.
[20] Wang Z,Wang Q,Zhang Y,et al.Synthesis of new chiral ionic liquids from natural acids and their applications in enantioselective Michael addition[J].Tereahedron Lett,2005,46:4 657-4 660.
[21] Kiss L,Kurtán T,Antus S,et al.Further insight into themechanism of Heck oxyarylation in the presence of chiral ligands[J].Arkivoc,2003,5:69-76.
[22] Biedron T,Kubisa P.Radical polymerization in a chiral ionic liquid:Atom transfer radical polymerization ofacrylates[J].JPolym Sci Part A:Polym Chem,2005,43:3 454-3 459.
[23] Ding J,Welton T,Armstrong DW.Chiral ionic liquids as stationary phases in gas chromatography[J].Anal Chem,2004,76:6 819-6 822.
[24] Wang JY,Jiang H C,Liu Y M,et al.Density and surface tension of pure 1-ethyl-3-methylimidazolium l-lactate ionic liquid and its binarymixtureswith water[J].JChem Thermodynamics,2011,43:800-804.
[25] Glasser L.Lattice and phase transition thermodynamics of ionic liquids[J].Thermochim Acta,2004,421:87-93.
[26] Ye C F,Shreeve JM.Rapid and accurate estimation of densities of room-temperature ionic liquids and salts[J].JPhys Chem A,2007,111:1 456-1 461.
[27] Guggenheim E A.The principle of corresponding states[J].JChem Phys,1945,13:253-258.
[28] Rebelo L,Canongia L,Esperança J,et al.On the critical temperature,normal boiling point,and vapor pressure of ionic liquids[J].JPhys Chem B,2005,109:6 040-6 043.
[29] Zaitsau D H,Kabo G J,Strechan A A,et al.Experimental vapor pressures of1-alkyl-3-methylimidazolium bis(trifluoromethylsulfonyl)imides and a correlation scheme for estimation of vaporization enthalpies of ionic liquids[J].JPhys Chem A,2006,110:7 303-7 306.
[30] Jiang H C,Wang JY,Zhao F Y,et al.Volumetric and surface properties of pure ionic liquid N-octyl-pyridinium nitrate and its binarymixture with alcohol[J].JChem Thermodyn,2012,47:203-208.
[31] Gomez E,Gonzalez B,Calvar N,et al.Physical properties of pure 1-ethyl-3-methylimidazolium ethylsulfate and its binary mixtureswith ethanol and water at several temperatures[J].JChem Eng Data,2006,51:2 096-2 102.
[32] Pereiro A B,Rodríguez A.Relative permittivities,refractive indices,and densities for the binarymixtures N,N'-dimethylacetamide with methanol,ethanol,1-butanol,and 2-propanol at298.15 K[J].JChem Eng Data,2007,52:600-608.
[33] Gonzâlez E J,Gonzâlez B,Calvar N,et al.Physical properties of binarymixtures of the ionic liquid 1-ethyl-3-methylimidazolium ethyl sulfate with several alcohols at T=(298.15,313.15,and 328.15)K and atmospheric pressure[J].J Chem Eng Data,2007,52:1 641-1 648.
[34] Marquardt DW.An algorithm for the leastsquares estimation ofnonlinear parameters[J].JSoc Ind ApplMath,1963,11:431-441.
[35] Zhang S J,Li X,Chen H P,et al.Determination of physical properties for the binary system of 1-ethyl-3-methylimidazolium tetrafluoroborate+H2O[J].JChem Eng Data,2004,49:760-764.
[36] Ries L A S,Amaral F A do,Matos K,et al.Evidence of change in themolecular organization of 1-n-butyl-3-methylimidazolium tetrafluoroborate ionic liquid solutionswith the addition ofwater[J].Polyhedron,2008,27:3 287-3 293.
[37] Zhou Q,Wang L S,Chen H P.Densities and viscosities of 1-butyl-3-methylimidazolium tetrafluoroborate+H2O binary mixtures from(303.15 to 353.15)K[J].JChem Eng Data,2006,51:905-908.
[38] Wang H J,Hu L J,Wu Y H.Excess volumes and partialmolar volumes of binary mixtures of 1,2-propanediol carbonate with xylene in the temperature range of(293.15 to 353.15)K[J].JChem Thermodyn,2005,37:1 119-1 129.
[39] Zarei H A.Densities,excessmolar volumes and partialmolar volumes of the binarymixtures of acetic acid+alkanol(C1-C4)at298.15 K[J].JMol Liq,2007,130:74-78.
[40] Rilo E,Pico J,García-Garabal S,et al.Density and surface tension in binary mixtures of CnMIM-BF4ionic liquids with water and ethanol[J].Fluid Phase Equilib,2009,285:83-89.
[41] Liu W,Zhao T,Zhang Y,etal.The physical properties of aqueous solutions of the ionic liquids[BMIM][BF4][J].JSolution Chem,2006,35:1 337-1 346.
[42] Fröba A P,Wasserscheid P,Gerhard D,etal.Revealing the influence of the strength of coulomb interactions on the viscosity and interfacial tension of ionic liquid cosolventmixtures[J].JPhys Chem B,2007,111:12 817-12 822.
