基于海洋细菌为受试生物的海洋防污剂快速筛选方法*
2014-03-09徐焕志孙保库陆阿定刘雪珠
沈 明 徐焕志① 孙保库 陆阿定 刘雪珠
(1.浙江海洋学院海洋科学与技术学院 国家海洋设施养殖工程技术研究中心 舟山 316004;2.浙江省海洋开发研究院舟山 316100;3.浙江海洋学院海洋科学与技术学院 海洋生物资源与分子工程实验室 舟山 316004)
海洋污损问题制约着人类对海洋资源的开发利用,并带来巨大的经济损失(黄宗国等,1984;倪春花等,2009)。关于海洋污损,最早的文字记录可以追溯到公元前5世纪(WHOI,1952)。通常认为,微生物群落首先附着在相应基体上,形成生物膜(Chamberset al,2006;段东霞,2011),为后来附着生物提供营养和附着基,从而有利于其他大型污损生物的附着(ASTM,1993;Swainet al,1996;Charnley,2011)。因此,阻止微生物的附着是防治海洋污损重要的环节。目前,涂装防污涂料是最常用的防污方法(胥震,2012),在防污涂料中加入杀菌剂类防污剂是常用的手段,但是其中添加的有毒防污剂(多为杀菌、灭藻剂)对海洋环境造成很大的危害(Yebra,2004;Antizar-Ladislao,2008),开发环境友好型防污涂料是目前的发展方向。目前防污材料(防污剂、防污涂料、防污树脂,等等)的防污性能评价多采用浅海挂板实验方法,致使防污涂料研发周期过长,因而在前人研究的基础上,探究简单快速的评价方法对防污剂和防污涂料的开发具有重要意义。研究者在这方面已经取得了一些成果,例如,利用室内挂板分光光度法和抑菌圈法(田斌,2005)快速评价防污剂的杀菌性,但研究者采用金黄色葡萄球菌、大肠杆菌、酵母菌等非海洋细菌和真菌作为受试生物,明显不具有代表性。也有研究者以海洋细菌为受试物(Hellioet al,2001;Philippeet al,2004)对防污材料进行室内评价,但仅限于对溶剂可溶型防污材料的评价,且其评价方法多用抑菌圈法等定性或半定量方法。室内摸拟浅海挂板方法,以紫贻贝为受试生物、以丙烯酸树脂为成膜物质室内挂板(徐焕志,2006),可根据紫贻贝的足丝量来评价材料防污性能,此法对于防污材料的室内评价取得一定进展。本文旨在以海区具有代表性的优势海洋细菌浓度加富的方法,选用防污涂料中广泛使用的防污剂和实验室自制防污剂为受试化合物,以凝胶板模拟涂层进行室内模拟浅海挂板,以探索基于海洋细菌的室内短期挂板方法在防污剂快速评价中的应用。
1 材料与方法
1.1 实验材料
实验所需主要设备和器材有,酶标仪(使用96孔板,高通量检测,MultiskanFC,赛默飞世尔(上海)仪器有限公司),可见分光光度计(WFJ-2000型,尤尼柯(上海)仪器有限公司),生化培养箱(SPX-250BS-Ⅱ,上海新苗医疗器械制造有限公司),水族缸,玻璃板等。
防污剂为防污涂料中广泛使用的防污剂种类,分别是滨海明鸿精细化工有限公司提供的吡啶硫酮铜(CPT,97%)固体橄榄绿色粉末) 和吡啶硫酮锌(ZPT,96%固体白色粉末),敌草隆(Diuron,99%固体白色粉末,上海思域化工科技有限公司)。三甲基氧化锡(TBTO)(曾是最有效的防污剂,由于严重的生态毒性问题目前已禁用,国药集团化学试剂有限公司),N,N-二甲基-3,4-二氯苄胺((3,4-dichlorophenyl)-N,N-dimethylmethanamine,简称DCDMA,浓度约为85%,实验室自制防污剂)。溶剂为二甲亚砜(DMSO,国药集团化学试剂有限公司)。
不同粒径微/纳米Cu2O,粒径分别为 ∅5.986μm,∅5.679μm(江苏泰禾金属工业有限公司提供),∅0.987μm,∅0.612μm(实验室自制)。
菌种是采用海水选择性培养基2216E(Maoet al,2007;郑兆祥等,2011)分离自东海海区的优势菌种,分别为 W-1(来源于东极海水水样,革兰氏阴性菌,舟山)、F-6(来源于东极深水养殖网箱附着物,革兰氏阴性菌,舟山)、Y-16(一种海洋芽孢杆菌Bacillus subtilis,革兰氏阳性菌,由浙江海洋学院微生物实验室采自舟山海域并提供)。
1.2 菌悬液的制备
配制2216E液体培养基备用。取斜面保存的菌种各1环,接种于50mL 的Zobell 2216 E 液体培养基中,25°C,180 r/min条件下,连续培养6h,选取吸光度在0.1—0.6之间(陈默等,2009)的悬液,备用。
以纯DMSO为溶剂(Maraldo,2002;Okamuraet al,2004),配制 CPT、ZPT和 TBTO三种防污剂的浓度为 0.1mg/mL、0.2mg/mL、0.4mg/mL、0.6mg/mL、0.8mg/mL的溶液。配制 Diuron溶液的浓度为10mg/mL、15mg/mL、20mg/mL、25mg/mL、30mg/mL、100mg/mL。DCDMA溶液浓度为 2.0mg/mL、4.0mg/mL、6.0mg/mL、8.0mg/mL、10.0mg/mL,备用。
1.3 室内短期挂板实验方法建立
浅海挂板实验方法、实船涂布(部分)实验方法是目前最有效的防污性能测试方法(Trentinet al,2001),但是实验周期过长,不适合用于防污材料的初、中期筛选。本文旨在研发一种适用于防污材料的初、中期筛选的室内短期挂板实验方法,以缩短防污材料的研发周期。该方法用凝胶模拟涂层评价防污剂的防污性能,具体方法如下:向Zobell 2216 E液体培养基中,分别加入琼脂粉,加热溶解配制琼脂浓度为 1%的琼脂凝胶溶液。冷却至 50—60°C,向其中分别加入 5种防污剂,振荡摇匀,制成防污剂浓度为1 mg/mL的5种琼脂凝胶溶液后,平滑均匀的涂覆于玻璃板(规格:100×100mm)上,如图1所示,晾干,制成凝胶测试板。以不加防污剂的琼脂凝胶测试板作为空白对照。

图1 防污剂——琼脂凝胶测试板示意图Fig.1 Diagram of the test antifoulant,the agar gel panel
分别于 6个玻璃缸(规格:630×370×500mm)中,加入10L无菌海水,以及培养6h后的三种受试菌悬液各1mL,保持温度25°C,培养6h(根据菌种种类不同,培养时间有所差别)后,将涂有琼脂凝胶的玻璃板放到玻璃缸中,置于自制支架上,连续培养 24h,将玻璃板取出,用液体培养基反复淋洗,淋洗液于50 mL容量瓶中定容,测其OD值。
1.4 测定OD值并绘制OD-t生长曲线
取200μL各受试菌悬液于96孔板中,分别向各孔板中加入1μL不同浓度的防污剂,以加入1μL纯溶剂 DMSO的孔板作为对照,以添加对应浓度防污剂的液体培养基作为空白,用酶标仪在 600nm波长下测定其OD值(杨浩等,1996;乔军等,2002;马勇等,2011)。将 96 孔板置于25°C培养箱中培养24 h,期间每隔1—2 h测定并记录菌悬液的OD值,绘制3种受试菌在不同条件板孔中的生长曲线,得到各种防污剂的最小抑制浓度MIC。
1.5 在溶剂难溶型防污剂评价中的应用
制备浓度为2.0mg/mL的不同粒径微/纳米Cu2O-琼脂凝胶测试板,根据 1.3.1所述方法进行室内 24h挂板实验。
1.6 数据分析
1.6.1 24h抑菌率的计算(陈默,2009)
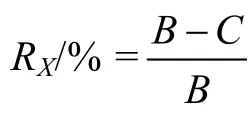
各种物质的抑菌性与TBTO相比较,得相对抑菌率R′/%=待测物平均抑菌率/TBTO平均抑菌率。
1.6.2 最小抑制浓度换算公式:
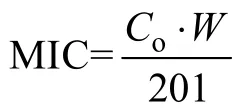
2 结果与分析
2.1 室内短期挂板实验结果
将涂有琼脂凝胶的玻璃板在含有三种受试菌的玻璃缸中,培养24h后取出,对挂板前后细菌的生长情况进行对比,如图2所示。
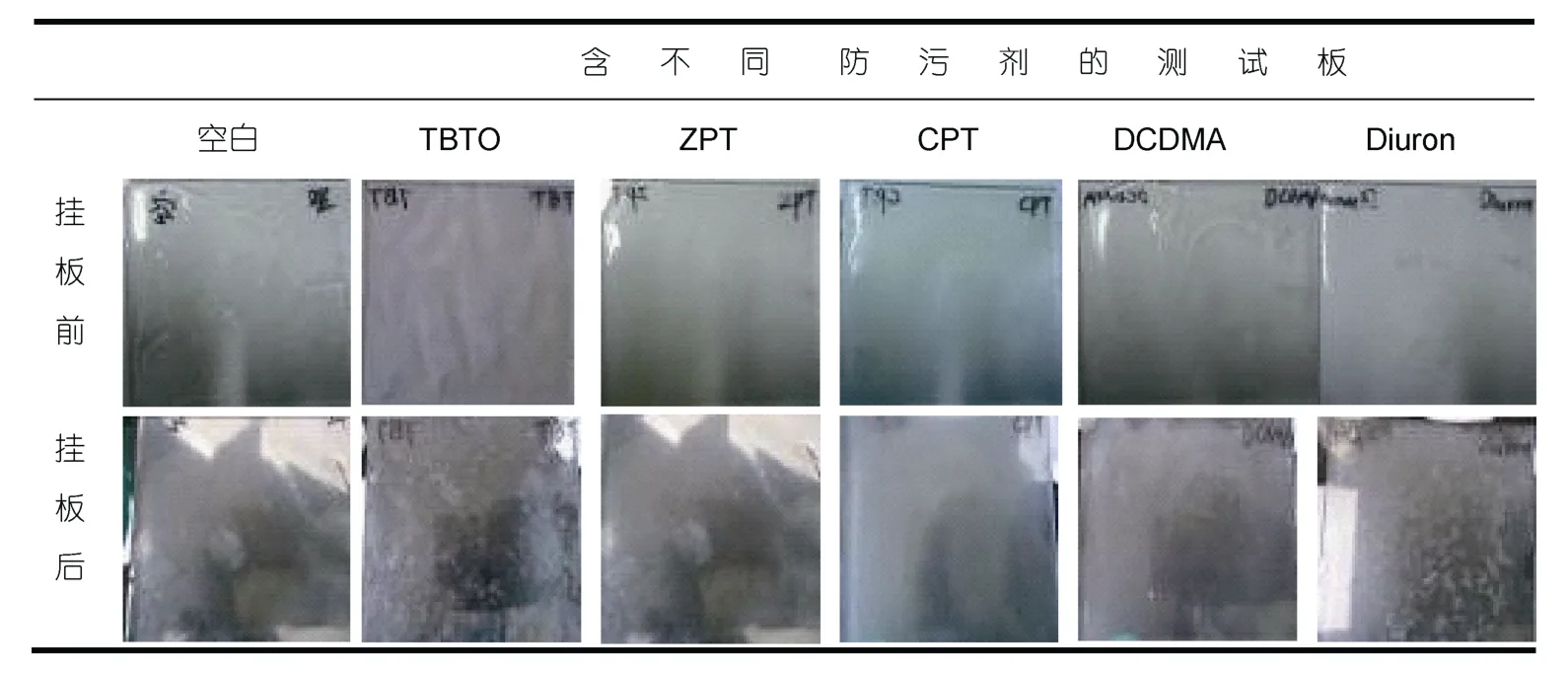
图2 不同凝胶测试板室内挂板前后对比Fig.2 Contrast between test gar gel panels before and after indoor hanging
挂板前,空白对照板、含有 TBTO和含有DCDMA的玻璃板为无色透明的,其中含有CPT的玻璃板为橄榄绿色,其余为乳白色,所有的玻璃凝胶板均平整光滑。24h后取出,琼脂凝胶层变得松软,取无色透明的防污剂——凝胶测试板在显微镜下观察,可发现表面上的细菌菌落。其中含有TBTO的玻璃凝胶板上几乎没有菌落附着,空白对照板和含有Diuron的板有大量菌落,含有ZPT、CPT和DCDMA的玻璃凝胶板上则无较大差别。
24h挂板后的凝胶测试板板,经淋洗定容后,其抑菌效果如图3所示。
由图3可以看出,24h室内短期挂板后,防污剂TBTO、CPT、ZPT、DCDMA对应的平均抑菌率分别为65.19%,41.24%,38.87%和30.88%。其中,TBTO抑菌效果最为显著;其凝胶测试板淋洗液的平均抑菌率达到了65.19%。CPT、ZPT的抑菌性较接近,但CPT效果稍强于ZPT,这可能是由于CPT比ZPT更加稳定的原因。DCDMA的抑菌性也比较显著;而Diuron对三种海洋细菌的抑制效果最差,这主要是因为作为防污剂的Diuron是一种除藻剂而非杀菌剂。综合图3a和图3b可以得到,5种化合物的抑菌性大小为 TBTO>CPT>ZPT>DCDMA>Diuron。与TBTO的抑菌性相比较,其余几种防污剂的相对抑菌率如图3b所示。
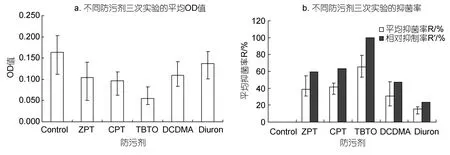
图3 不同凝胶测试板24h室内挂板结果Fig.3 Results of different test gar gel panels after 24h indoor hanging
2.2 受试菌的生长曲线及 MIC
3种受试菌在几种不同浓度防污剂溶液影响下的生长曲线,可以很直观地反应出 5种试验防污剂的抑菌效果(Marionet al,2008),见图4、图5、图6、图7、图8。
由图4 —图6可以看出,随着防污剂CPT、TBTO和ZPT浓度的升高,3种受试菌的生长逐渐受到抑制,当溶液浓度达分别到 0.97×10–3mg/mL、1.99×10–3mg/mL和1.91×10–3mg/mL时,三种防污剂对受试菌均表现出明显的抑制作用。
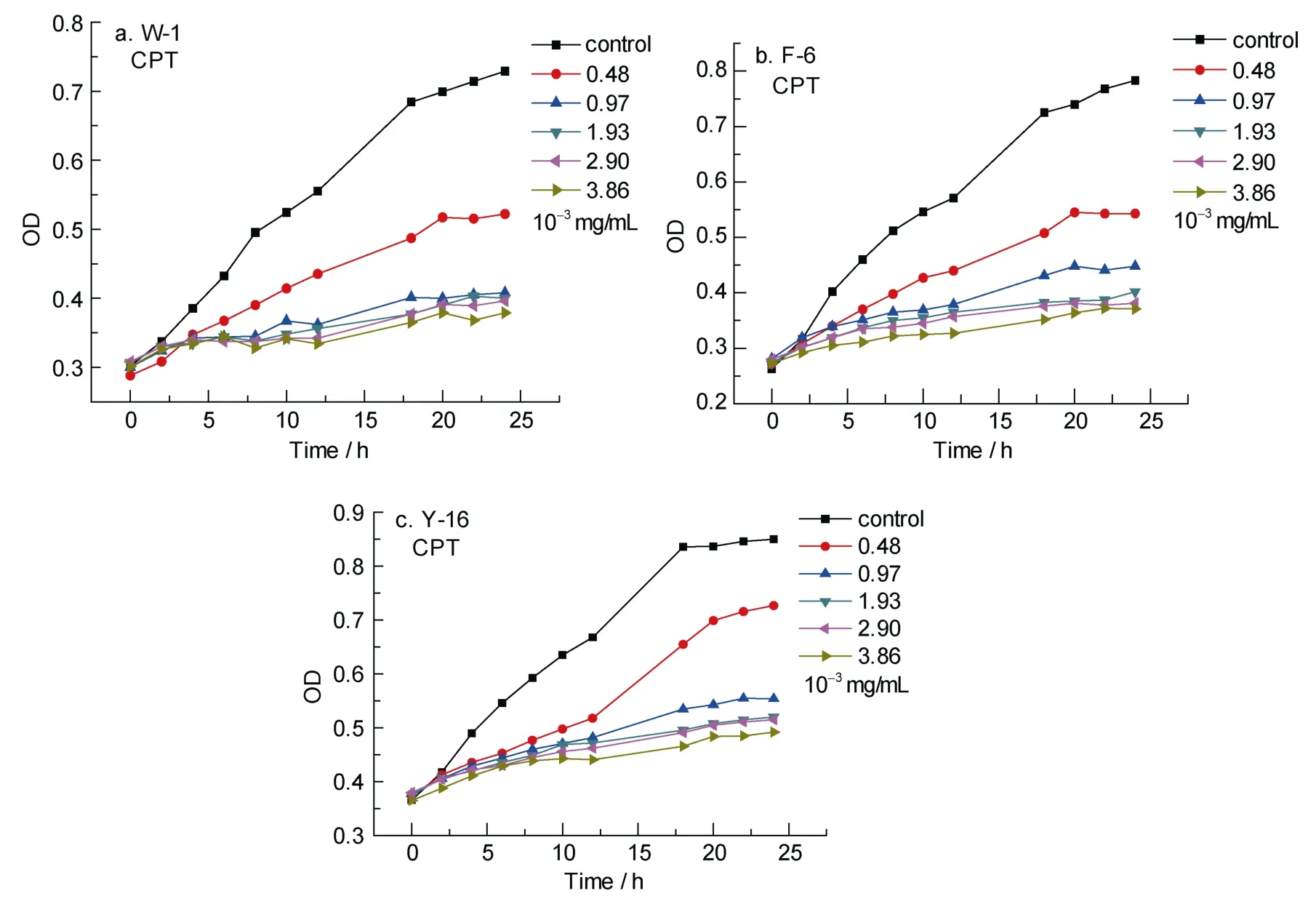
图4 CPT对三种受试菌生长曲线的影响Fig.4 The influence of CPT on the growth curve of three test bacteria
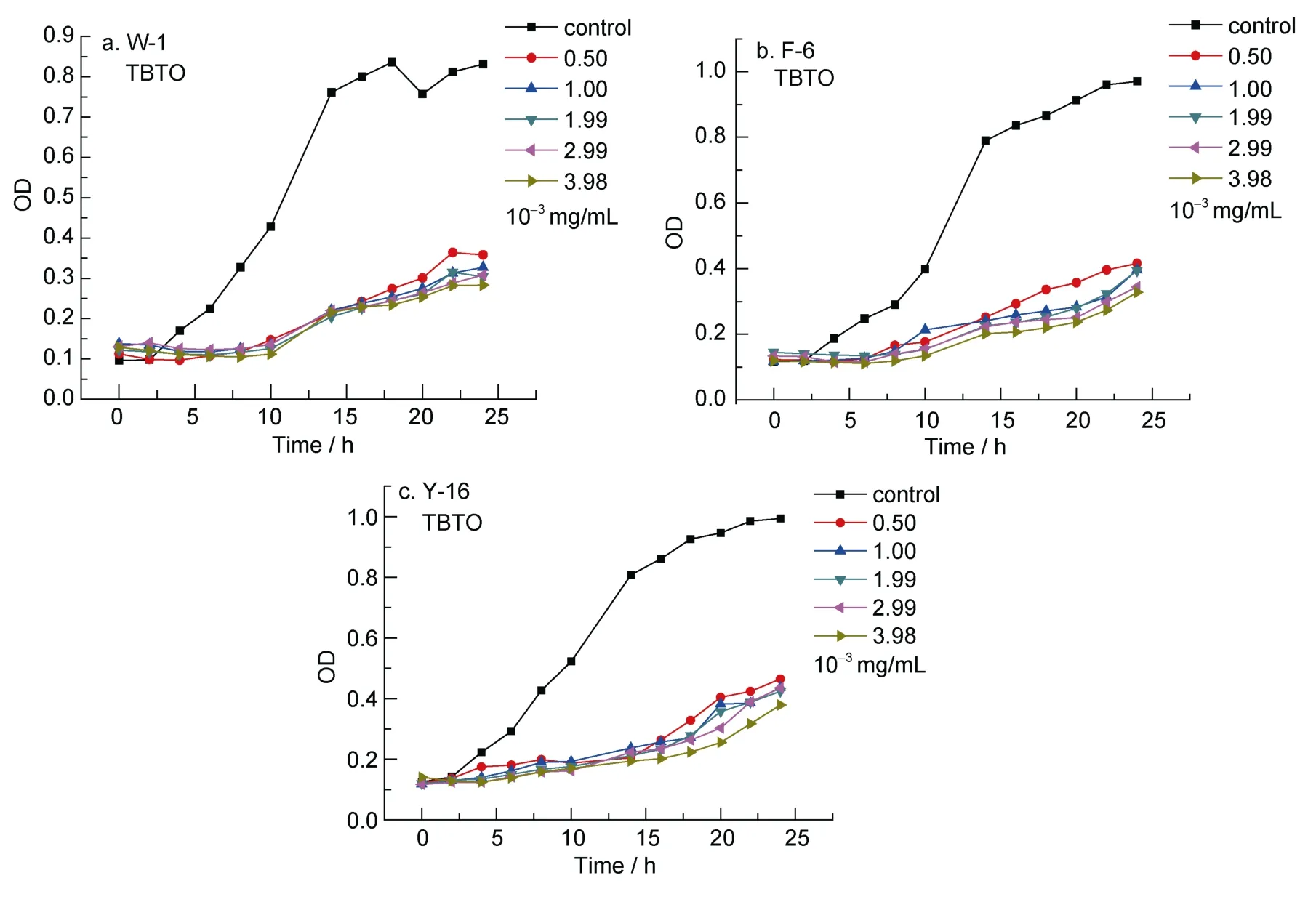
图5 TBTO对三种受试菌生长曲线的影响Fig.5 The influence of TBTO on the growth curve of three test bacteria
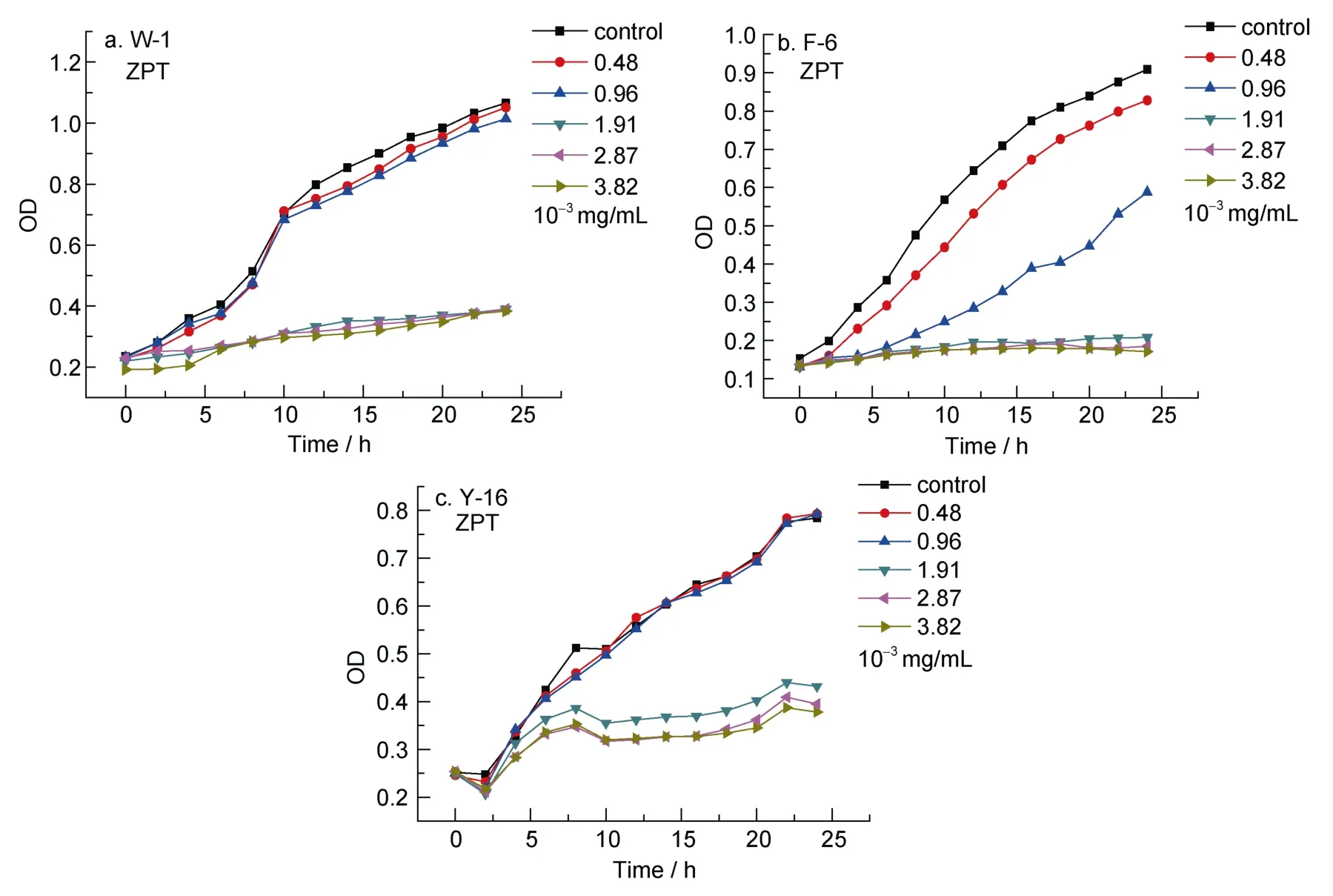
图6 ZPT对三种受试菌生长曲线的影响Fig.6 The influence of ZPT on the growth curve of three test bacteria
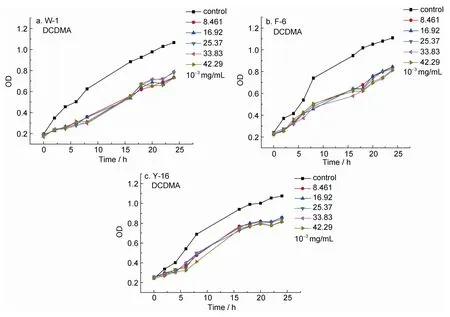
图7 DCDMA对三种受试菌生长曲线的影响Fig.7 The influence DCDMA on the growth curve of three test bacteria
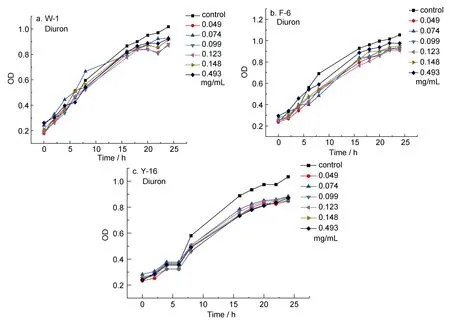
图8 Diuron对三种受试菌生长曲线的影响Fig.8 The influence of Diuron on the growth curve of three test bacteria
对于 CPT,整体来看,其抑菌性随浓度增加而增加。但是,当浓度达到 0.97×10–3mg/mL后,继续增大浓度,抑菌效果仅有轻微增加;并且随时间延长,受试菌呈平稳生长状态;对于 TBTO,在各个试验浓度下,均表现出了很好的抑菌效果,且浓度变化对抑菌效果影响不大。但随时间的延长,在 17.5h时,受试菌生长速率明显加快,这或许和细菌的生长周期有关;对于 ZPT,在浓度低于 1.91×10–3mg/mL 时,抑菌效果不是太明显,当浓度达到1.91×10–3mg/mL时,才表现出明显的抑菌性,继续增大浓度对其影响不大。
由图6可以看出,当溶液浓度达到8.46×10–3mg/mL时,DCDMA才对三种受试菌表现出轻微的抑制作用,但当浓度继续增加时,抑菌效果并没有增加,这可能是因为溶液中的DCDMA已达到饱和状态。相较于前三种防污剂,DCDMA的防污效果并不十分显著。
由图8中 3种受试菌的生长曲线可以看出,Diuron对海洋细菌的正常生长几乎没有影响,当浓度高达 0.493mg/mL时,依然没有明显抑制作用。印证了前面室内挂板的结果。
几种防污剂的抑菌机理可作如下解释:对于金属盐类配合物,配合物中心的金属离子带有正电荷,当微量金属离子接触到微生物的细胞膜时与带负电荷的细胞膜发生库仑吸引,金属离子穿透细胞膜进入细胞内与微生物体内蛋白质上的巯基氨基等发生反应,使蛋白质被破坏造成微生物死亡或丧失分裂增殖能力(安燕等,2012)。如,ZPT可与释放出的铜离子结合转变为活性更强的铜配合物。DCDMA主要为破坏微生物间的信息传递,使其无法聚集成膜,而破坏其繁衍,从而达到抑菌的目的。
几种防污剂针对三种海洋细菌的最小有效浓度如下表1所示。通常情况下,对于MIC法,OD值与空白对照的差距约在0.3以上(Evaet al,2008),即可作为最低有效浓度。
从表1可以看出,TBTO对三种受试菌的MIC非常小,且均为0.5×10–3mg/mL;CPT对W-1和F-6的MIC为 0.97×10–3mg/mL,对 Y-16 的 MIC 为 1.93;ZPT 对W-1和Y-16的MIC为1.91×10-3mg/mL,对F-6的MIC为 0.96×10–3mg/mL;DCDMA 对 W-1 和 F-6 的 MIC为 8.46×10–3mg/mL,对 Y-16 的 MIC 为 42.29mg/mL。其中CPT和ZPT具有相似的化学结构,所以抑菌效果也更为接近且较为显著;DCDMA具有一定的抑菌效果,但效果低于三丁基氧化锡和吡啶硫酮金属盐类防污剂;Diuron是一种除藻剂而非杀菌,对此三种海洋细菌基本没有抑制作用。几种防污剂的防污效果如下:TBTO> CPT>ZPT>DCDMA>Diuron。同时,已知菌种W-1和F-6为两种革兰氏阴性菌,Y-16为革兰氏阳性菌,整体(除防污剂ZPT对W-1的MIC较大外)看以得出,几种防污剂对两种革兰氏阴性菌的MIC 值更小,对其抑制作用更为敏感。这可能是因为革兰氏阳性菌要比阴性菌壁厚,防污剂不易破坏其生物结构。

表1 几种防污剂的MICTab.1 The MIC of each antifoulant
几种防污剂对三种海洋细菌的生长曲线的影响与室内挂板的结果是一致的,因此,以海洋细菌为受试微生物在海水中人工加富浓度,以含防污剂凝胶测试板进行室内摸拟浅海挂板的防污剂评价方法具有可行性。对于海洋防污涂料的开发,尤其是防污剂的筛选评价以及缩短海洋防污剂开发周期具有重要意义。
2.3 室内短期挂板在非溶解性防污剂评价中的应用
四种不同粒径的微/纳米 Cu2O粉末制备的测试板24h挂板后的结果如图9所示。
由图9可见,对于不同粒径的氧化亚铜来说,粒径越细其抑菌性越好,这与文献所述一致(高红秋等,2008)。因而采用以海洋细菌为受试微生物,在海水中人工加富浓度,并且制备凝胶测试板进行室内模拟浅海挂板的方法,对不同粒径氧化亚铜等溶剂不溶性化合物的防污性评价,同样具有可行性。
3 结论
本课题对海洋防污剂的评价具有一定的创新性。研究中用海区优势海洋细菌作为受试生物,在室内用天然海水人工加富的方法模拟海上挂板,从而对防污剂进行快速有效评价。其中,研究采用凝胶层模拟防污涂层,此法更加方便快捷;室内短期挂板采用海区优势代表性菌种在海水人工加富浓度,能更好的模拟复杂的海水环境,而且方法简便快速。评价试验相当于在含高浓度优势菌种的实海中进行,因而评价结果更加可靠。将测定OD-t生长曲线的方法应用到溶剂可溶性防污剂的评价中,操作快速且灵敏度极高,且与防污剂室内短期挂板结果具有一致性,因而可作为辅助评价方法。
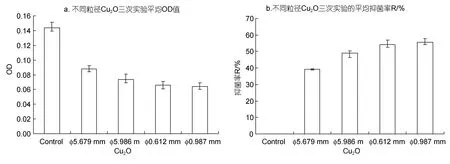
图9 微/纳米Cu2O –凝胶测试板室内挂板结果Fig.9 Results of indoor testing on micro/nano-Cu2O–agar gel panels
测定 OD-t生长曲线的方法,在杀菌剂的检测中已经得到应用(孙世春等,1999;陈默等,2009)。此法在本研究中作为一种辅助方法,不但对防污剂的防污效果做出了定量的大小比较,而且对防污剂在实际防污涂料中的用量问题,给予一定的参考值。室内短期挂板实验,采用几种菌在海水中混合培养的人工加富浓度模式,与实海(浅海挂板)情况更接近,比测试单一某种菌种的抑菌性更具实际意义,且其 24h抑菌率与 OD-t生长曲线法所得结果一致。因此,本研究方法对于海洋防污剂的评价具有可靠性。
马 勇,樊永军,2011.用 OD值监测产油酵母培养过程中的菌体生物量变化.安徽农业科学,39(12):7342—7343,7346
田 斌,2005.海洋防污涂层生物学性能研究.中国海洋大学硕士论文
丛巍巍,于良民,姜晓辉等,2011.新型防污剂的合成、生物毒性以及防污性能的研究.材料导报 B:研究篇,25(2):37—41
乔 军,孟庆龄,贾桂珍,1996.运用 OD 值法进行细菌计数的研究.中国家禽,(4):26—27
孙世春,赵锡光,孙建华等,1999.异硫氰酸苄酯(BITC)防污损效果研究——对 3种海洋细菌的抑菌作用.海洋科学,(2):49—51
杨 浩,王春婷,吴玉梅等,2002.细胞特性状态及细胞数与OD值的关系探讨.动物医学进展,23(5):49—51
陈 默,王志伟,胡长鹰等,2009.酶标仪法快速评价香兰素的抑菌活性.食品与发酵工业,35(5):63—66
郑兆祥,袁 扬,陈蒙蒙等,2011.舟山海域海泥细菌的分离及抗水产病原弧菌的筛选.浙江海洋学院学报(自然科学版),30(1):51—55,90
段东霞,2011.污损生物附着机理及酶在生物防污中的应用.海洋科学,35(7):107—112
胥 震,欧阳清,易定和,2012.海洋污损生物防除方法概述及发展趋势.腐蚀科学与防护技术,4(3):192—198
倪春花,于良民,赵海洲等,2009.防污涂料及其防污性能的评价方法.上海涂料,48(1):29—32
徐焕志,2006.含辣素衍生结构的丙烯酞胺单体与聚合物的合成及其海洋防污应用性能研究.青岛:中国海洋大学博士论文
高秋红,于良民,赵 静等,2008.纳米氧化亚铜的制备及其在防污涂料中的应用.上海涂料,46(12):30—32
黄宗国,蔡如星,1984.海洋污损生物及其防除(上册).北京:海洋出版社,20—32
Antizar-Ladislao B,2008.Environmental levels,toxicity and human exposure to tributyltin(TBT)-contaminated marine environment.J Environ Int,34(2):292
ASTM D,1993.Standard method for testing antifouling panels in shallow submergence.American Society for Testing and Materials,3623—78a
Chambers L D,Stokes K R,Walsh F Cet al,2006.Modern approaches to marine antifouling coatings.Surface &Coatings Technology,201:3642 — 3652
Diego M Y,Søren K,Kim D,2004.Antifouling technology-past,present and future steps towards efficient and environmentally friendly antifouling coatings.Progress in Organic Coatings,50:75—104
Eva B,Tingting D,Ronald J Wet al,2008.An explanation for the effect of inoculum size on MIC and the growth/no growth interface.International Journal of Food Microbiology,126(1—2):140—152
Hellio C,De La Broise D,Dufossé Let al,2001.Inhibition of marine bacteria by extracts of macroalgae:potential use for environmentally friendly antifouling paints.Marine Environmental Research,52(3):231—247
Mao Z J,Yu L,You Z Qet al,2007.Cloning,expression and immunogenicty analysis of five outer membrane proteins ofVibrio parahaemolyticuszj2003.Fish &Shellfish Immunology,23(3):567—575
Maraldo K,Dahllof I,2004.Indirect estimation of degradation time for zinc pyrithione and copper pyrithione in seawater.Marine Pollution Bulletin,48:894—901
Marion G,Stéphane Fet al,2008.Tetrazolium salts for MIC determination in microplates:Why? Which salt to select?How?.Journal of Microbiological Methods,75:156—159
Mirren C,Marcus T,Canet A,2011.Designed polymer structures with antifouling—antimicrobial properties.Reactive &Functional Polymers,71:329—334
Okamura H,Watanabe T,2002.Toxicity evaluation of new antifouling compounds using suspension—cultured fish cells.Chemosphere,46:945—951
Philippe J,Culioli G,Hellio Cet al,2004.Seasonal variation in antifouling activity of crude extracts of the brown algaBifurcaria bifurcata(Cystoseiraceae) against cyprids ofBalanus amphitriteand the marine bacteriaCobetia marinaandPseudoalteromonashaloplanktis.Journal of Experimental Marine Biology and Ecology,313(1):47—62
Swain G W,Schultz M P,1996.The testing and evaluation of nontoxic antifouling coatings.Biofouling,10:187—197
WHOI,1952.Marine Fouling and its Prevention.United States Naval Institute,Annapolis,388
