寄生性病原血卵涡鞭虫(Hematodinium sp.)感染山东半岛养殖梭子蟹的初步研究*
2014-03-09李才文宋书群王金凤
李才文 宋书群 刘 云 王金凤, 肖 洁
(1.中国科学院海洋研究所海洋生态与环境科学重点实验室 青岛 266071;2.中国科学院大学 北京 100049;3.国家海洋局第一海洋研究所 青岛 266061)
Hematodinium是一类感染海水甲壳类的寄生性甲藻(parasitic dinoflagellates)(Stentifordet al,2005;李才文等,2013)。目前,该类寄生性病原已经在 20多种螃蟹、1种对虾、1种龙虾和10多种端足类动物中被报道发现(Shields,1994;许文军等,2010;李才文等,2014),已先后在法国、英国、加拿大、澳大利亚和美国等国家近海海域大范围流行,严重影响了挪威龙虾(Nephrops norvegicus)、美国兰蟹(Callinectes sapidus)、蛛雪蟹(Chionoecetes opilio)、白氏雪蟹(C.bairdi)等多种重要经济甲壳类的渔业生产(Meyerset al,1987;Fieldet al,1992;Messicket al,2000;Stentifordet al,2002,2003,2005;Sheppardet al,2003)。
近年来,血卵涡鞭虫(Hematodiniumsp.)先后在我国浙江舟山、宁波和台州海域的海捕和养殖三疣梭子蟹(Portunus trituberculatus)(许文军等,2007a)、锯缘青蟹(Scylla serrata)(许文军等,2007b)、养殖脊尾白对虾(Exopalaemon carinicauda)(Xuet al,2010)和广东省汕头海域低盐养殖的锯缘青蟹(Liet al,2008)中被发现和报道,并已确定该寄生性病原是近年来引起舟山群岛海水养殖三疣梭子蟹大规模死亡“牛奶病”和青蟹“黄水病”的主要病原之一。三疣梭子蟹也是山东半岛海水养殖的重要经济物种,2009年山东半岛养殖三疣梭子蟹产量达 3万吨,约占全国总产量的三分之一(中国渔业年鉴,2010)。
虽然此前,山东半岛尚未有寄生性病原Hematodinium感染三疣梭子蟹的报道,而自 2011年秋季起,山东省胶南市的三疣梭子蟹养殖区内发现个别养殖池的梭子蟹由于未知原因而大规模死亡。因此,我们在2012年 7—11月间,对于胶南市海州湾和烟台市莱州湾的养殖和海捕梭子蟹进行了随机取样检测,并进行了人工感染实验。经病原、组织病理、电镜观察和分子生物学鉴定,我们在该区域首次发现了血卵涡鞭虫(Hematodiniumsp.)感染;并且,该寄生性病原能够感染健康梭子蟹并导致典型组织病理变化。进一步分析表明,在山东半岛周边海域发现的Hematodinium与在我国东南沿海一带发现的Hematodinium有很近的遗传关系。本研究显示寄生性病原(Hematodiniumsp.)在我国沿海地区的重要经济甲壳类中有广泛的分布,考虑其对经济甲壳类的危害,其传播、发生机制应该引起足够的重视。
1 材料和方法
1.1 材料来源
梭子蟹样品(Portunus trituberculatus)于2012年7—11月间分别随机采集自山东省胶南市海州湾和烟台市莱州湾的养殖池中或者从水产市场上购买的源自邻近海域的野生梭子蟹(图1)。螃蟹均无明显发病症状,个体体长13—16cm,体重108—220g。样品置于低温冷藏箱中及时运回实验室,暂养于装配循环水和充气系统的玻璃缸中(温度18—22°C,盐度25—27),直至样品处理或进一步实验。

图1 山东半岛三疣梭子蟹取样站点示意图Fig.1 Sampling sites of Chinese swimming crab P.trituberculatus in Shandong Peninsula,China
1.2 血淋巴检测
参照 Stentiford等(2005)的方法对螃蟹样品寄生性病原Hematodinium的感染情况进行检测。具体步骤如下:用一次性 1mL注射器(27号针头)从第五步足与蟹体的软组织结合处无菌抽取约 250μL血淋巴,滴~50μL在载波片上并与等体积的中性红溶液(0.04%w/v,1×PBS)混匀,盖上盖波片于显微镜下观察并拍照(Olympus BX53,DP73数码镜头)。Hematodinium细胞能够主动吸收中性红,其溶酶体被染色而呈亮红色;有些濒死血淋巴细胞内的颗粒物有时也会被染成暗红色,然而其染色颗粒大小显著小于Hematodinium细胞内染色的溶酶体。剩余的血淋巴(~200μL)经 100% 酒精固定后于-20°C 保存用于DNA提取和分子生物学检测。
1.3 感染实验
共 12只经血淋巴检测和 PCR检测(方法见 1.4)诊断没有Hematodinium感染的螃蟹暂养在两个配有生物滤器和紫外消毒装置的 300L玻璃缸中(盐度 25—27,温度 17—19°C),用于人工感染实验。从感染Hematodinium的螃蟹中抽取血淋巴,通过显微计数,估算血淋巴中Hematodinium细胞浓度,并用PBS缓冲液稀释终浓度至约106cell/mL作为注射液;将受试螃蟹第五步足和蟹体软组织结合处用酒精(70%)擦拭干净,小心注入100µL注射液(大约105Hematodinium细胞)。实验期间(共 10天),每天定时投喂蛤蜊肉一次,并观测评估螃蟹生活状况,及时取出濒死螃蟹进行组织病理样品采集(详细步骤见1.5)。注射感染后第10天,存活的螃蟹经解剖、取样处理后用于组织病理诊断(见 1.5)。
1.4 组织病理和电镜检测
解剖梭子蟹样品,取肝胰腺、心脏、鳃丝、上皮组织和肌肉等组织块于 10%海水福尔马林固定,48h后转移到 70%酒精中长期保存或进行下一步处理;参考Wheeler等(2007)的样品处理和石蜡切片技术处理固定样品,而后经系列脱水后进行 H&E(hematoxylin and eosin)染色,切片经盖片、封片后于显微镜下观察螃蟹组织病理变化并拍数码照片。
从重度感染Hematodinium的螃蟹中抽取血淋巴,低速离心沉降(400r/min)弃上清液,加入 10倍体积2.5%戊二醛(0.1mol/L PBS,pH7.4)于冷藏条件下(4°C)固定24h以上,直至进一步样品处理;另取小块肝胰腺组织(0.5—1mm3),按类似方法固定处理。参考姜明等(1996)方法进一步处理固定样品,经锇酸固定,梯度乙醇脱水,Epon812包埋,超薄切片染色后,用日立 H-7000透射电镜(中国海洋大学测试中心)观察并摄影。
1.5 分子生物学检测
按照E.Z.N.ATMTissue DNA kit(Omega Bio-Tek,USA)的说明书从酒精固定的血淋巴中提取样品基因组DNA,分别采用针对HematodiniumrRNA基因间的内转录第1间隔区(internal transcribed spacer 1,ITS 1)的特异性引物(正向引物:5′GTTCCCCTTGAACG AGGAATTC 3′,反向引物:5′CGCATTTCGCTGCG TTCTTC 3′,Hudsonet al,1994)和针对小亚基(SSU)完整序列的特异性引物(正向引物:5′CTGCCAGTA GTCATATGC 3′;反向引物:5′CACGGTGAATGTTT GTGTGTGAA 3′,Smallet al,2012),在 Mastercycler®pro thermocycler PCR仪上(Eppendorf,Germany)进行扩增检测样品是否感染Hematodinium,并进一步分析其遗传关系。PCR反应体系包括:1μL(10—50ng)DNA 模板,引物各 2μL(终浓度 2μmol/L),12.5μLPCR 混合液(Dongsheng Biotech,Guangzhou,China)和 7.5μL 超纯去离子水,共 25μL。ITS 1 PCR反应条件如下:94°C 预变性 5min,94°C 变性30s→56°C退火 30s→72°C延伸 1min,35个循环后,再72°C延伸5min;SSU PCR反应条件如下:94°C预变性 5min,94°C 变性 1min→58°C 退火 1min→72°C延伸 1min,共 30个循环后,再 72°C延伸 5min。扩增产物经琼脂糖凝胶电泳(1.5%w/v)、溴化乙啶(ethidium bromide)染色后于紫外灯下观察并拍照(Tannon 3500凝胶成像系统)。
1.6 分子测序和遗传学分析
上述 PCR扩增产物(ITS 1和 SSU)经 TaKaRa MiniBest DNA 提纯试剂盒(Ver.3.0)(TaKaRa,China)纯化后,送上海美吉生物医药科技有限公司用上述特异性引物进行双向测序。所得序列通过 BLAST(basic local alignment search tool)与NCBI(National Center for Biotechnology Information)GenBank中的相应序列进行比较分析,并选取代表性序列(序列号:DQ925231-925234,EF065714-065716,EF065718,EF-153724-153726,EF173451-173454,FJ844430-844431),运用 MacVector 12.6(MacVector Inc.,Carey,NC)的CLUSTALW 算法进行序列比对分析。并根据 Small等(2012)的分析结果,从核苷酸排列矩阵中,提取含有344bp的ITS-1序列,运用MEGA 5(Tamuraet al,2011)分析软件进行遗传相似性分析。
2 结果
2.1 血卵涡鞭虫感染情况
经血淋巴和 PCR方法检测,自山东省胶南市海州湾养殖区采集的20只养殖三疣梭子蟹中有三只确定为Hematodinium感染,其中两只为重度、一只为中度感染;源于周边海域的 20只野生三疣梭子蟹中则未发现感染。而在烟台市莱州湾的养殖池中养殖区采集的 20只养殖三疣梭子蟹中,发现一只重度感染Hematodinium的三疣梭子蟹,从水产市场上购买的源自邻近海域的 20只野生梭子蟹中也未发现Hematodinium感染。
在注射感染的 12只梭子蟹中,有两只在注射后两天内死亡,经血淋巴检测和PCR检测确认未发现Hematodinium感染,但发现体液中有大量细菌,这些梭子蟹可能是由于注射过程中细菌侵入宿主体内而导致死亡。到注射后第 8天开始有梭子蟹死于Hematodinium感染,实验结束时共有 8只螃蟹确诊被Hematodinium感染,存活率为33.3%(图2)。
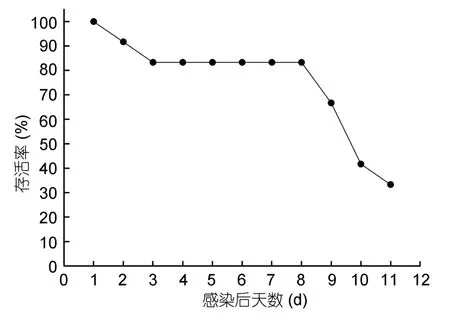
图2 三疣梭子蟹人工感染Hematodinium sp.实验结果Fig.2 Survival of Chinese swimming crab P.trituberculatus artificially infected with Hematodinium sp.
2.2 血卵涡鞭虫的常见形态
本次调查中采集的梭子蟹,包括四只确认感染Hematodinium的梭子蟹,都没有像其他宿主蟹虾类感染Hematodinium后所表现的诸如体表暗淡或呈黄红色等外部发病症状,只是感染Hematodinium的梭子蟹的血淋巴明显稀薄而不能像健康梭子蟹的血淋巴一样能够瞬间凝固。在染病梭子蟹的血淋巴中共发现Hematodinium的四种生活史形态:丝状滋养体(filamentous trophont)、单细胞滋养体(uninucleate trophont)、滋养体聚合体(trophont clumps)和多核孢子体(multinucleate sporonts)(图3)。Hematodinium不同生活史阶段的大小差异很大,例如单细胞营养体的直径范围为 9—15μm,其大小与宿主的血细胞接近,而丝状营养体和多核孢子体则是宿主血细胞大小的3—5倍以上。

图3 感染Hematodinium sp.三疣梭子蟹的血淋巴中不同生活史阶段的显微形态Fig.3 Hematodinium parasites in hemolymph of diseased Chinese swimming crab P.trituberculatus
2.3 组织病理变化
Hematodinium感染导致梭子蟹肝胰腺、心脏、鳃丝、上皮组织等组织出现明显病理变化,尤其是肝胰腺和心脏。重度Hematodinium感染的梭子蟹,其肝管结缔组织间隙和血窦处内均充满大量寄生虫,肝小管有序的排列方式由于间隙寄生虫的大量增殖、挤压而改变,其上皮组织与结缔组织间的清晰界限也由于病原的侵入而变模糊(图4a)。感染Hematodinium梭子蟹的心肌也由于寄生虫的增生、侵入而变形、断裂,心肌层间的结缔组织也空泡化甚至丧失,导致肌纤维原本密实的结构变得松散破碎(图4b)。

图4 感染血卵涡鞭虫(Hematodinium sp.)三疣梭子蟹的组织病理变化Fig.4 Histopathology of Chinese swimming crab P.trituberculatus infected with Hematodinium sp
2.4 电镜观察
在山东半岛梭子蟹养殖区发现的Hematodiniumsp.的超微结构与在浙江舟山群岛发现的Hematodiniumsp.的超微结构类似。该寄生性病原的染色体呈浓缩状态分布于细胞核内,形成甲藻类特有的间核结构;细胞质内也发现脂肪粒,线粒体等细胞器;囊泡膜结构(alveolar membrane)下面分散着不规则空泡结构。然而,我们并没有在这种Hematodiniumsp.的电镜观察中发现模式种Hematodinium perezi所报道发现的刺丝泡(trichocyst)结构和顶复虫门类(Apicomplexans)特有的微孔结构(micropores)(图5)。

图5 染病三疣梭子蟹血淋巴中Hematodinium sp.的超微结构Fig.5 General ultrastructure of Hematodinium cells in hemolymph of infected Chinese swimming crab P.trituberculatus.
2.5 分子生物学鉴定及遗传学分析
本研究获得的Hematodiniumsp.的 RNA小亚基(SSU)序列(~1750bp)与已发表的Hematodinium的相应序列完全一致(GenBank No.EF065718)。利用Hudson 等(1994)设计的特异性 PCR 引物,从感染Hematodiniumsp.的血淋巴样品中扩增出约630bp的产物,该片段包含部分SSU序列,完整ITS 1区和部分5.8S序列,其中ITS 1区长度为344bp。通过ITS 1序列比对,在山东半岛报道发现的Hematodiniumsp.有三种不同的基因类型,第一种在 88号位点有4碱基插入,第二种在145号位点有1个碱基插入,第三种在105号位点有碱基转换(T→C)。与在浙江舟山海域发现报道的Hematodiniumsp.的相应序列(Genbank Nos.EF173451—173454)比较,第二、三种基因型此前已有报道,而第一种为新发现基因型,遗传分析表明其与浙江海域发现的Hematodiniumsp.亲缘关系较近(99%相似度);与在欧洲(GenBank Nos.EF065714—065716,EF153724—153726)和北美(GenBank Nos.DQ925231—925236,FJ844430—844431)报道发现的Hematodinium perezi的相应序列有95%的相似度。基于ITS 1序列的遗传进化分析表明,在我国报道发现的Hematodiniumsp.在分子进化树中组成单源支,与在欧洲和北美发现的Hematodinium perezi形成亲缘关系密切的姊妹支(图6)。

图6 我国发现的寄生性病原Hematodinium与在欧洲和北美洲发现的Hematodinium种的遗传关系分析Fig.6 Molecular phylogenetic anaylsis of Hematodinium sp.identified in China based on genetic distances analysis of the first internal transcribed spacer(ITS1)of rDNA
3 讨论
寄生性病原血卵涡鞭虫(Hematodiniumspp.)是近年来在世界范围内危害经济甲壳类的主要病原之一,其显著影响与危害堪与对虾科(Penaeidae)中流行的白斑综合症病毒病(white spot syndrome virus,WSSV)和龙虾科(Palinuridae)中频繁发病的高夫败血症(Gaffkemia disease)相提并论(Stentifordet al,2005);鉴于其对于经济甲壳类的危害,Hematodinium也被认为是一类非典型有害藻华甲藻类(Burkholderet al,2006;Frischeret al,2006)。自2004年报道发现以来,该寄生性病原对我国东南沿海几种主要养殖蟹虾类的流行性发病逐渐引起研究者的重视;然而在北方蟹虾类主要养殖区(包括山东省)此前尚未有关于该寄生性病原感染养殖蟹虾的报道。本研究首次在山东半岛发现了Hematodinium感染养殖梭子蟹,表明该寄生性病原在我国沿海地区有更广的地理分布,其对我国沿海虾蟹类养殖业的危害应得到充分的重视;并且为防止该类病原性病原的继续扩散,其来源及传播扩散方式等亟需进一步调查研究。
关于感染养殖虾蟹的Hematodinium病原来源,是关系到如何防治该病害的关键性问题之一。2004年以来,该寄生性病原相继在我国东南沿海的养殖梭子蟹和锯缘青蟹中被报道发现(许文军等,2007a,b;Liet al,2008),之后又在与梭子蟹混合养殖的脊尾白虾中发现Hematodinium感染(Xuet al,2010),本研究又在我国北方梭子蟹养殖区发现了Hematodinium感染。Hematodinium的宿主种类繁多,其中流行病的发生主要集中于多种野生的短尾亚目甲壳动物(蟹类)和一种龙虾,其它端足类宿主可能在传播扩散的过程起中间宿主或携带者的作用(Stentifordet al,2005)。然而,目前尚缺乏我国沿海一带野生蟹虾类中Hematodinium感染率的调查研究。尽管我们在山东半岛养殖区附近的野生梭子蟹进行了初步采样检测,可能受采样季节、数量或采样物种的影响,并没有在养殖区附近的野生梭子蟹中发现Hematodinium感染。因此,感染这些养殖虾蟹的Hematodinium来源还十分不清楚,有待于更进一步的详细研究。
三疣梭子蟹养殖在我国沿海地区的水产养殖业中占有很大比重,据《2010中国渔业年鉴》统计其养殖规模在在2009年达到44万亩,产量超过9.6万吨。为了高效率的饵料利用和经济产出,我国目前沿海大多数海水养殖区普遍采取多物种混合(polyculture system)或间期养殖(rotation culture)模式,例如虾类和贝类、虾类和鱼类、贝类和海参等(Wanget al,2004)一起养殖;有些养殖区还采取了蟹类与虾类的混合养殖模式,例如梭子蟹与脊尾白虾或斑节对虾等(浙江舟山、山东半岛等地区)。这种养殖模式对提高养殖水域的经济效率起到了重要作用;然而,这种高密度混合养殖模式有可能增加一些流行性病原(病毒、细菌、寄生虫等)在相近养殖物种之间的传播机率,从而使病原在新的宿主中传播扩散。例如,Xu等(2010)首次报道了我国浙江舟山养殖脊尾白虾受Hematodinium的感染,而导致大面积死亡;分子生物学研究表明,感染脊尾白虾的Hematodinium与同池混养的梭子蟹中的Hematodinium为同一种。目前缺乏对于流行性病原在这种养殖池中的传播和扩散等方面的研究,对于Hematodinium如何侵染新的宿主,以及是否在混养池外流行等问题还不清楚。这种生活史阶段或多宿主流行性病原可以在不同的养殖对象之间相互传播、扩散,为我们如何在实际生产过程中实现健康养殖提出了新的挑战。
寄生性病原血卵涡鞭虫(Hematodiniumspp.)传播扩散途径的相关研究一定程度上受限于对其复杂生活史认识的不足。迄今为止,尽管在超过 30多种甲壳动物中发现报道了Hematodinium感染,但只有从挪威龙虾和美国兰蟹中分离出来的Hematodinium种有完整的生活史研究(Appletonet al,1998;Liet al,2011),包括典型种H.perezi在内的其它种都没有生活史方面的系统研究。我国报道发现的Hematodiniumsp.也没有系统研究,在此前的文献报道中已经发现了孢子(dinospores),滋养体(trophonnts)和孢子体(sporonts)这几个阶段,然而并没有发现丝状滋养体(filamentous trophonts or plasmodia)这一阶段(许文军等,2007a,b;Liet al,2008;Xuet al,2010)。在我们取样的一只轻度感染的梭子蟹的血淋巴中,发现了形态多变的丝状滋养体阶段。尽管多数Hematodiniumspp.的生活史都至少包括孢子、滋养体和孢子体这几个阶段,然而不同宿主发现的Hematodinium种的生活史多有不同(Newmanet al,1975;Appletonet al,1998;Liet al,2011)。因此,有必要对我国发现的这种Hematodiniumsp.的生活史开展进一步研究,并深入探讨关键生活史阶段在其传播扩散过程中的作用。
目前正式命名的Hematodinium种只有两种:典型种Hematodinium perezi和H ematodinium australis,在我国发现的Hematodiniumsp.等其他未命名物种暂以Hematodiniumsp.或Hematodinim-like sp.来表示。本文分子测序结果显示,在山东半岛发现的Hematodinium的RNA小亚基序列与Genbank中的相应序列完全一致,其ITS 1序列有少数碱基差异。基于ITS 1序列的遗传关系分析显示,虽然在我国发现的Hematodinium的不同株系的 ITS1序列略有不同,但这些序列都归于同一基因型(Genotype II),并与在欧洲发现的基因型(Genotype I)和在北美洲发现的基因型(Genotype III)有较近的遗传亲缘关系,这些结果与 Small等(2012)建议的Hematodinium物种分类体系一致。然而,我国发现的这种Hematodinium的描述、正式命名及其与其他Hematodinium物种的遗传关系,尚需要更多的形态学描述、超微结构分析和其他基因信息的遗传学分析的支持才能最终确定。
中国农业部渔业局,2010.中国渔业年鉴.北京:中国农业出版社,1—129
许文军,绳秀珍,徐汉祥等,2007a.血卵涡鞭虫在养殖锯缘青蟹中的寄生.中国海洋大学学报,37(6):916—920
许文军,施 慧,徐汉祥等,2007b.养殖梭子蟹血卵涡鞭虫感染的初步研究.水生生物学报,31(5):27—32
许文军,谢建军,施 慧等,2010.池塘养殖脊尾白虾(Exopalaemon carinicauda)感染血卵涡鞭虫的研究.海洋与湖沼,41(3):396—402
李才文,许文军,2014.海水甲壳类寄生性病原Hematodiniumspp.研究进展.海洋与湖沼,45(1):1—10
姜 明,刘晓云,范瑞青,1996.蓝非鲫生活于不同渗透压下肾脏显微与超微结构变化的初步研究.水生生物学报,20(2):186—189
Appleton P L,Vickerman K,1998.In vitro cultivation and development cycle in culture of a parasitic dinoflagellate(Hematodiniumsp.)associated with mortality of the Norway lobster (Nephrops norvegicus)in British waters.Parasitology,116(2):115—130
Burkholder J M,Azanza R V,Sako Y,2006.The ecology of harmful dinoflagellates.In:Graneli E,Turner J T eds.Ecology of Harmful Algae.Springer-Verlag,Berlin:53—66
Field R H,Chapman C J,Taylor A Cet al,1992.Infection of the Norway lobsterNephrops norvegicusby aHematodiniumlike species of dinoflagellate on the west coast of Scotland.Diseases of Aquatic Organisms,13:1—15
Frischer M E,Lee R F,Sheppard M Aet al,2006.Evidence for a free-living life stage of the blue crab parasitic dinoflagellate,Hematodiniumsp..Harmful Algae,5(5):548—557
Hudson D A,Adlard R D,1994.PCR-techniques applied toHematodiniumspp.andHematodinium-like dinoflagellates in decapod crustaceans.Diseases of Aquatic Organisms,19:203—206
Li C,Miller T L,Small H Jet al,2011.In vitro culture and developmental cycle of the parasitic dinoflagellateHematodiniumsp.from the blue crabCallinectes sapidus.Parasitology,138(14):1924—1934
Li Y,Xia X,Wu Qet al,2008.Infection withHematodiniumsp.in the mud crabsScylla serratacultured in low salinity water in southern China.Diseases of Aquatic Organisms,82(2):145—150
Messick G A,Shields J D,2000.Epizootiology of the parasitic dinoflagellateHematodiniumsp.in the American blue crabCallinectes sapidus.Diseases of Aquatic Organisms,43(2):139—152
Meyers T R,Koeneman T M,Bothelho Cet al,1987.Bitter crab disease:a fatal dinoflagellate infection and marketing problem for Alaskan Tanner crabsChionoecetes bairdi.Diseases of Aquatic Organisms,3:195—216
Newman M W,Johnson C A,1975.A disease of blue crabs(Callinectes sapidus)caused by a parasitic dinoflagellate,Hematodiniumsp..Journal of Parasitology,61(3):554—557
Sheppard M,Walker A,Frischer M Eet al,2003.Histopathology and prevalence of the parasitic dinoflagellateHematodiniumsp,in crabs(Callinectes sapidus,Callinectes similis,Neopanope sayi,Libiniae marginata,Menippemer cenaria)from a Georgia estuary. Journal of Shellfish Research,22(3):873—880
Shields J D,1994.The parasitic dinoflagellates of marine crustaceans.Annual Review of Fishery Diseases,4:241—271
Small H J,Shields J D,Reece K Set al,2012.Morphological and molecular characterization ofHematodinium perezi(Dinophyceae:Syndininiales),a dinoflagellate parasite of the harbour crab,Liocarcinus depurator.Journal of Eukaryotic Microbiology,59(1):54—66
Stentiford G D,Evans M G,Bateman Ket al,2003.Co-infection by a yeast-like organism inHematodiniuminfected European edible crabsCancer pagurusand velvet swimming crabsNecora puberfrom the English Channel.Diseases of Aquatic Organism,54(3):195—202
Stentiford G D,Green M,Bateman K Set al,2002.Infection by aHematodinium-like parasitic dinoflagellate causes Pink Crab Disease(PCD)in the edible crabCancer pagurus.Journal of Invertebrate Pathology,79(3):179—191
Stentiford G D,Shields J D,2005.A review of the parasitic dinoflagellatesHematodiniumspecies andHematodinium-like infections in marine crustacea.Diseases of Aquatic Organism,66(1):47—70
Tamura K,Peterson D,Peterson Net al,2011.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods.Molecular Biology and Evolution,28(10):2731—2739
Wang R,Yan J,Zheng X,2004.Current status of polyculture and rotation culture in Chinese mariculture industry.Acta Oceanologica Sinica,23(3):505—512
Wheeler K N,Shields J D,Taylor D M,2007.Pathology ofHematodiniuminfections in snow crabs(Chionoecetes opilio)from Newfoundland,Canada.Journal of Invertebrate Pathology,95(2):93—100
Xu W,Xie J,Shi Het al,2010.Hematodiniuminfections in cultured ridgetail white prawn,Exopalaemon carinicauda,in eastern China.Aquaculture,300(1):25—31
