蒙药肝乐康胶囊的质量标准研究
2014-03-09包明兰巴根那白梅荣萨日古乐黑龙江中医药大学基础医学院哈尔滨150040内蒙古民族大学蒙医药学院内蒙古通辽08000
包明兰,巴根那,白梅荣,萨日古乐(1.黑龙江中医药大学基础医学院,哈尔滨 150040;.内蒙古民族大学蒙医药学院,内蒙古通辽 08000)
蒙药肝乐康胶囊是在传统验方地格达-4味汤基础上研制的复方制剂,由肋柱花、苦参、栀子、瞿麦等4味药组成,具有清“协日”、凉血、清糟归精、除“粘热”等功效,主要用于血热相搏、肝胆热、咽喉肿痛、口渴等证[1]。为有效控制其制剂质量,笔者采用薄层色谱(TLC)法对方中的肋柱花、苦参、栀子进行了定性鉴别;并采用高效液相色谱(HPLC)法对苦参的主要成分苦参碱与氧化苦参碱进行了含量测定。
1 材料
1.1 仪器
1260型HPLC仪,包括Openlab色谱工作站、G1315D检测器(美国Agilent公司);ISO9001型电子天平(上海蓝习实业有限公司);ZF-I型紫外灯(上海双旭电子有限公司);HHS21-4型电子恒温水浴锅(上海跃进医疗器械);KQ-200VDE型双频数控超声波清洗器(昆山市超生仪器有限公司)。
1.2 药品与试剂
肝乐康胶囊(乌兰浩特中蒙制药有限公司,批号:20120604、20120605、20120606);獐牙菜苦苷对照品(批号:0785-200203)、栀子苷对照品(批号:110749-200613)、苦参碱对照品(批号:0805-9703)、氧化苦参碱对照品(批号:0780-200004)均由中国食品药品检定研究院提供;硅胶G(青岛海洋化工有限公司);甲醇、乙腈为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 TLC鉴别
2.1.1 肋柱花的TLC鉴别[2]取本品内容物1.0 g,加25 ml甲醇,超声(功率:50 W,频率:45 kHz)处理50 min,滤过,滤液浓缩成1 ml,作为供试品溶液;另取缺肋柱花的阴性样品0.75 g,同法制成阴性对照溶液;精密称取獐牙菜苦苷对照品适量,加甲醇制成质量浓度为1.0 mg/ml的对照品溶液。照TLC法(2010年版《中国药典》)[3]试验,吸取上述3种溶液各5µl,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇(17 ∶3,V/V)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,于110 ℃加热至斑点显色清晰,置紫外光灯(365 nm)下检视。结果,供试品色谱中,在与对照品色谱相应的位置上显相同颜色斑点;阴性对照无干扰。肋柱花的TLC图见图1。
2.1.2 苦参的TLC鉴别[3-4]取本品内容物1.0 g,加10 ml三氯甲烷和0.2 ml浓氨试液,室温浸泡12 h,滤过,取滤液作为供试品溶液;另取缺苦参的阴性样品0.75 g,同法制成阴性对照溶液;精密称取苦参碱对照品适量,加三氯甲烷制成质量浓度为0.2 mg/ml的对照品溶液。照TLC法(2010年版《中国药典》)[3]试验,吸取上述3种溶液各6µl,分别点于同一硅胶G薄层板上,以甲苯-丙酮-甲醇(8 ∶3 ∶0.5,V/V/V)为展开剂,展开,取出,晾干,喷以稀氢氧化钾试液,于110 ℃加热至斑点显色清晰,置日光下检视。结果,供试品色谱中,在与对照品色谱相应的位置上显相同颜色的斑点;阴性对照无干扰。苦参的TLC图见图2。

图1 肋柱花的TLC图1.獐牙菜苦苷对照品;2~4.供试品;5.阴性对照Fig 1 TLC oflomatogonium.rotatum1.swertiamain control;2-4.test samples;5.negative control

图2 苦参的TLC图1.苦参碱对照品;2~4.供试品;5.阴性对照Fig 2 TLC ofSophora.flavescens1.matrine control;2-4.test samples;5.negative control
2.1.3 栀子的TLC鉴别[5-7]取本品内容物1.0 g,加50%甲醇10 ml,超声(功率:50 W,频率:45 kHz)处理40 min,滤过,取滤液作为供试品溶液;另取缺栀子的阴性样品0.75 g,同法制成阴性对照溶液;精密称取栀子苷对照品适量,加50%甲醇制成质量浓度为1.5 mg/ml的对照品溶液。照TLC法(2010年版《中国药典》)[3]试验,吸取上述3种溶液各5µl,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇(9∶3,V/V)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,于110℃加热至斑点显色清晰,置日光下检视。结果,供试品色谱中,在与对照品色谱相应的位置上显相同颜色的斑点;阴性对照无干扰。栀子的TLC图见图3。
2.2 含量测定
2.2.1 色谱条件 色谱柱:lnertsil NH2Columns C18(250 mm×4.6 mm,5 μm);流动相:乙腈-3%磷酸水-无水乙醇(80 ∶10 ∶10,V/V/V);流速:0.1 ml/min;柱温:30 ℃;检测波长:220 nm。
2.2.2 对照品溶液的制备[3]分别精密称取苦参碱对照品2.0 mg、氧化苦参碱对照品3.75 mg,加乙腈-无水乙醇(80 ∶20,V/V)制成苦参碱氧化苦参碱质量浓度分别为0.10、0.15 mg/ml的对照品溶液。
2.2.3 供试品溶液的制备[8-13]称取肝乐康胶囊内容物约0.3 g,精密称定,置具塞锥形瓶中,加0.5 ml浓氨试液和20 ml三氯甲烷,密塞,称定质量,超声(功率:50 W,频率:45 kHz)处理30 min,放冷,再次精密称定,用三氯甲烷补足减失的质量,摇匀,滤过,精密吸取续滤液5 ml,加于中性氧化铝柱(内径1 cm)上,依次以三氯甲烷、三氯甲烷-甲醇溶液(70 ∶30,V/V)各20 ml洗脱,合并洗脱液,回收溶剂,残渣加无水乙醇定容至10 ml,摇匀,即得。
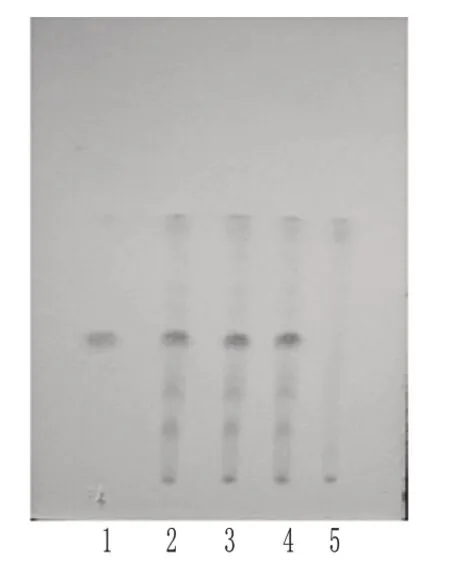
图3 栀子的TLC图1.栀子苷对照品;2~4.供试品;5.阴性对照Fig 3 TLC ofGardenia.jasminoides1.jasminoidin control;2-4.test samples;5.negative control
2.2.4 阴性对照溶液的制备 精密称取缺苦参的阴性对照品0.75 g,按“2.2.3”项下方法制备阴性对照溶液,即得。
2.2.5 空白干扰试验 精密量取上述对照品、阴性对照和供试品溶液各10 μl,按上述色谱条件分别进样测定,绘制HPLC图。结果表明,阴性对照对苦参碱和氧化苦参碱的测定无干扰。色谱见图4。
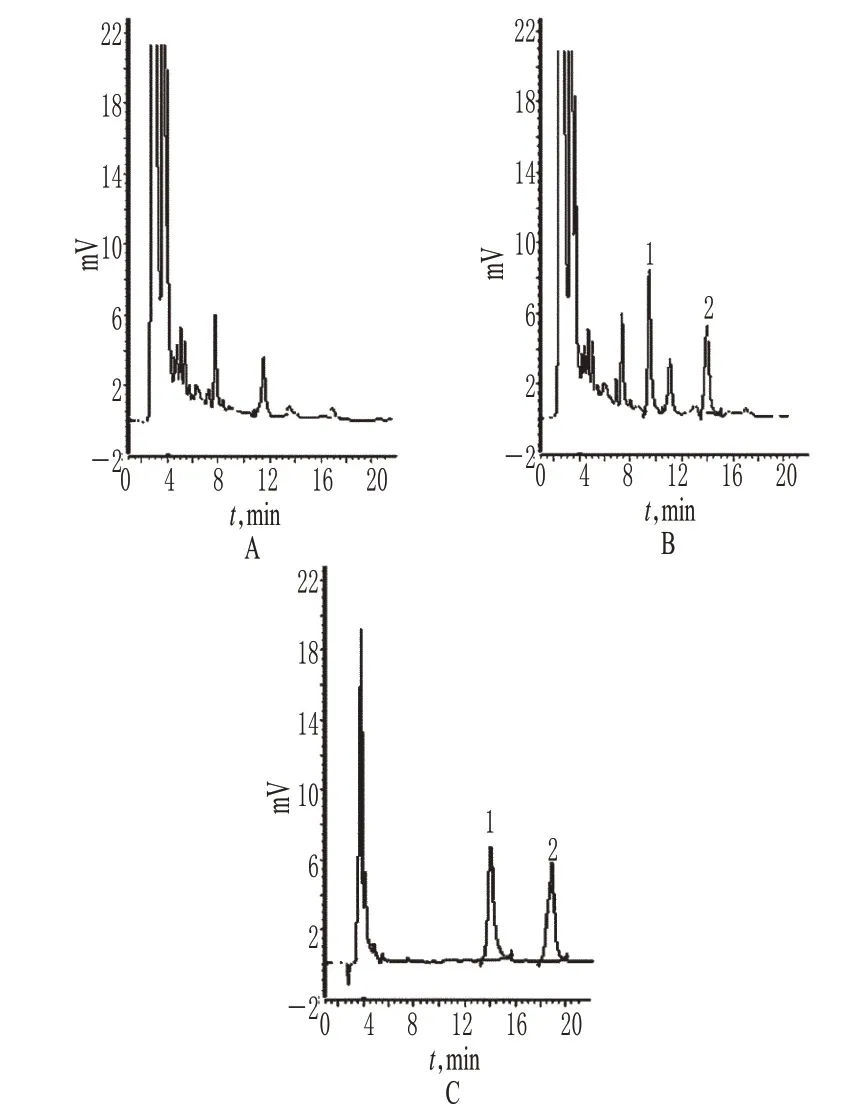
图4 高效液相色谱图A.供试品;B.对照品;C.阴性对照;1.苦参碱;2.氧化苦参碱Fig 4 HPLC chromatogramsA.test sample;B.substance control;C.negative control;1.matrine;2.oxymatrine
2.2.6 线性关系考察 精密吸取对照品溶液2、4、6、8、10、12 μl,按上述色谱条件进样测定,记录色谱图。以进样量(x,μg)为横坐标,峰面积积分值(y)为纵坐标,进行线性回归,得苦参碱的回归方程为y=30 975x-1 543.1(r=0.999 8)、氧化苦参碱的回归方程为y=55 915x-4 977.1(r=0.999 6)。结果表明,苦参碱和氧化苦参碱的进样量分别在0.2~1.2和0.3~1.8 μg范围内与峰面积积分值呈良好线性关系。
2.2.7 精密度试验 精密吸取对照品溶液10 μl,按上述色谱条件连续进样6次,记录峰面积。结果,苦参碱和氧化苦参碱的峰面积RSD分别为1.72%、0.35%(n均为6),表明仪器精密度良好。
2.2.8 稳定性试验 取同一供试品溶液,分别于0、4、8、12、24、36、48 h按上述色谱条件进样测定,记录色谱图。结果,苦参碱和氧化苦参碱的峰面积RSD分别为0.32%、0.26%(n=7),表明供试品溶液在48 h内稳定。
2.2.9 重复性试验 取同一批样品适量,按“2.2.3”项下方法平行制备6份供试品溶液,分别按上述色谱条件进样测定,记录峰面积。结果,苦参碱和氧化苦参碱峰面积的RSD分别为0.59%、1.14%(n=6),表明本方法重复性良好。
2.2.10 加样回收率试验 精密称取已知含量的同一批样品6份,分别精密加入适量的苦参碱和氧化苦参碱对照品,按“2.2.3”项下方法制备供试品溶液,再按上述色谱条件进样测定,记录色谱图并计算加样回收率,结果见表1。
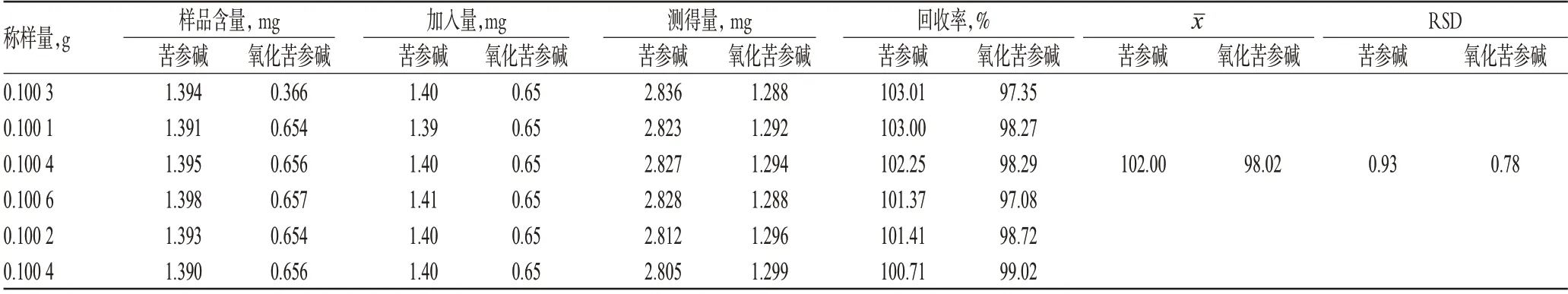
表1 加样回收率试验结果(n=6)Tab 1 Results of recovery tests(n=6)
2.2.11 样品含量测定 取3批样品各适量,分别按“2.2.3”项下方法制备供试品溶液,再按上述色谱条件连续进样3次,记录峰面积,并以外标法计算样品含量。结果,3批样品(20120604、20120605、20120606)中苦参碱的平均含量分别为13.79、13.78、13.76 mg/g,氧化苦参碱的平均含量分别为6.57、6.56、6.59 mg/g。
3 讨论
研究表明,肝乐康胶囊具有抗乙型肝炎病毒的作用[14],其中苦参为其重要药效成分[15],苦参提取物苦参碱和氧化苦参碱具有明显的抗乙型肝炎的作用,有效率可达55%[16]。为此,本试验除采用TLC法对方中的肋柱花、苦参和栀子进行定性鉴别外,还运用HPLC法对苦参的有效成分苦参碱和氧化苦参碱进行了含量测定,试验结果较理想,可为制订含苦参制剂的质量控制标准提供参考。
[1]中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准:蒙药分册[S].1998:91.
[2]太平,王霞.三种地格达类蒙药材的薄层鉴别实验[J].中国民族民间医药,2012(15):78.
[3]国家药典委员会.中华人民共和国药典:一部[S].2010年版.北京:中国医药科技出版社,2010:188、231、359.
[4]吕武清,龙新华.中成药中的药材薄层色谱鉴别[M].北京:人民卫生出版社,1994:356.
[5]巴根那,白明刚,包明兰.蒙药协日嘎四味汤剂的定性鉴别研究[J].中国实验方剂学杂志,2009,15(8):31.
[6]巴根那,包明兰,桂玲.蒙药胃舒安胶囊的质量标准研究[J].中国现代中药,2007,9(7):17.
[7]白明刚,巴根那,赵家栋,等.蒙药黄柏八味片的质量标准研究[J].中成药,2007,29(12):1 795.
[8]孟永梅,韩额尔德木图,孟根杜希.用正交试验设计优选苦参七味胶囊的提取工艺条件[J].国际中医中药杂志,2010,32(6):535.
[9]包明兰,巴根那,白梅荣.HPLC同时测定蒙药胃舒安胶囊中大黄素、大黄酸、大黄酚的含量[J].中国实验方剂学杂志,2013,19(6):96.
[10]孟根杜希,王伟,特木尔.HPLC法测定蒙成药苦参七味胶囊中苦参碱含量[J].中成药,2006,28(12):1 849.
[11]李毅,王飞,吴民.苦参药材质量标准研究[J].中成药,2011,33(2):363.
[12]萨日古乐,包明兰,白梅荣,等.HPLC法测定蒙药肝乐康胶囊中氧化苦参碱含量[J].北方药学,2012,9(9):1.
[13]刘永胜,陈华,金伟华,等.HPLC法测定抗病毒口服液中苦参碱的含量[J].中国药房,2012,23(4):371.
[14]白梅荣,巴根那,高玉峰.蒙药肝乐康胶囊剂抗乙型肝炎病毒体外实验研究[J].中华中医药学刊,2008,26(6):1 229.
[15]郑虎占,董泽宏,佘靖.中药现代研究与应用[M].北京:学苑出版社,1998:2 694.
[16]陈曙霞.苦参生物碱的药理研究进展[J].中成药,2003,25(1):75.
