魔芋葡甘低聚糖毒理学及肠道益生性评价
2014-03-08秦清娟徐小青
秦清娟,徐小青,张 媛,钟 耕,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
魔芋葡甘低聚糖毒理学及肠道益生性评价
秦清娟1,徐小青1,张 媛1,钟 耕1,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
目的:研究以半干法酶解制备的魔芋葡甘低聚糖(konjac oligosaccharides,KOS)的毒理学特性和肠道益生性。方法:以小鼠急性毒性实验,小鼠骨髓细胞微核实验和小鼠精子畸形实验对KOS急性毒性和遗传毒性进行研究、评价;通过小鼠盲肠内容物体外厌氧发酵评价KOS的肠道益生性。结果:KOS对雌、雄小鼠急性经口半致死量(LD50)均大于21 500 mg/kg,属无毒级;小鼠骨髓细胞微核实验及小鼠精子畸形实验均呈阴性;体外厌氧发酵实验表明KOS可被肠道菌群有效利用,明显增加肠道益生菌(双歧杆菌、乳酸菌)和短链脂肪酸的数量,而对大肠杆菌的增殖效果不明显。结论:KOS的安全性高,是一种功能显著的肠道益生元。
魔芋葡甘低聚糖;急性毒性;遗传毒性;肠道益生性
低聚糖(oligosaccharides)又称为寡糖,是2~10 个单糖连接而成为直链或支链低聚合度糖类的总称。随着人们健康意识的增强,营养科学和医药科学的发展,开发天然的功能性食品原料成为近年来的研究热点。低聚糖具有理化性质稳定、无污染、无残留、配伍性良好等特点,成为人们关注的焦点[1-2]。
魔芋葡甘聚糖(konjac glucomannan,KGM)是魔芋块茎中的特有成分[3-4],含量可达到44%~65%。KGM是由β-D-葡萄糖与β-D-甘露糖以1.5~1.6的比例,通过β-l,4-糖苷键和β-l,3-糖苷键连接而成[5]。但由于KGM的相对分子质量太高,溶于水中形成的液体黏度大,限制了KGM的应用范围,因此可通过物理法[6]、化学法[7-8]或生物法[9]将KGM降解,形成不同聚合度的魔芋葡甘低聚糖(konjac oligosaccharide,KOS)。KOS不但可以避免KGM的劣势,还能保留KGM多种生理功能,如对乳酸菌的增殖功能[10-11],同时还具有一些新的已知[12]或未知的功能。半干法酶解制备KOS是以β-甘露聚糖酶处理KGM,通过微波加热灭酶制备KOS。该种方法具有反应条件温和、污染小、能耗低、得率高、提纯方法简单等特点,可极大节约成本,便于工业化生产,故而以该种方法制备的KOS是一种潜在的、优良的功能性低聚糖[13-14]。
半干法酶解制备KOS的工艺研究已基本完善[15],本研究通过急性毒性实验、骨髓细胞微核实验及精子畸形实验,对半干法酶解制备的KOS的安全性进行了研究。肠道中微生物发 酵是衡量肠道健康的一个重要指标[16],因此本实验体外模拟肠道发酵环境研究该种方法制备的KOS对肠道混合菌群及发酵环境的影响,以期为研究KOS的生理功能提供依据。
1 材料与方法
1.1 动物、材料与试剂
清洁级昆明小鼠、饲料,购自重庆腾鑫比尔实验动物销售有限公司,许可证号:SCXK(渝)2012-0003;动物房温度22~25 ℃,每天12 h明暗轮换(7:00—19:00),实验动物环境设施合格证:普通级环境。
KOS粉末由本实验室自制[13],经液相色谱和飞行质谱联用分析,表明该KOS粉末为葡甘二糖至十糖及少量单糖的混合物[15]。
曙红(水溶)、牛肉膏、酵母浸粉、磷酸氢二钾;磷酸二氢钾、硫酸镁、氯化钙、碳酸氢钠、吐温-80成都市科龙 化工试剂厂;L-半胱氨酸 广州艾辉生物科技有限公司;乙酸、丙酸、丁酸、正戊酸、异戊酸(色谱纯) 阿拉丁试剂(上海)有限公司;胆汁酸盐、氯化血红素 合肥博美生物科技有限责任公司;吉姆萨染色液 苏州苏大赛尔免疫生物科技有限公司;BBL培养基、MRS培养基、EMB培养基(生化试剂) 北京奥博星生物技术有限责任公司;以上试剂除特殊标明外均为分析纯。
1.2 仪器与设备
BX43显微镜 奥林巴斯(中国)有限公司;5810型台式离心机 德国Eppendorf公司;厌氧培养箱美国Sheldon Manufacturing公司;VD-650型桌上式洁净工作台 苏州精华设备有限公司;GC-2010气相色谱日本岛津公司;ES-315高压蒸汽灭菌锅 日本Kagoshima Seisakusyo公司;Rtx-wax毛细管柱 美国Restek公司;PHS-3C pH计 上海诺博环保科技有限公司。
1.3 方法
1.3.1 KOS中总糖和还原糖含量测定
称取0.10 g KOS溶解到100 mL容量瓶中,编号为Ⅰ。取Ⅰ号溶液5 mL溶液于25 mL容量瓶中,加入3 mol/L的硫酸2.5 mL,沸水浴反应1.5 h,冷却,加6 mol/L氢氧化钠溶液2.5 mL中和硫酸,定容至25 mL,编号为Ⅱ。分别取Ⅰ、Ⅱ号溶液2 mL用DNS法[17]测定还原糖,以葡萄糖做标准曲线,KOS中总糖和还原糖含量按公式(1)、(2)计算。

1.3.2 急性毒性实验
健康昆明小鼠50 只,体质量(20±2) g,随机分为5 组,每组10 只,雌雄各半。根据霍恩法[18]KOS的灌胃剂量(以体质量计,下同)分别设置为2 150、4 640、10 000、21 500 mg/kg,另设灌胃蒸馏水的空白对照组。采用一次性灌胃法,小鼠灌胃前禁食24 h,灌胃体积为0.2 mL/10 g。灌胃后连续观察两周,记录小鼠中毒症状及死亡数量。
1.3.3 遗传毒性实验
1.3.3.1 小鼠精子畸形实验
健康成年雄性昆明小鼠25 只,体质量(25±2) g,随机分成5 组。KOS分高、中、低3 个剂量,分别为2 500、5 000、10 000 mg/kg,以环磷酰胺为阳性组(40 mg/kg),另设空白对照组(灌胃蒸馏水),灌胃体积为0.2 mL/10 g,每日1 次,连续5 d,于首次灌胃后35 d颈椎脱臼处死小鼠,取双侧附睾,制备精子标本(每鼠制3 个),1%伊红染色,高倍镜下观察1 000 个精子,记录畸形精子数目,并按照公式(3)计算畸形率/‰。

式中:a、b、c分别为同一只小鼠所做3 个标本中畸形精子数量。
1.3.3.2 小鼠骨髓细胞微核实验
健康昆明小鼠50 只,体质量(20±2)g,随机分为5 组,雌雄各半。KOS分别设为高(10 000 mg/kg)、中(5 000 mg/kg)、低(2 500 mg/kg)剂量组,另设环磷酰胺阳性组(40 mg/kg)和空白对照组(灌胃蒸馏水)。采用两次经口灌胃法,于第2次灌胃后6 h脱颈椎处死小鼠,取胸骨骨髓制标本(每鼠制2 个),吉姆萨染色液染色。油镜下观察1 000 个嗜多染红细胞(polychromatic erythrocytes,PCE),计数产生微核的嗜多染红细胞(microkernel normorchromatic erythrocytes,MNE),并于每个标本中分别计数200 个红细胞中的PCE和成熟红细胞(normorchromatic erythrocytes,NCE)的个数,计算微核产生率和PCE/NCE值。
1.3.4 体外厌氧发酵
1.3.4.1 体外发酵步骤
体外厌氧发酵参考Sanz[19-20]和Lan[21]等的方法,稍做改动。无菌取20 只健康小鼠盲肠内容物于灭菌离心管中,9 倍无菌生理盐水稀释,涡旋振荡3 min使其分散均匀,4 层纱布过滤,取8 mL加入盛有72 mL无菌氮基础培养基中(蛋白胨2 g、酵母浸粉2 g、氯化钠0.1 g、磷酸氢二钾0.04 g、磷酸二氢钾0.04 g、硫酸镁0.01 g、氯化钙0.01 g、碳酸氢钠2 g、吐温-80 2 mL、氯化血红素5 mg、L-半胱氨酸0.5 g、胆汁酸盐0.5 g,溶于1 000 mL蒸馏水)。将三角瓶分为4 组,每组3 瓶,分别加入1%的葡萄糖(Glu组)、1% KOS(KOS组)、0.5% KOS+0.5% Glu(KOS/Glu组),另外一组为不加任何碳源的空白对照组。之后将其放于37 ℃厌氧发酵箱中发酵12 h,终止发酵。检测发酵液的pH值,短链脂肪酸及微生物含量。
1.3.4.2 发酵液pH值测定
发酵液pH值的测定参考GB/T 1601—1993《农药pH值的测定方法》[22]。
1.3.4.3 发酵液中微生物测定
取1 mL发酵液加入9 mL无菌生理盐水,依次10 倍梯度稀释为10-1~10-77 个梯度,取10-5、10-6、10-73 个梯度用于双歧杆菌、大肠杆菌和乳酸菌的平板分离计数,接种量为100 øL。双歧杆菌和乳酸菌分别采用BBL和MRS选择培养基,37 ℃厌氧培养(厌氧培养箱气体成分5% O2、5% CO2、90% N2)48 h,大肠杆菌采用EMB培养基,37 ℃恒温培养箱中培养24 h。然后按照菌落计数原则进行计数,结果以lg(CFU/mL)表示。
1.3.4.4 发酵液中短链脂肪酸测定
短链脂肪酸的提取参考贾益群等[23]的方法,用气相色谱测定发酵液中乙酸、丙酸、丁酸、戊酸及总酸含量。以乙酸、丙酸、正丁酸、异丁酸、正戊酸及异戊酸标准品做标准曲线,总酸为以上各种酸的总和。
气相色谱条件:进样量1 øL;进样口温度220 ℃;柱流量0.95 mL/min,柱温90 ℃、平衡时间0.5 min,5 ℃/min升温至150 ℃,保留时间7 min;检测器温度230 ℃;氢气流量40 mL/min,空气流量400 mL/min,尾吹流量40 mL/min。
1.4 数据分析及处理
数据用Microsoft Excel进行预先处理,然后通过SPSS 17.0处理软件进行各组间差异显著性分析,P<0.05表示有显著差异。
2 结果与分析
2.1 KOS还原糖及总糖测定
用DNS法测定半干法酶解制备的KOS粉末中还原糖和总糖含量,还原糖含量为43.23%,总糖含量为80.25%。总糖与还原糖的比(即平均聚合度)为1.86。根据李剑芳等[24]的报道,将平均聚合度控制在1.8~1.9之间可以将低聚糖中单糖的含量降到最低。
2.2 急性毒性实验
小鼠灌胃后观察期间,体质量增长正常,且各个剂量组均无死亡。外观、体征、行为活动、精神状态、饮食、大小便等均没有异常现象;口、眼、鼻等处也无异常分泌物。经解剖肉眼观察其心、肝、脾、肺、肾、肠等脏器,与空白对照组小鼠比较,皆未发现明显病变和差异。在本实验设置的最大剂量组21 500 mg/kg中雌雄两性小鼠均没有出现异常现象,故而说明半干法制备的KOS的最大耐受量(maximum tolerated dose,MTD)>21 500 mg/kg,故可推算出LD50>21 500 mg/kg,根据GB 15193.1—2003《食品安全性毒理学评价程序》中的急性毒性分级标准,该种方法制备的KOS属于无毒级物质。
2.3 遗传毒性实验
2.3.1 小鼠精子畸形实验

表1 魔芋葡甘低聚糖对小鼠精子畸形的影响(x±s,n=55)Table1 Effect of KOS on mouse sperm abnormality (x ±s,, n == 55))
小鼠精子畸变主要表现为精子头部弯曲、中部弯曲、双头、双尾、胖头和无钩,其中以头部和中部弯曲居多。由表1可知,与空白对照组相比,环磷酰胺组小鼠精子畸变率显著增加(P<0.01),而KOS各个剂量组与蒸馏水对照组相比均无显著性差异(P>0.05)。由此可以说明KOS对小鼠精子畸变无影响。图1展示了检片过程中小鼠精子畸形种类及形态。

图1 小鼠精子畸形种类及形态(×40000)Fig.1 The type and morphology of sperm deformity in mice (×400)
2.3.2 小鼠骨髓细胞微核实验
微核是由致突变物质作用于细胞有丝分裂中期,使染色体分裂异常而产生。由表2可知,在两性小鼠中,环磷酰胺组小鼠与空白对照组相比,微核率有极显著差异(P<0.01),而KOS各个剂量组与空白对 照组无显著性差异(P>0.05),且无剂量-效应关系。说明KOS对小鼠骨髓细胞微核发生率无影响。KOS各剂量组PCE/NCE值与空白对照组相比均无显著性差异(P>0.05),说明KOS对小鼠骨髓细胞分裂无影响。图2展示了检片过程中小鼠骨髓NCE、PCE、MNE的形态颜色特征,由于其在小鼠两性之间无显著性差异,故此处只选取雌性作图。

表2 魔芋葡甘低聚糖对小鼠骨髓嗜多染红细胞微核发生率的影响(x±s,n=55)Table2 Effect of KOS on marrow micronucleus rate in mice (±s, , n = 5)
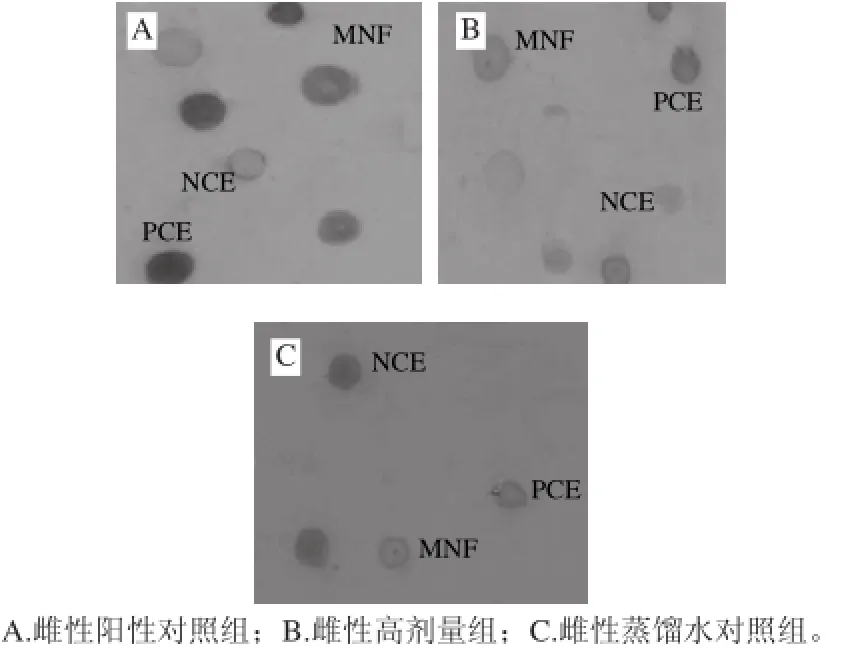
图2 小鼠骨髓细胞微核(×2 000)Fig.2 Bone marrow micronucleus of mice (×2 000)
2.4 体外发酵实验
2.4.1 发酵液pH值变化
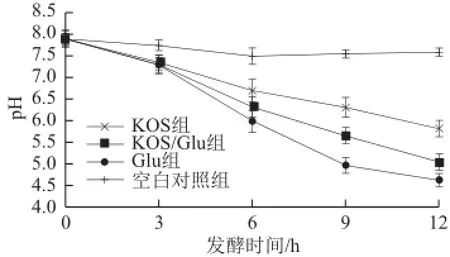
图3 发酵液pH值变化趋势Fig.3 pH changes in anaerobic fermentation broth
由图3可知,在发酵过程中,发酵液的pH值均逐渐减小,其中以Glu组发酵液降低速率最快,KOS/Glu组次之,KOS组较两者都小。发酵液的pH值变化主要受微生物生长产生的有机酸和游离氨影响[25],可能是因为不同发酵液中微生物发酵产酸或游离氨速率不同,从而导致pH值变化速率不同。
2.4.2 发酵液中微生物变化趋势

图4 发酵液中微生物含量Fig.4 Microbial counts in anaerobic fermentation broth
由图4可知,1% KOS组发酵液中双歧杆菌和乳酸菌数量明显高于KOS/Glu组、Glu组、空白对照组(P<0.05),KOS/Glu组发酵液中双歧杆菌和乳酸菌数量也明显高于Glu组和空白对照组(P<0.05),由此可以看出KOS不论是单独使用还是和葡萄糖复合都可以被微生物利用,并对双歧杆菌和乳酸菌有良好的增殖作用。从大肠杆菌的分离结果可以看出,KOS组和KOS/Glu组的大肠杆菌与Glu组相比,数量明显较多(P<0.05),而与空白对照组相比无显著差异(P>0.05),这可能是由于Glu组发酵液pH值降低速率极快,在发酵结束时pH 4.62,对大肠杆菌造成了抑制作用,而KOS组、KOS/Glu组和空白对照组发酵液pH值降低速率较慢,对大肠杆菌影响不大。由此可以看出,KOS对肠道有害菌大肠杆菌增殖作用不明显,这可能是因为双歧杆菌等的增长对其有抑制作用[26]。
2.4.3 发酵液中短链脂肪酸含量

图5 KOS厌氧发酵液气相色谱图(11% KOOSS组)Fig.5 GC of KOS anaerobic fermentation broth (1% KOS)
发酵液气相色谱图见图5。由表3可知,在不同发酵液的短链脂肪酸(short-chain fatty acids,SCFAs)中,乙酸含量最高,占总量的47%~64%,其中KOS组和KOS/Glu组显著高于Glu组和空白对照组(P<0.05),而KOS组与KOS/Glu组含量差异不明显(P>0.05)。同样KOS组和KOS/Glu组中丙酸、丁酸、和戊酸含量也极显著高于另外两组(P<0.05),而KOS组与KOS/Glu组相比,丁酸和戊酸含量都显著较高(P<0.05),而丙酸含量略低,但差异不明显(P>0.05)。另外从SCFAs总量来看,KOS组和KOS/Glu组发酵液中SCFAs总量明显高于其他两组(P<0.05),同样KOS组与KOS/Glu组相比也具有显著差异(P<0.05)。SCFAs主要是双歧杆菌等肠道益生菌通过厌氧发酵肠道中糖类物质产生的对机体肠道健康有积极作用的一类次级代谢产物[27]。从上述结果可以看出,KOS可以促进肠道微生物发酵产生SCFAs,有利于肠道健康。

表3 发酵液中短链脂肪酸含量(x±s,n=3)Table3 The contents of short-chain fatty acids (SCFAs) in anaerobic fermentation brotthh ((x ±s,, n == 33))
3 结 论
本实验采用霍恩法研究KOS的急性毒性,结果表明:KOS的LD50>21 500 mg/kg,属于无毒级物质。通过小鼠骨髓细胞微核实验和小鼠精子畸形实验,研究了KOS的遗传毒性,结果发现骨髓细胞微核实验和精子畸形实验均呈现阴性,表明KOS无遗传毒性。综合急性毒性实验和遗传毒性实验表明KOS是一种安全的低聚糖。
肠道内容物体外厌氧发酵结果表明不论是单独的KOS或与葡萄糖复合都对肠道中的益生菌(双歧杆菌、乳酸菌)有显著的增殖作用(P<0.05),而发酵液中SCFAs的增加也呈现极显著的趋势(P<0.05),而对大肠杆菌的增殖没有明显作用(P>0.05)。结果表明KOS刺激肠道益生菌生长,产生乙酸、丙酸、丁酸及戊酸等有机酸,降低肠道发酵pH值,改变肠道微环境,促进肠道健康。
综上所述,KOS具有较高的安全性,是一种功能显著的肠道益生元。
[1] PATEL S, GOYAL A. Functional oligosaccharides: production, properties and applications[J]. World Journal of Microbiology and Biotechnology, 2011, 27(5): 1119-1128.
[2] NAKAKUKI T. Present status and future of functional oligosaccharide development in Japan[J]. Pure and Applied Chemistry, 2002, 74(7): 1245-1251.
[3] WEN Xian, CAO Xuelian, YIN Zehua, et a1. Preparation and characterization of konjac glucomannan-poly (acrylic acid) IPN hydrogels for controlled release[J]. Carbohydrate Polymers, 2009, 78(2): 193-198.
[4] 刘佩瑛. 魔芋学[M]. 北京: 中国农业出版社, 2004: 12-27.
[5] LIU Feng, LUO Xuegang, LIN Xiaoyan. Adsorption of tannin from aqueous solution by deacetylated konjac glucomannan[J]. Journal of Hazardous Materials, 2010, 178(1/3): 844-850.
[6] JIN Weiping, XU Wei, LI Zhenshun, et al. Degraded konjac glucomannan by γ-ray irradiation assisted with ethanol: preparation and c haracterization[J]. Food Hydrocolloids, 2014, 36: 85-92.
[7] CHEN Hsiaoling, FAN Yinghsin, CHEN Meien, et al. Unhydrolyzed and hydrolyzed konjac glucomannans modulated cecal and fecal microflora in BALB/c mice[J]. Nutrition, 2005, 21(10): 1059-1064.
[8] JIN Weiping, MEI Ting, WANG Yuntao, et al. Synergistic degradation of konjac glucomannan by alkaline and thermal method[J]. Carbohydrate Polymers, 2014, 99: 270-277.
[9] MICHAEL L C, JULIE A L, KIERANM T. Konjac glucomannan hydrolysate beneficially modulates bacterial composition and activity within the faecal microbiota[J]. Journal of Functional Foods, 2010, 2(3): 219-224.
[10] ALGHAZZEWI F H, TESTER R F. Efficacy of cellulase and mannanase hydrolysates of konjac glucomannan to promote the growth of lactic acid bacteria[J]. Journal of the Science of Food and Agriculture, 2012, 92(11): 2394-2396.
[11] AL-GHAZZEWI F H, TESTER R F. Effect of konjac glucomannan hydrolysates and probiotics on the growth of the skin bacterium Propionibacterium acnes in vitro[J]. International Journal of Cosmetic Science, 2010, 32(2): 139-142.
[12] YEH Shulan, LIN Mengsgen, CHEN Hsiaoling. Partial hydrolysis enhances the inhibitory effects of konjac glucomannan from Amorphophallus konjac C. Koch on DNA damage induced by fecal water in Caco-2 cells[J]. Food Chemistry, 2010, 119(2): 614-618.
[13] 秦清娟, 张媛, 刘倍毓, 等. 半干法酶解制备魔芋葡甘低聚糖工艺及其抗氧化性能研究[J]. 食品工业科技, 2013, 34(23): 186-191.
[14] BIAWAS A, SHOGREN R L, SELLING G, et al. Rapid and environmentally friendly preparation of starch esters[J]. Carbohydrate Polymers, 2008, 74(1): 137-141.
[15] 邓利玲, 钟耕, 刘倍毓, 等. 半干法酶解制备的魔芋葡甘低聚糖性质[J].食品科学, 2013, 34(15): 115-119.
[16] KARPPINEN S, LIUKKONEN K, AURA A, et al. in vitro fermentation of polysaccharides of rye, wheat and oat brans and inulin by human faecal bacteria[J]. Journal of the Science of Food and Agriculture, 2000, 80(10): 1469-1476.
[17] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31: 426-428.
[18] 王向东. 食品毒理学[M]. 南京: 东南大学出版社, 2007: 350-358.
[19] SANZ M L, CÔTÉ G L, GIBSON G R, et al. Selective fermentation of gentiobiose-derived oligosaccharidesby human gut bacteria and influence of molecular weight[J]. FEMS Microbiology Ecology, 2006, 56(3): 383-388.
[20] SANZ M L, CÔTÉ G L, GIBSON G R, et al. Prebio tic properties of alternansucrase maltose-acceptor oligosaccharides[J]. Journal of Agricultural and Food Chemistry, 2005, 53(15): 5911-5916.
[21] LAN Y, WILLIAMSA B A, VERSTEGEN M W A, et al. Soy oligosaccharides in vitro fermentation characteristics and its effect on caecal microorganisms of young broiler chickens[J]. Animal Feed Science and Technology, 2007, 133(3/4): 286-297.
[22] GB/T 1601—1993 农药pH值的测定方法[S].
[23] 贾益群, 叶福媛, 王双, 等. 生物样品中短链脂肪酸的快速提取与分析方法[J]. 实验室研究与探索, 2012, 31(7): 262-264.
[24] 李剑芳, 邬敏辰, 程科, 等. β-甘露聚糖酶制备魔芋葡甘露低聚糖的研究[J]. 食品与发酵工业, 2007, 33(1): 21-24.
[25] 吕娇, 苏昕峰, 方国珊, 等. 果胶改善辣椒素对肠道发酵环境的影响[J].食品科学, 2013, 34(17): 273-277.
[26] ARAYA K, YAESHIMA T, ISHIBASHI N, et al. Inhibitory effects of Bifidobacterium longum BB536 on harmful intestinal bacteria[J]. Bifidobact Microflora, 1995, 14: 59-66.
[27] DRASER B S, BARROW P A. Intestinal microbiology[M]. Washington DC: American Society of Microbiology, 1985: 28-38.
Toxicological and Prebiotic Evaluation of Konjac Oligosaccharides
QIN Qing-juan1, XU Xiao-qing1, ZHANG Yuan1, ZHONG Geng1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Chongqing Special Food Engineering Technology Research Center, Chongqing 400715, China)
Objective: To evaluate the safety and prebiotic function of konjac oligosaccharides (KOS). Methods: Mouse acute toxicity test, mouse bone marrow cell micronucleus test and mouse sperm aberration test were used to evaluate the safety of KOS. The prebiotic function was evaluated by in vitro fermentation of mouse cecum contents. Results: Acute toxicity test showed that the LD50of KOS was greater than 21 500 mg/kg body weight for both male and female mi ce, indicating that KOS is non-toxic. The results of genotoxicity tests, including mouse bone marrow cell micronucleus test and mouse sperm aberration test, were all negative. Fermentation in vitro showed that KOS could promote proliferation of beneficial bacteria, such as Bif i dobacterium spp. and Lactobacillus/Enterococcus spp., but caused no significant effects on Escherichia coli. In addition, KOS significantly promoted the accumulation of acetic acid, propionic acid, butyric acid and valeric acid generated by gut microbes, and increased the total amount of short-chain fatty acid (SCFAs). Conclusion: KOS is highly safe and possesses an excellent prebiotic function.
konjac oligosacc harides (KOS); acute toxicity; genotoxicity; prebiotic function
TS201.4
A
1002-6630(2014)21-0244-05
10.7506/spkx1002-6630-201421048
2014-01-15
秦清娟(1989—),女,硕士研究生,研究方向为食品科学。E-mail:825681973@qq.com
*通信作者:钟耕(1964—),男,教授,博士后,研究方向为粮食、油脂、植物蛋白。E-mail:zhongdg@126.com
