鼠曲草总黄酮抑制疼痛模型小鼠炎症因子产生而致镇痛作用
2014-03-08黄晓佳李永金
黄晓佳,李永金*,李 静,许 潇
(江苏大学医学院,江苏 镇江 202013)
鼠曲草总黄酮抑制疼痛模型小鼠炎症因子产生而致镇痛作用
黄晓佳,李永金*,李 静,许 潇
(江苏大学医学院,江苏 镇江 202013)
目的:研究鼠曲草总黄酮的镇痛活性及其作用机制。方法:采用热板刺激、腹腔注射醋酸法构建小鼠疼痛模型,观察灌胃给予不同剂量的鼠曲草总黄酮对小鼠疼痛反应的作用,研究鼠曲草总黄酮对疼痛小鼠血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、一氧化氮(nitric oxide,NO)的作用,以及对腹腔巨噬细胞TNF-α、IL-6、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)基因表达的影响。结果:鼠曲草总黄酮可明显延长热刺激引起的小鼠舔足时间,抑制腹腔注射醋酸后引起的小鼠扭体反应;降低腹腔注射醋酸致痛小鼠血清中TNF-α、IL-6、NO的含量,也抑制小鼠腹腔巨噬细胞TNF-α、IL-6、iNOS基因表达。结论:鼠曲草总黄酮具有镇痛作用,其作用与减少血清中炎症因子的产生和巨噬细胞介导的炎症反应有关。
鼠曲草;总黄酮;镇痛;炎症因子
鼠曲草(Gnaphalium aff i ne D. Don)为菊科植物鼠曲草属植物,主产于江苏、浙江、福建等地。每年清明节前后,民间采摘其嫩叶用于制作糕点等食品。研究表明鼠曲草的主要成分包含黄酮类、挥发油等,其黄酮类成分具有抗氧化、抑菌、护肝等作用[1-4],且毒性低,具有可观的作为天然保健食品的开发利用价值。来自于天然产物中的黄酮类化合物具有降血糖、降血压、抗衰老、抗炎等生物活性[5-8],在保健食品和保健药品中的使用日益广泛,对黄酮类化合物的研究开发也日益增多。但目前对鼠曲草黄酮类化合物的研究仍不完全。
本实验采用小鼠疼痛模型,研究鼠曲草总黄酮对小鼠疼痛的作用,观察其镇痛作用的特点,同时也测试其对小鼠血清中炎症因子和腹腔巨噬细胞炎症因子基因表达的作用,评价其镇痛作用和相关机制,为有效开发鼠曲草作为保健食品和药品提供有效的理论支持。
1 材料与方法
1.1 动物、材料与试剂
清洁级雄性昆明种小鼠购自中国科学院上海实验动物中心,饲养于江苏大学实验动物中心,饲养温度25 ℃,标准饲料,自由饮水,灯光控制12 h昼夜节律;鼠曲草购自安徽亳州药材市场。
芦丁对照品 中国药品生物制品检定所;纤维素酶(1 400 U/mg) 广州市齐云生物技术有限公司;AB-8型大孔吸附树脂 安徽三星树脂有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、白细胞介素-6(interleukin-6,IL-6)试剂盒 上海越研生物技术有限公司;NO试剂盒 南京建成生物工程研究所;mRNA提取试剂盒(含DNA酶Ⅰ消化)、小鼠TNF-α引物、IL-6引物、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)引物、亲环蛋白A(cyclophilin A)引物 美国Qiagen公司;cDNA逆转录试剂盒美国ABI公司;其他试剂均为国产化学分析纯。
1.2 仪器与设备
SENCO R201L旋转蒸发仪 上海申生科技有限公司;Model 680酶标仪、S1000聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;ABI 7000定量PCR仪 美国ABI公司。
1.3 方法
1.3.1 鼠曲草总黄酮的制备及纯度测定
鼠曲草干燥粉经过筛后,取粉末4 g于三角瓶中,加入10 mg纤维素酶和0.1 mol/L醋酸-醋酸钠缓冲液(pH 5.0)使总体积为100 mL。置于50 ℃在水浴振荡器中反应2 h后,于沸水浴中5 min终止反应,过滤,离心取上清液,合并滤液,抽滤浓缩。
使用AB-8型大孔吸附树脂对提取的滤液进行纯化,纯化条件为上样液质量浓度2.3 mg/mL,上样液pH 4.5,流速2 BV/h;洗脱液为75%乙醇,流速为1 BV/h;回收率为80%,纯化后产品纯度为45%。
[2]的方法,以芦丁作为对照品测定总黄酮的纯度。称取芦丁标准品,加入70%乙醇溶解使其质量分数为0.60 mg/mL,以亚硝酸钠-亚硝酸铝比色法在510 nm波长处读取吸光度,绘制标准曲线y=9.422 5x+ 0.162(R2=0.997 3)。取鼠尾草乙醇提取液按标准曲线绘制方法处理,于510 nm波长处测定吸光度,代入标准曲线计算总黄酮质量分数。
1.3.2 实验动物与分组
雄性昆明种小鼠40 只,体质量(22±2)g,适应性喂养1 周后,随机分为5 组。各组动物分组及灌胃剂量如下:生理盐水组、阿司匹林组(300 mg/(kg·d))、鼠曲草总黄酮组(低剂量组25 mg/(kg·d)、中剂量组50 mg/(kg·d)、高剂量组100 mg/(kg·d))。
热板法小鼠疼痛模型:给予药物前预先测定各小鼠的痛阈值。将小鼠置于55 ℃热板上,观察其开始舔足的时间并予以记录。重复测量3 次,剔除平均痛阈值<3 s或>30 s的小鼠,将3 次痛阈平均值作为该小鼠基础痛阈值。之后,各组动物均进行灌胃给药,鼠曲草总黄酮组各小鼠1 次/d,连续灌胃5 d;阿司匹林组小鼠只给予1 次药物。末次给药后分别在0.5、1、2 h后将小鼠置于热板上,测定其痛阈值。
腹腔注射醋酸小鼠疼痛模型:取雄性昆明种小鼠40 只,随机分为5 组,分组及给药剂量同上。连续灌胃5 d,末次给药后1 h,各小鼠均腹腔注射体积分数0.6%的醋酸溶液0.1 mL/10 g,观察注射醋酸后20 min内各组小鼠发生扭体反应的次数。
1.3.3 血清中TNF-α、IL-6、NO含量检测
小鼠于腹腔注射醋酸1 h后处死,取血样进行酶联免疫法检测血清中TNF-α、IL-6含量。依照试剂盒说明书进行实验操作,终止反应后,将酶标板放入酶标仪内,在450 nm波长处进行检测,读取吸光度。血清NO含量按照试剂盒说明书进行操作。
1.3.4 小鼠腹腔巨噬细胞mRNA的制备及定量PCR检测
依据文献[9-10]方法并加以改进,进行小鼠腹腔巨噬细胞的分离。末次给药2 h后将小鼠断颈处死,用乙醇消毒小鼠腹部皮肤。腹腔注射5 mL无菌磷酸盐缓冲溶液(phosphate buffered solution,PBS),轻揉腹部5 min,小心抽吸出液体,收集到离心管中。将细胞悬液4 ℃、1 500 r/min离心5 min,弃上清液收集沉淀。按照试剂盒说明书进行操作提取细胞mRNA,进行cDNA逆转录和定量PCR分析。
1.4 统计学分析
2 结果与分析
2.1 鼠曲草总黄酮对热板致小鼠疼痛的作用
如表1所示,灌胃5 d后,与生理盐水组比较,鼠曲草总黄酮(50、100 mg/kg)可显著提高热板导致小鼠疼痛阈值,2 种剂量药物的作用均与阿司匹林相当。此外,灌胃给予药物后0.5 h即开始产生作用,至2 h后仍然有效,其峰值为给药后1 h。
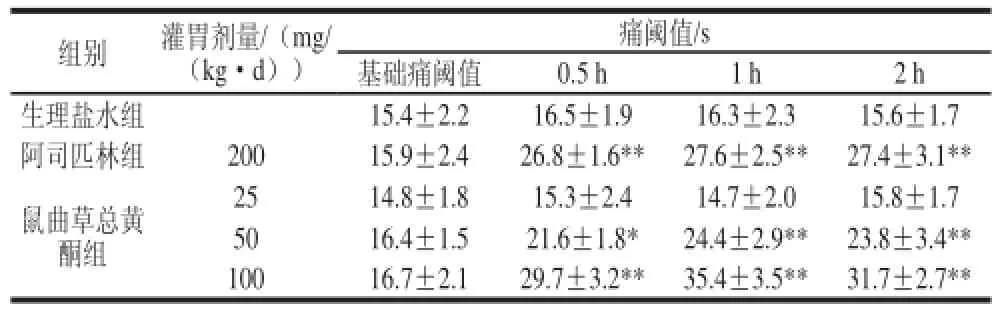
表1 鼠曲草总黄酮对热板致小鼠疼痛的作用(x±s,n=8)Table1 Effect of total flavonoids from Gnaphalium af fi nee D. Don oonn heat-induced pain in mice ((x ±s,, n == 88))
2.2 鼠曲草总黄酮对腹腔注射醋酸致小鼠扭体反应的作用

表2 鼠曲草总黄酮对腹腔注射醋酸致小鼠扭体反应的作用(x =8)Table2 Effect of total flavonoids from Gnaphalium affifi ne D. Don on the writhing response in mice induced by intraperitoneal injection of acetic acid (x , = 8)
如表2所示,腹腔注射醋酸后,各组小鼠均出现扭体反应。灌胃5 d后,与生理盐水组比较,鼠曲草总黄酮(50、100 mg/kg)可显著减少腹腔注射醋酸导致的小鼠扭体反应次数,其作用呈现剂量依赖性,50 mg/kg剂量作用与阿司匹林相当,100 mg/kg剂量可产生比阿司匹林更强的作用(P<0.05)。鼠曲草总黄酮(25 mg/kg)对扭体反应次数没有影响。
2.3 鼠曲草总黄酮对腹腔注射醋酸后小鼠血清中炎症因子的作用


图1 鼠曲草总黄酮对小鼠腹腔注射醋酸后血清炎症因子的作用(x±s,n=8)Fig.1 Effect of total flavonoids from Gnaphalium af fi ne D. Don on the production of pro-inflammatory mediators in mouse plasma after administration with acetic acid (x ±s,n=8)
如图1所示,经腹腔注射醋酸后,小鼠血清中出现大量炎症因子,包括TNF-α、IL-6、NO。鼠曲草总黄酮(50、100 mg/kg)呈剂量依赖性地降低血清中TNF-α、IL-6、NO的含量,而25 mg/kg剂量不具有抑制血清中炎症因子表达的作用。
2.4 鼠曲草总黄酮对小鼠腹腔巨噬细胞炎症因子表达的作用
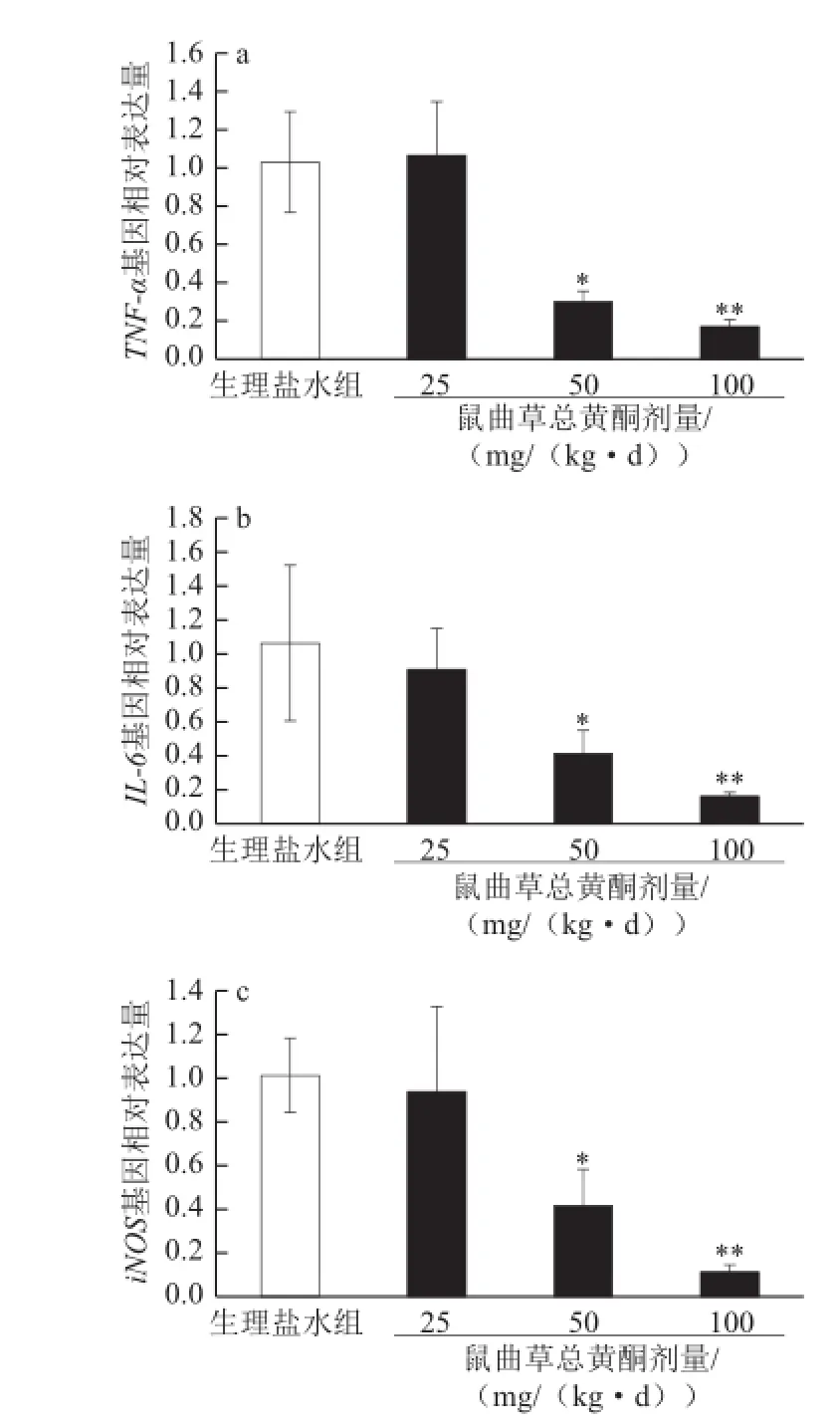
图2 鼠曲草总黄酮对小鼠腹腔巨噬细胞炎症因子表达的作用(x±s,n=4)Fig.2 Effect of total flavonoids from Gnaphalium af fi ne D. Don on the expressions of pro-inflammatory mediators in abdominal macrophages in mice treated with acetic acid (x±s, n=4)
小鼠腹腔注射醋酸后,腹腔巨噬细胞炎症因子表达水平增加,诱发了炎症反应[11]。如图2所示,鼠曲草总黄酮可剂量性地抑制巨噬细胞TNF-α、IL-6、iNOS基因表达,50、100 mg/kg剂量效果与生理盐水组相比具有显著或极显著差异(P<0.05或P<0.01)。
3 讨 论
疼痛是机体对损伤的一种反应,缓解疼痛的方法之一是采用药物治疗。用来筛选镇痛药物的动物模型有许多,其中热板实验可模拟热刺激导致的疼痛,可考察中枢性镇痛药物的作用[12]。本实验发现鼠曲草总黄酮对热板引起的疼痛具有缓解作用,可明显延长小鼠的痛阈值,其作用与阿司匹林相似,提示其镇痛作用位点不在中枢,而在外周。此外,醋酸引起的小鼠扭体反应模型是另一种动物疼痛模型,该模型可模拟腹腔炎症导致的病理性疼痛,已被广泛用于非甾体抗炎药和阿片类镇痛药物的筛选和作用机制研究[11]。腹腔注射醋酸后,动物出现内脏痛疼,表现为扭体反应,该反应至少持续2 h,其高峰期为0.5 h[13-14]。在本实验也发现小鼠腹腔注射醋酸后20 min内出现多次扭体反应,鼠曲草总黄酮和阿司匹林可显著减少该反应的次数,表现出良好的镇痛作用。
鼠曲草中含有多种化学成分,包括黄酮类成分如芦丁、槲皮素、槲皮素糖苷等,挥发油、氨基酸、微量金属元素等[1]。鼠曲草主要活性成分为黄酮类化合物,目前已知鼠曲草黄酮可发挥抗氧化、抑制细菌生长、止咳祛痰、保护肝脏损伤等作用[1,8]。本实验通过热板法和腹腔注射醋酸法模型,证实了鼠曲草总黄酮具有镇痛的作用,且镇痛作用在50~100 mg/kg范围内具有剂量依赖性,且100 mg/kg剂量的效应优于阿司匹林。此外,鼠曲草总黄酮可抑制腹腔注射醋酸后小鼠血清中炎症因子如TNF-α、IL-6、NO的产生,也可抑制腹腔巨噬细胞TNF-α、IL-6、iNOS基因表达,表明鼠曲草总黄酮的镇痛作用来自于抑制巨噬细胞参与的机体炎症反应。在疼痛发生过程中,各种细胞因子和致炎症物质如TNF-α、干扰素、IL-6、NO、环氧合酶产物等都可引起痛觉的产生和传递过程,抑制各种细胞因子的表达则具有明显的镇痛效果[15-16]。而巨噬细胞是一种重要的炎症因子产生细胞,其分泌的各种致炎因子可导致血管通透性增加、中性粒细胞渗出、组织浸润、痛觉受体增敏和与痛觉有关细胞内信号的启动,引起机体疼痛的感觉[17-18]。研究已表明,抑制巨噬细胞产生和分泌炎症因子,降低血液中炎症因子水平可明显减低小鼠扭体反应次数,二者具有良好的相关性[19-22]。因此,通过抑制巨噬细胞的活化及分泌炎症因子,进而减轻机体炎症反应是一种可行的镇痛药物的研发思路。
综上所述,本实验通过小鼠疼痛模型,证实了鼠曲草总黄酮的镇痛作用,且该作用与其抑制巨噬细胞产生炎症因子,减低机体炎症反应有关。我国鼠曲草资源丰富,在保健食品和药品开发上具有一定的价值。目前,国内外研究已经初步表明鼠曲草黄酮类物质可能的作用,但其生物活性成分仍需进一步研究,为其作为功能性食品或药品的开发提供理论基础。
参考文献:
[1] 徐玉婷, 吴丹慧. 鼠曲草的研究进展[J]. 医药导报, 2012, 31(2): 192-194.
[2] 李超, 崔珏, 周小双, 等. 鼠曲草总黄酮改善糖尿病小鼠的抗氧化功能[J]. 食品科学, 2013, 34(21): 311-314.
[3] 潘明. 鼠曲草提取物抑菌作用初步研究[J]. 四川食品与发酵, 2006, 42(6): 53-56.
[4] 姜丽君, 朴锦花, 刘宇, 等. 鼠曲草提取物对四氯化碳所致小鼠急性肝损伤保护作用[J]. 时珍国医国药, 2008, 19(8): 1901-1903.
[5] 陈玲玲, 刘炜, 陈建国, 等. 桑叶黄酮对糖尿病小鼠调节血糖的作用机制研究[J]. 中国临床药理学杂志, 2010, 26(10): 835-838.
[6] 李晓岚, 裘名宜, 刘素鹏, 等. 一枝黄花总皂苷和总黄酮对家兔血压的影响[J]. 时珍国医国药, 2010, 21(3): 552-553.
[7] 范红艳, 顾饶胜, 王艳春, 等. 大豆异黄酮抗衰老作用研究[J]. 中草药, 2010, 41(12): 2054-2057.
[8] 俞冰, 杜瑾, 张亚珍, 等. 鼠曲草止咳祛痰作用的实验研究[J]. 浙江中医药大学学报, 2006, 30(4): 352-353.
[9] KRECKLER L M, WAN T C, GE Z D, et al. Adenosine inhibits tumor necrosis factor-α release from mouse peritoneal macrophages via A2A and A2B but not the A3 adenosine receptor[J]. The Journal of Pharmacology and Experimental Therapeutics, 2006, 317(1): 172-180.
[10] 叶莎莎, 曾耀英, 尹乐乐, 等. 红景天苷对小鼠腹腔巨噬细胞体外增殖、凋亡、吞噬、ROS和NO产生的影响[J]. 细胞与分子免疫学杂志, 2011, 27(3): 237-241.
[11] RIBEIRO R A, VALE M L, THOMAZZI S M, et al. Involvement of resident macrophages and mast cells in the writhing nociceptive response induced by zymosan and acetic acid in mice[J]. European Journal of Pharmacology, 2000, 387(1): 111-118.
[12] HUANG Chungyu, CHEN Yingling, LI A H, et al. Minocycline, a microglial inhibitor, blocks spinal CCL2-induced heat hyperalgesia and augmentation of glutamatergic transmission in substantia gelatinosa neurons[J]. Journal of Neuroinf l ammation, 2014, 11: 7. http://dx.doi. org/10.1186/1742-2094-11-7.
[13] HARADA H, HOSONUMA K, FUJII T, et al. Enhancement of cerebral cortical acetylcholine release by intraperitoneal acetic acid and its suppression by analgesics in freely moving rats[J]. Neuroscience Letters, 2000, 284(3): 163-166.
[14] MU X, WU A, WU J, et al. Effects of anesthetic propofol on release of amino acids from the spinal cord during visceral pain[J]. Neuroscience Letters, 2010, 484(3): 206-209.
[15] CUNHA T M, VERRI W A,Jr, SILVA J S, et al. A cascade of cytokines mediates mechanical inflammatory hypernociception in mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(5): 1755-1760.
[16] BODDEKE E W. Involvement of chemokines in pain[J]. European Journal of Pharmacology, 2001, 429(1/3): 115-119.
[17] BAGGIO C H, FREITAS C S, MARTINS D F, et al. Antinociceptive effects of (1→3), (1→6)-linked beta-glucan isolated from Pleurotus pulmonarius in models of acute and neuropathic pain in mice: evidence for a role for glutamatergic receptors and cytokine pathways[J]. The Journal of Pain, 2010, 11(10): 965-971.
[18] NAVARRO S A, SERAFIM K G, MIZOKAMI S S, et al. Analgesic activity of piracetam: effect on cytokine production and oxidative stress[J]. Pharmacology, Biochemistry, and Behavior, 2013, 105: 183-192.
[19] NIU Xiaofeng, XING Wei, LI Weifeng, et al. Isofraxidin exhibited antiinflammatory effects in vivo and inhibited TNF-α production in LPS-induced mouse peritoneal macrophages in vitro via the MAPK pathway[J]. International Immunopharmacology, 2012, 14(2): 164-171.
[20] SCHUH C D, PIERRE S, WEIGERT A, et al. Prostacyclin mediates neuropathic pain through interleukin 1β-expressing resident macrophages[J]. Pain, 2013, 155(3): 545-555.
[21] JUNG H J, KANG H J, SONG Y S, et al. Anti-inflammatory, antiangiogenic and anti-nociceptive activities of Sedum sarmentosum extract[J]. Journal of Ethnopharmacology, 2008, 116(1): 138-143.
[22] VALE M L, ROLIM D E, CAVALCANTE I F, et al. Role of NO/cGMP/ KATPpathway in antinociceptive effect of sildenaf i l in zymosan writhing response in mice[J]. Inf l ammation Research, 2007, 56(2): 83-88.
Total Flavonoids from Gnaphalium aff i ne D. Don Exert Analgesic Effect via Inhibiting the Production of Pro-inflammatory Mediators in Mouse Model of Pain
HUANG Xiao-jia, LI Yong-jin*, LI Jing, XU Xiao
(School of Medicine, Jiangsu University, Zhenjiang 202013, China)
Objective: To investigate the anti-nociceptive effect of total fl avonoids from Gnaphalium aff i ne D. Don and the involved mechanism. Methods: Employing the mouse model of pain induced by heat and intraperitoneal injection of acetic acid, the analgesic activity of oral administration of the total fl avonoids was assessed. Moreover, the production of cytokines in mouse plasma, including tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6) and nitric oxide (NO) was determined. The gene expression levels of TNF-α, IL-6 and inducible nitric oxide synthase (iNOS) in peritoneal macrophages were also examined. Results: The total fl avonoids signif i cantly increased the withdrawal latency in hot plate tests and inhibited the writhing response in mice. In addition, the total fl avonoids blocked the production of TNF-α, IL-6, and NO in plasma and reduced the expression levels of TNF-α, IL-6, and iNOS in the peritoneal macrophages. Conclusions: The total fl avonoids from Gnaphalium aff i ne D. Don exert analgesic effects in mice, which is associated with the inhibition of the production of cytokines in plasma and macrophage-mediated inf l ammation.
Gnaphalium aff i ne D. Don; total fl avonoids; analgesic effect; pro-inf l ammatory mediator
R285.5
A
1002-6630(2014)21-0240-04
10.7506/spkx1002-6630-201421047
2014-01-16
江苏大学高级人才启动基金项目(08JDG005;11JDG092)
黄晓佳(1980—),男,讲师,博士,研究方向为中药药理学和抗肿瘤药物药理学。E-mail:harold1980@163.com
*通信作者:李永金(1968—),男,副教授,博士,研究方向为天然药物药理学。E-mail:lyj8617@163.com
