降解赭曲霉毒素A菌株的筛选及其鉴定
2014-03-08王峻峻张红印杨其亚
王峻峻,张红印*,杨其亚
(江苏大学食品与生物工程学院,江苏 镇江 212013)
降解赭曲霉毒素A菌株的筛选及其鉴定
王峻峻,张红印*,杨其亚
(江苏大学食品与生物工程学院,江苏 镇江 212013)
为了提供筛选生物降解赭曲霉毒素A(ochratoxin A,OTA)的便利条件,优化水系中OTA的测定方法。通过在水系中添加甲醇或乙醇的方法,使得水系中OTA回收率超过了90%,此外通过对比,当甲醇或乙醇与样液体积比为1∶1时,足以准确测定水系中OTA含量。利用以上方法对降解OTA的菌株进行筛选,发现细菌B-1和酵母Y-2均能够降解OTA,且细菌B-1在2 d时能降解87%的OTA,3 d将OTA全部降解,而酵母Y-2在2 d时就能够降解84%的OTA,在后续的培养中维持降解率不变。此外,利用液质联用法进一步确定了菌株B-1和Y-2的降解作用,并分析了降解产物。最后,通过分别分析细菌B-1和酵母Y-2的16S rDNA和ITS rDNA序列,菌株B-1鉴定为泡囊短波单胞菌,菌株Y-2鉴定为耶罗维亚酵母。
赭曲霉毒素A;回收率;降解;微生物;筛选;鉴定
利用微生物,尤其真菌,降解赭曲霉毒素A(ochratoxin A,OTA)的研究,取得了良好的效果。Abrunhosa等[1]将Phaffia rhodozyma CBS 5905与OTA在20 ℃条件下培养15 d后,利用二氯甲烷提取发酵液中OTA,发现OTA降解了90%;Varga等[2]将黑曲霉(Aspergillus niger)、根霉(Rhizopus)以及酿酒酵母(Saccharomyces cerevisiae)培养在含有OTA的发酵液中,一段时间后,先将发酵液酸化,再利用氯仿萃取,然后通过高效液相色谱(high performance liquid chromatography,HPLC)等方法来测定OTA含量。从文献报道可以看出,测定水系溶液中的OTA,大多采用了萃取的方法。这是因为OTA易溶于极性有机物,而微溶于水[3-4]。但OTA标准品价格昂贵,加之萃取方法需试剂较多,同时耗时长、易造成较大误差,尤其不适合处理大量样品,因此亟需一种简便快速的方法来处理水系OTA样品。本实验首先优化水系OTA样品的前处理方法,将筛得的菌株分别与OTA一起培养一段时间后,利用建立的样品前处理方法,初步确定能够降解OTA的实验菌株。由于高效液相-质谱联用(high performance liquid chromatography-mass spectrometry,HPLC-MS)可以排除其他未知因素引起的OTA含量的变化,但是检测成本较高,因此为节省成本,本实验仅对能够降解OTA的菌株进行HPLC-MS实验,进一步验证筛选出的菌株对OTA的降解作用,并利用分子生物学方法对它们进行鉴定[5-9]。筛选出的两株降解OTA菌株,目前还未见关于它们降解OTA的报道,这对以后生物降解OTA的研究具有重要意义。
1 材料与方法
1.1 试剂与培养基
乙腈、甲醇(均为色谱级) Teida公司;OTA标准品(纯度大于99%) Pribo Lab公司;其他试剂为分析纯。
PM培养基:酵母浸膏5 g、蔗糖10 g、蛋白胨5 g、麦芽糖2 g,蒸馏水1 000 mL;NA培养基:氯化钠5 g、蛋白胨10 g、牛肉粉3 g、琼脂20 g,蒸馏水1 000 mL;PA培养基:酵母浸膏5 g、蔗糖10 g、蛋白胨5 g、麦芽糖2 g、琼脂20 g,蒸馏水1 000 mL;NB培养基:氯化钠5 g、蛋白胨10 g、牛肉粉3 g,蒸馏水1 000 mL。
1.2 仪器与设备
安捷伦1100高效液相检测仪(配有荧光检测器)美国安捷伦公司;LXQ液相色谱-质谱联用仪 美国Thermo公司。
1.3 OTA标准曲线的制作
1.3.1 色谱条件
Agilent ZORBAX SB-C18反相色谱柱(250 mm×4.6 mm,5 øm);柱温30 ℃;流动相为乙腈-1%乙酸(60∶40,V/V);流速1.0 mL/min;进样量20 øL;激发波长(Ex)为333 nm,发射波长(Em)460 nm。
1.3.2 具体操作
将1 mg OTA溶解于10 mL的甲醇中,制成100 μg/mL的OTA储备溶液,保存于-20 ℃。利用该储备液,以甲醇为溶剂分别配制2 000、1 000、100、50、25、5 ng/mL的OTA标准溶液Ⅰ,在已确定的1.3.1节所述的色谱条件下,测定不同质量浓度OTA标准溶液Ⅰ的色谱峰面积,多次测量取平均值。根据色谱峰面积与OTA质量浓度关系作出OTA的标准曲线。
1.4 水系OTA样品前处理方法的建立
1.4.1 OTA标准溶液Ⅱ的制备
利用OTA储备液,以PM液体培养基为溶剂,分别制备2 000、1 000、100、50 ng/mL的OTA标准溶液Ⅱ。1.4.2 最优溶剂及体积的确定
以质量浓度为1 μg/mL的OTA标准溶液Ⅱ为实验对象,分析添加不同量的甲醇对测定结果的影响:取1 μg/mL的标准溶液Ⅱ200 μL,分别按照标准溶液Ⅱ与甲醇体积比为1∶1、1∶2、1∶3的比例加入200、400、600 μ L甲醇,旋涡振荡30 s混匀后,用0.22 μm的滤膜过滤后,利用高效液相色谱-荧光检测法(HPLC-fluorescence detector,HPLC-FLD)测定,计算OTA的回收率。
以同样的方法,按照标准溶液Ⅱ与乙醇体积比为1∶1、1∶2、1∶3的比例加入200、400、600 μL乙醇,旋涡振荡、过滤后,测定并计算OTA的回收率。
1.4.3 OTA回收率的计算

式中:ρ为实际测得的OTA质量浓度/(μg/mL);ρ0为OTA的理论质量浓度/(μg/mL)。
1.4.4 进一步验证方法的可行性
通过以上实验结果,选择回收率最高的溶剂添加量处理质量浓度分别为2 000、1 000、100、50 ng/mL OTA标准溶液Ⅱ,测定其OTA质量浓度,并计算回收率,同时对比不添加任何溶剂,直接用0.22 μm滤膜过滤的标准品的回收率。
1.5 降解OTA菌株的初步筛选
1.5.1 菌种的分离
在葡萄园中收集土样、枝叶以及果实后,将其包装在无菌袋中,尽量在当天运回实验室。采用梯度稀释法、平板涂布法分离单菌落。
1.5.2 菌种活化
将分离到的细菌培养在NA斜面上约24 h,酵母培养在PA斜面上约48 h;培养后的菌株置于4 ℃冰箱保存。
1.5.3 菌悬液浓度的调节
用接种环挑取适量菌体到无菌生理盐水中,调节菌体浓度为1×107CFU/mL;酵母菌用血球计数板计数,细菌用分光光度计计数,在波长600 nm处测定OD值为2.0时,菌液浓度约为1×108CFU/mL。
1.5.4 降解OTA菌株的筛选
向50 mL液体培养基(酵母菌用PM培养基,细菌用NB培养基)中加入适量OTA储备溶液,以调节OTA的初始质量浓度约为1 μg/mL;然后加入1 mL菌浓度为1×108CFU/mL待测菌液,分别在37 ℃和28 ℃的条件下,摇床培养分离到的细菌和酵母;同时,以不加微生物仅加入OTA的液体培养基作为阴性对照。每天定时取样,取样一周,利用1.4节建立的方法处理样品,测定OTA质量浓度。
1.5.5 OTA降解率的计算

式中:ρ为初始OTA质量浓度/(μg/mL);ρ0为1 周后样品中OTA质量浓度/(μg/mL)。1.6 液相色谱-质谱联用法(LC-MS)验证菌株降解OTA的作用
1.6.1 质谱条件
ESI检测器参数:喷雾电压4 500 V;毛细管电压30 V;毛细管温度325 ℃;正离子模式下,扫描质荷比m/z范围为100~600;母离子m/z 404。
1.6.2 样品预处理
按1.4节方法制备OTA的初始质量浓度为2 μg/mL的OTA标准溶液Ⅱ,然后加入1 mL菌浓度为1×107CFU/mL待测菌液,分别在37 ℃和28 ℃条件下,摇床培养分离到的细菌和酵母;对照仅加入OTA不加任何微生物。培养3 d后,取样300 μL,并加入300 μL乙醇,漩涡振荡30 s混匀,用0.22 μm的滤膜过滤后进行LC-MS测定。
1.7 降解OTA菌株的鉴定
1.7.1 DNA的提取
用接种环挑半环菌于100 μL无菌双蒸水中,混匀,于聚合酶链式反应(polymerase chain reaction,PCR)仪100 ℃加热15 min,以破裂细胞壁,最后再加200 μL无菌双蒸水,即得模板DNA,将其保存于-20 ℃冰箱中备用。
1.7.2 序列分析
细菌采用的16S rDNA序列分析法,使用引物为27F(5’-AGAGTTTGATCTGGCTCAG-3’)和1492R(5’-AAGGAGGTGATCCAGCC-3’);酵母菌采用的5.8S rDNA-ITS序列分析法,使用引物为ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)。
2 结果与分析
2.1 菌株的分离结果
在葡萄园中主要分离到6 株菌,分别标记为Y-1、Y-2、Y-3、Y-4、Y-5和B-1,其中B-1为细菌,其他均为酵母菌。
2.2 OTA的标准曲线
采用HPLC-FLD测定不同质量浓度(5、25、50、100、1 000、2 000 ng/mL)OTA的标准曲线,由该曲线得到峰面积与OTA 质量浓度之间的关系为:y=2.645x+ 1.400 3,线性相关系数R2为0.999 5,即OTA质量浓度与HPLC检测峰面积呈高度线性关系。
2.3 水系OTA样品前处理方法的建立
2.3.1 溶剂种类及添加量对OTA标准溶液Ⅱ回收率的影响

表1 添加不同体积的甲醇对OTA回收率的影响Table1 OTA recovery by adding different volumes of methanol

表2 添加不同体积的乙醇对OTA回收率的影响Table2 OTA recovery by adding different volumes of ethanol
由于OTA易溶于极性有机溶剂,因此首先考察了添加不同体积的甲醇和乙醇对OTA标准溶液回收率的影响。表1和表2分别对比了在水系溶液中,添加不同体积的甲醇和乙醇对OTA回收率的影响。由表可以看出,加入不同体积的甲醇或乙醇,OTA回收率均在95%左右,且互相之间没有显著性差异。因此选择1∶1的溶剂添加量(200 μL)处理样品,既可以获得较高的回收率,又节约了溶剂。
2.3.2 添加溶剂对不同质量浓度的OTA标准溶液回收率的影响
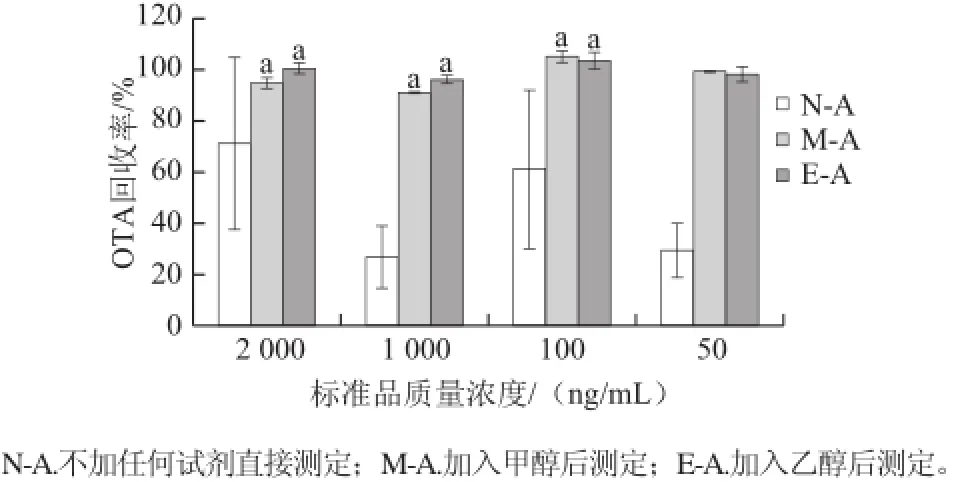
图1 不同方法处理样液后OTA回收率Fig.1 Recovery rates of OTA determined by different alcohols or nothing
由图1可知,当甲醇或乙醇以1∶1的添加量处理不同质量浓度的标准品溶液Ⅱ时,均能得到较高的OT A回收率(>94%),且互相之间没有显著性差异,这表明此方法对低质量浓度和高质量浓度的水系中OTA测定都适用;但是当不添加任何溶剂、直接取样液过滤后进行测定,得到的OTA回收率结果普遍偏低,且数据稳定性不好、相对偏差较大。考虑到乙醇相对于甲醇的毒性小,最后选取乙醇用于后面实验中OTA的测定。
2.4 降解OTA菌株的筛选
2.4.1 HPLC法对降解OTA菌株的初筛

图2 OTA在不含微生物的培养基中的自然降解情况Fig.2 OTA degradation in medium not inoculated with microorganisms
由图2可知,在28 ℃摇床条件下培养一周,不加微生物的PM培养基和NB培养基中,OTA的降解率几乎均为零,这也表明了OTA在自然条件下稳定性极强、很难降解的特性。OTA质量浓度略有波动,可能是由于测定时,因环境因素(如温度、光照)的略微变化对荧光强度造成影响而引起的;而后期OTA的质量浓度略有增大,可能是由于水分的蒸发造成的。


图3 实验菌株对OTA的降解效果Fig.3 OTA degradation by isolated strains
所分离的各菌株对OTA的降解效果见图3,可以看出菌株Y-2(图3B)在培养1 d后就能够降解23% OTA,在第2天降解率达到最大,为83%;与之对比,菌株B-1(图3F)具有更强的降解OTA的能力,培养2 d后OTA的降解率达到了90%,到第3天,在实验条件下已经检测不到OTA。
2.4.2 利用LC-MS进一步验证降解菌株对OTA的降解作用

图4 OTA的LC-MS总离子流图Fig.4 LC-MS total ion chromatograms of OTA before and after microbial degradation
由图4可知,通过总离子流图谱(t o t a l i o n chromatogram,TIC)可以看出对照在5.9 min左右有一个明显的峰(图4A),而加入菌株Y-2(图4B)和B-1(图4C)的溶液中在该处基本都没有峰,此外没有发现新物质的产生。因此这一结果进一步验证了菌株B-1和Y-2具有降解OTA的作用。

图5 菌株B-1的进化树Fig.5 Phylogenetic tree of B-1

图6 菌株Y-2的进化树Fig.6 Phylogenetic tree of Y-2
2.5 降解OTA菌株的鉴定
由图5、6可知,菌株B-1和菌株Y-2分别与Brevundimonas vermicularis strain KNUC9003、Yarrowia lipolytica strain GX4-1A有亲缘关系;即菌株B-1为泡囊短波单胞菌(Brevundimonas vermicularis),而菌株Y-2为耶罗维亚酵母(Yarrowia lipolytica)。
3 讨 论
甲醇或乙醇是极性较大的有机溶剂,与水互溶。OTA易溶于甲醇或乙醇但不溶于水。因此当往OTA水溶液中加甲醇或乙醇,能够使得两者成为互溶的体系,OTA溶于此体系,利用此原理省却了萃取的繁琐步骤。实验结果表明,在水系溶液中测定OTA含量的时候,直接过滤进行HPLC测定引入的误差大、且实验数据稳定性差。而无论添加甲醇还是乙醇对样品进行前处理,都能够得到较高的OTA回收率(>94%),准确地反映OTA的质量浓度。当甲醇或乙醇分别以1∶1、2∶1、3∶1的添加比例处理样品时,OTA的回收率没有显著性差异。也即随着甲醇或乙醇加入量的增加,OTA的回收率并没有增加。因此当甲醇或乙醇以1∶1的添加比例处理样品时即可满足测定的要求。根据这一现象也可推断OTA回收率没有达到100%可能是人为或系统误差造成的。
降解实验结果表明,分离到的菌株B-1和Y-2对OTA均具有很好的降解效果,且通过总离子图可以看出,此试验条件下并没有检测到生物降解OTA可能产生的代谢物,关于这一点还需在更深层次上进行进一步分析。
分别对B-1、Y-2这两株菌的rDNA-ITS、16S rDNA序列扩增、测序以及构建系统发育树,确定菌株B-1为泡囊短波单胞菌(Brevundimo nas vermicularis),菌株Y-2为耶罗维亚酵母(Yarrowia lipolytica)。泡囊短波单胞菌是一种罕见的条件致病菌,主要存在于土壤中,目前关于它的报道都是一些致病方面的,它能够引起关节炎、脑膜炎、肝脓肿以及血液疾病等[10-11]。此外,虽然泡囊短波单胞菌引起的发病率以及死亡率,目前尚不清楚,但是实验过程中使用这种菌的时候仍需要慎重。耶罗维亚酵母是在1942年首次分离得到的,它曾先后被命名为Candida lipolytica、Endomycopsis lipolytica、Saccharomycopsis lipolytica,最终定名为Yarrowia lipolytica[12]。耶罗维亚酵母能够利用甘油、乙酸、脂肪酸以及多种烃类等物质作为碳源,这一生长的特性,赋予了它对较恶劣的环境的抵御能力,使得它在有机废弃物治理、污水处理方面得到广泛的研究,这在国内外文献中均见有关研究报道[8,13-16];此外,在非模式酵母菌株中,耶罗维亚酵母的表达系统被看作是最具有开发潜力的,因此经常被用于外源蛋白的表达[9-18];但目前关于耶罗维亚酵母降解毒素的研究尚未见报道。
[1] ABRUNHOSA L, SERRA R, VENANCIO A. Biodegradation of ochratoxin A by fungi isolated from grapes[J]. Journal of Agricultural and Food Chemistry, 2002, 50: 7493-7496.
[2] VARGA J, PETERI Z, TABORI K, et al. Degradation of ochratoxin A and other mycotoxins by Rhizopus isolates[J]. International Journal of Food Microbiology, 2005, 99: 321-328.
[3] CRISTINA J, LILIANA G, JOSE M, et al. Accelerated solvent extraction of ochratoxin A from rice samples[J]. Agriculture and Food Chemistry, 2005, 53: 9348-9351.
[4] 谢春梅, 王华. 葡萄与葡萄酒中赭曲霉毒素A检测方法研究进展[J].酿酒科技, 2007(3): 92-96.
[5] 李凤琴. 赭曲霉毒素A分析方法进展[J]. 中国食品卫生杂志, 2004, 16(6): 545-550.
[6] 燕勇, 李卫平, 高雯洁, 等. rDNA-ITS序列分析在真菌鉴定中的应用[J].中国卫生检验杂志, 2008, 18(10): 1958-1961.
[7] 孙广宇, 彭友良, 李振歧, 等. 核苷酸序列分析在真菌系统学研究中的应用[J]. 西北农林科技大学学报: 自然科学版, 2003, 31(6): 187-192.
[8] BAKEER G C, SMITH J J, COWAN D A. Review and re-analysis of domain-specific 16S primers[J]. Journal of Microbiological Methods, 2003, 55(3): 541-555.
[9] GOTO K, OMURA T, HARA Y, et al. Application of the partial 16S rDNA sequence as an index for rapid identification of species in the genus[J]. Journal of General and Applied Microbiology, 2000, 46: 1-8. [10] ZHANG Chuncheng, HSU H J, LI C M. Brevundimonas vesicularis bacteremia resistant to trimethoprim-sulfamethoxazole and ceftazidime in a tertiary hospital in Southern Taiwan[J]. Journal of Microbiology, Immunology and Infection, 2012, 45: 448-452.
[11] YOO S H, KIM M J, ROH K H. Liver abscess caused by Brevundimonas vesicularis in an immunocompetent patient[J]. Journal of Microbiological Methods, 2012, 61: 1476-1479.
[12] 赵鹤云, 黄瑛, 杨江科, 等. 解脂耶氏酵母表达系统研究进[J]. 生物加工过程, 2008, 6(3): 10-16.
[13] FICKERS P, BENETTI P H, WACHE Y, et al. Hydrophobic substrate utilisation by the yeast Yarrowia lipolytica and its potential applications[J]. FEMS Yeast Research, 2005, 5(6/7): 527-543.
[14] LANCIOTTI R, GIANOTTI A, BALDI D. Use of Yarrowia lipolytica strains for the treatment of olive mill waste water[J]. Bioresource Technology, 2005, 96: 317-322.
[15] 池振明, 赵新灵, 王凌飞. 解脂耶罗维亚酵母(Yarrowia lipolytica)的代谢工程[J]. 中国海洋大学学报, 2012, 42(5): 55-59.
[16] MADZAK C, GAILLARDIN C. Heterologous protein and secretion in the non-conventional yeast Yarrowia lipolytica: a review[J]. Biotechnology, 2004, 109: 63-81.
[17] FREDRICKS D N, FIEDLER T L, MARRAZZO J M. Molecular identification of bacteria associated with bacterial vaginosis[J]. New England Journal Medicine, 2005, 353(18): 1899-1911.
[18] BARTH G, BECKERICH J M. Functional gentics of industrial yeasts[M]. New York: Springer Verlag, 2003.
Screening and Identification of Microorganisms for Ochratoxin A Degradation
WANG Jun-jun, ZHANG Hong-yin*, YANG Qi-ya
(School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, China)
An optimized method for determining of ochratoxin A (OTA) in aqueous solution was proposed, and screening of si x strains isolated from vineyard soil for microbial OTA degradation was performed using the developed method. By adding either methanol or ethanol, the recovery rate of OTA in aqueous solution was increased to more than 90%, and its concentration could accurately determined at an addition ratio of 1:1 by volume. It was demonstrated that B-1 (bacterium) and Y-2 (yeast) were able to degrade OTA. After incubation for two days, B-1 reduced 87% of OTA, and it was thoroughly degraded another day later. Y-2 showed similar ability to degrade OTA, with a degradation rate of 84% after two-day cultivation, and the concentration of residual OTA was stable in the following days. Moreover, LC-MS was used to detect OTA byproducts. Finally, through sequence analysis of the 16S rDNA and 5.8S internal transcribed spacer (ITS) ribosomal DNA (rDNA) regions, respectively, B-1 was identified as Brevundimonas vesicularis, while Y-2 as Yarrowia lipolytica.
ochratoxin A (OTA); recovery; degradation; microorganisms; screening; identi fication
TS262.6;TS201.6
A
1002-6630(2014)21-0154-05
10.7506/spkx1002-6630-201421030
2014-06-15
国家自然科学基金面上项目(31271967);教育部高等学校博士学科点专项科研基金项目(20123227110015);镇江市科技支撑计划(农业)项目(NY1013004)
王峻峻(1987—),女,硕士,研究方向为水果的采后保鲜。E-mail:hmn23_44@126.com
*通信作者:张红印(1972—),男,教授,博士,研究方向为水果的采后保鲜。E-mail:zhanghongyin126@126.com
