中华鳖腿肉蛋白质体内外消化研究
2014-03-08王锡昌
张 丹,王锡昌*
(上海海洋大学食品学院,上海 201306)
中华鳖腿肉蛋白质体内外消化研究
张 丹,王锡昌*
(上海海洋大学食品学院,上海 201306)
通过测定氨基酸组成、体内外蛋白质消化率及经蛋白质消化率校正的氨基酸评分(protein digestibilitycorrected amino acid scores,PDCAAS)等指标,评价热处理前后中华鳖腿肉蛋白质的营养价值。结果表明:中华鳖腿肉热处理前后必需氨基酸含量分别为36.84%、34.55%(以干质量计),占氨基酸总量的41.12%、40.20%,其构成符合联合国粮农组织/世界卫生组织推荐的理想模式。热处理前,测得中华鳖腿肉蛋白质体外消化率为83.68%,体内消化率为95.05%;热处理后,测得其体外消化率为87.04%,体内消化率为96.18%,热处理后消化率显著提高(P<0.05)。结合氨基酸评分及真实消化率,计算得到热处理前其PDCAAS为100%,由于蒸煮过程营养物质的流失,测得热处理后Trp氨基酸评分最低为80,热处理后其PDCAAS为76.94%。
中华鳖;体内消化;体外消化;经蛋白质消化率校正的氨基酸评分
中华鳖(Trionyx sinensis),俗称甲鱼、团鱼等,是我国特色水产品。据联合国粮农组织渔业统计数据,2012年全球中华鳖养殖产量已达到33.6万 t,其中98.77%产自中国[1]。中华鳖腿肉蛋白质含量高达18.20%[2],是人体摄取蛋白质的良好来源。蛋白质的营养价值,一方面取决于其含量,另一方面在很大程度上取决于其氨基酸组成及消化率。蛋白质消化率反映了蛋白质在消化道内被分解的程度,消化率越高,则被机体利用的可能性越大,营养价值越大[3]。目前消化率的研究主要包括体外消化实验及体内消化实验两种方法[4]。1991年联合国粮农组织(The Food and Agriculture Organization of United States,FAO)/世界卫生组织(World Health Organization,WHO)蛋白质品质评价专家委员会公布并推荐通过蛋白质消化率校正的氨基酸评分(protein digestibility-corrected amino acid scores,PDCAAS)这一指标来衡量蛋白质质量[5]。PDCAAS综合考虑氨基酸评分及真实消化率,能较好地评价蛋白质品质,为测定蛋白质品质的首选方法[6-7]。
前人关于中华鳖蛋白质营养价值的研究,主要从蛋白质含量、蛋白质组成、氨基酸组成及功能性蛋白方面进行[2,8-9]。对于中华鳖蛋白质的消化率及通过真实消化率来计算的PDCAAC尚未见报道。本实验从体外、体内消化实验及PDCAAS的角度,分析评价热处理前后中华鳖腿肉的蛋白质营养特性,一方面对热处理对蛋白质品质的影响进行初步探讨,另一方面为中华鳖腿肉蛋白质更全面的营养价值评价提供参考。
1 材料与方法
1.1 材料与试剂
中华鳖由上海尚达水产科技发展有限公司提供,体质量为550~750 g,样品数量20 只。饲料由南通特洛菲饲料科技有限公司按照美国AIN-93标准生产。实验大鼠由上海汤宝生物科技服务社提供,清洁级,雄性Sprague-Dawley(SD)大鼠,体质量为50~70 g。
胃蛋白酶(P7000)、胰酶(V900486) 美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
Kieltel 8400凯氏定氮仪 丹麦福斯公司;L-8800氨基酸自动分析仪 日本日立公司;970CRT荧光分光光度计 日本岛津公司。
1.3 方法
1.3.1 样品前处理
将鲜活的中华鳖宰杀,取腿部肌肉搅碎后分成3 部分。一部分直接分装,于-20 ℃条件下保存;一部分进行冷冻干燥处理,得到生中华鳖粉;最后一部分进行蒸煮处理(温度100 ℃、时间15 min、料液比1∶1.5)后,再进行冷冻干燥获得熟中华鳖粉。
1.3.2 饲料加工
饲料配方如表1所示。
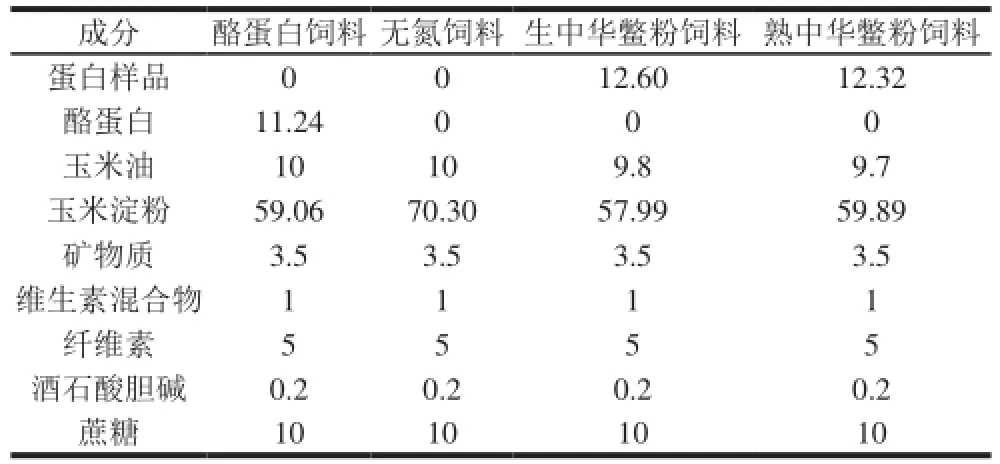
表1 蛋白质体内消化实验饲料配方Table1 Feed formulations used for in vivo protein digestion trials g/100 g
1.3.3 氨基酸组成的测定
使用氨基酸自动分析仪测定除色氨酸外的17 种氨基酸含量[10],色氨酸含量采用荧光分光光度法[11]测定。
1.3.4 蛋白质体外消化实验
参照Akeson等[12]建立的胃蛋白酶-胰酶体外消化模型进行实验,并略作修改。
1.3.4.1 模拟胃液(simulated gastric fluid,SGF)消化实验
称取0.5 g搅拌均匀的腿肉于三角烧瓶中,添加15 mL模拟胃液(0.1 g胃蛋白酶溶于1 L 0.1 mol/L盐酸,pH 1.5),在恒温振荡水浴锅中37 ℃水浴3 h进行消化。1.3.4.2 模拟肠液(simulated intestinal fl uid,SIF)消化实验
用0.2 mol/L的NaOH将1.3.4.1节消化液pH值调整到8.0。之后在反应体系中加入7.5 mL含有0.005 mol/L NaN3的模拟肠液(0.533 g胰酶溶于1 L pH 8.0的磷酸盐缓冲液),继续在恒温振荡器水浴锅中37 ℃水浴加热24 h。
模拟肠液消化实验结束后,向反应体系中添加10 mL 20%的三氯乙酸(trichloroacetic acid,TCA)终止反应。
1.3.4.3 体外蛋白质消化率计算
模拟胃液消化率(protein digestibility in gastric fl uid,PDG)、模拟肠液消化率(protein digestibility in intestinal fluid,PDI)及总消化率(total protein digestibility,PDT)按照公式(1)~(3)进行计算。
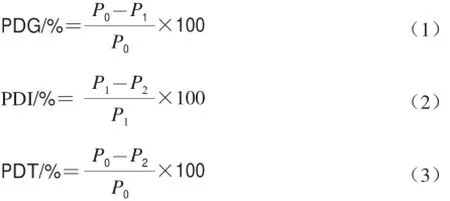
式中:P0为样品中的蛋白质含量/(g/100 g);P1为模拟胃液消化后剩余蛋白质含量/(g/100 g);P2为模拟肠液消化后剩余蛋白质含量/(g/100 g)。
1.3.5 蛋白质体内消化实验
1.3.5.1 体内消化实验
参照AOAC 991.29《True Protein Digestibility of Foods and Food Ingredients》及Wong等[13]的方法,采用大鼠粪氮平衡实验进行蛋白质体内消化研究。实验室饲养SD大鼠2 d后,随机分成4 组:标准酪蛋白组、无氮饲料组、生中华鳖粉组及熟中华鳖粉组。其中酪蛋白饲料(蛋白质含量10%)为对照组,无氮饲料为空白组,生中华鳖粉及熟中华鳖粉饲料(蛋白质含量10%)为实验组。每组8只,每只大鼠在代谢笼中单笼饲养。饲养实验分为4 d的预备期和5 d的平衡期。在5 d的平衡期中,每天收集未摄食的饲料残渣及老鼠粪便、尿液,并分装在不同的容器中。饲料残渣收集后风干3 d,之后进行称质量。大鼠粪便及残渣经100 ℃干燥、称质量、研磨后进行蛋白质含量的测定。整个实验过程,保证大鼠自由饮水,限制每只大鼠摄食量为15 g/d。
1.3.5.2 评价指标计算
蛋白质真实消化率(true digestibility,TD)、生物价(biological value,BV)、净蛋白利用率(net protein utilization,NPU)以及蛋白质消化率校正的氨基酸评分分别根据公式(4)~(7)计算[14]。

式中:Ni为摄入氮含量/(mg/d);Fn为粪氮含量/(mg/d);Fk为粪代谢氮含量/(mg/d);Un为尿氮含量/(mg/d);Uk为尿内源氮含量/(mg/d);LAAS为最低限制性氨基酸评分(limiting amino acids score)。
1.4 数据处理
数据采用SPSS 20.0进行单因素方差显著性分析,统计值用±s表示,P<0.05表示差异显著。
2 结果与分析
2.1 氨基酸组成分析
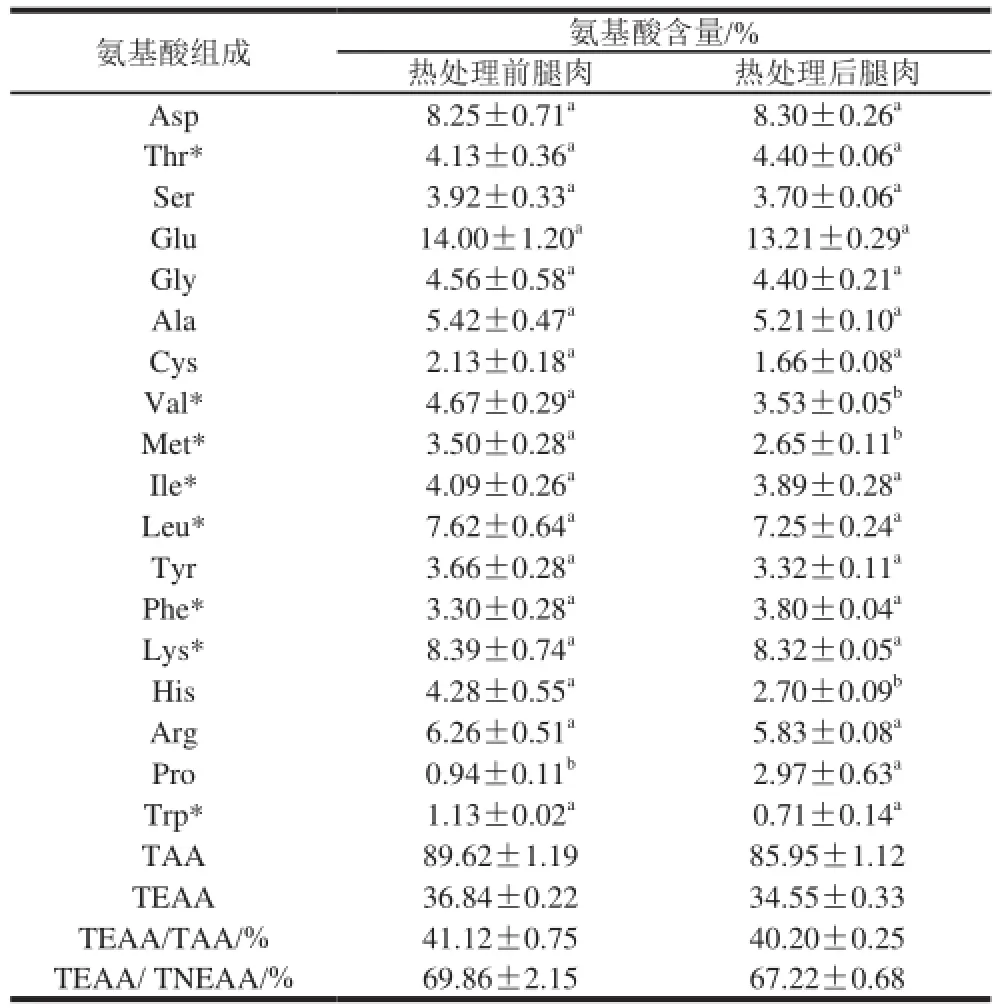
表2 热处理前后中华鳖腿肉的氨基酸组成(x±s,n=3)Table2 Amino acid composition of Chinese soft-shelled turtle muscle protein (x±s,n= 3)
由表2可知,热处理前后样品中均检测出18 种氨基酸,其中谷氨酸含量最高,分别为14.00%、13.21%。热处理过程中由于营养物质流失到蒸煮液中,中华鳖腿肉氨基酸总量(total amino acids,TAA)、必需氨基酸总量(total essential amino acids,TEAA)均低于热处理前的样品。热处理前后,两者TEAA/TAA、TEAA/非必需氨基酸总量(total nonessential amino acids,TNEAA)均符合FAO/WHO推荐的TEAA/TAA为40%左右、TEAA/TNEAA在60%以上这一理想氨基酸组成模式[15],为优质蛋白质来源。

表3 热处理前后中华鳖腿肉必需氨基酸含量及其评分Table3 Contents and amino acid scores of essential amino acids in Chinese soft-shelled turtle meat
由表3可知,热处理前后样品必需氨基酸总量均高于FAO/WHO推荐的32.0[6],但低于鸡蛋中的49.0。根据氨基酸评分(amino acid scores,AAS),Trp的AAS在热处理前、后的样品中均表现最低,分别为115、80。热处理前中华鳖腿肉必需氨基酸评分均高于100,与汤峥嵘等[16]的研究结果一致,氨基酸组成十分均衡,为优质蛋白质来源。
2.2 体外消化实验

表4 热处理前后中华鳖腿肉蛋白质体外消化率(x±s,n=3)Table 4in vitro digestibility of Chinese soft-shelled turtle protein (x±s, n= 3) %
前期实验测得,热处理前中华鳖腿肉蛋白质含量为18.20%,热处理后腿肉蛋白质含量为24.36%[2]。由表4可知,经过整个蛋白质体外消化过程,热处理前其腿肉蛋白质消化率为83.68%,高于带鱼[17]的80.96%、牛肉[12]的80%等肉类。在胃液中,胃蛋白酶能水解含芳香族氨基酸、蛋氨酸、亮氨酸等氨基酸残基的蛋白质,把蛋白质分解成多肽。但由于胃蛋白酶的消化作用较弱,食物在胃中停留时间较短,所有蛋白质在胃中的消化很不完全。食糜进入小肠后,蛋白质的不完全水解产物会在肠液中进一步被分解[18]。整个消化过程中,71.79%的蛋白质在模拟胃液中被分解,在模拟肠液中有11.89%的蛋白质及前者的不完全分解产物被进一步消化。
对比热处理前后中华鳖腿肉蛋白质消化率,可以发现经过热处理后的PDG、PDI及PDT值均高于热处理前,且PDG、PDT值差异显著(P<0.05),这个结论与Sun Minjie等[19]关于热处理对蛋白质消化率影响的研究结论类似。消化率的提高可能是热处理使蛋白质发生了不同程度的变性,比如蛋白质的伸展、重组,分子间氢键、二硫键部分断裂等,最终蛋白质结构的改变导致其消化率发生变化[20]。
2.3 体内消化实验
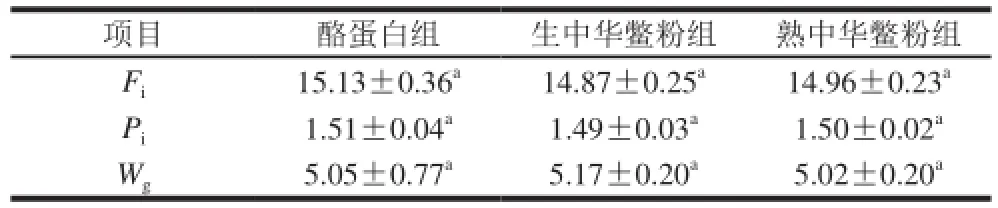
表5 体内消化实验中大鼠的摄食及体质量增加结果(x±s,n=8)Table5 Food intake and weight gain in rats from in vivo digestion trials (x±s,n= 8) g/d
表5是酪蛋白组与实验组大鼠摄食量(Fi)、蛋白摄入量(Pi)及体质量增量(weight gain,Wg)的结果,对照组(酪蛋白组)与实验组在摄食、蛋白摄入量、体质量增量上没有显著性差异(P>0.05)。理论上通过体内消化实验评估蛋白质品质,如果实验组蛋白质品质低于酪蛋白组,动物的摄食就会减少。如果实验组与酪蛋白组的摄食量出现显著性差异,导致实验组摄入的蛋白质部分用于能量及蛋白组织的合成,则实验结果将会受到影响[21]。
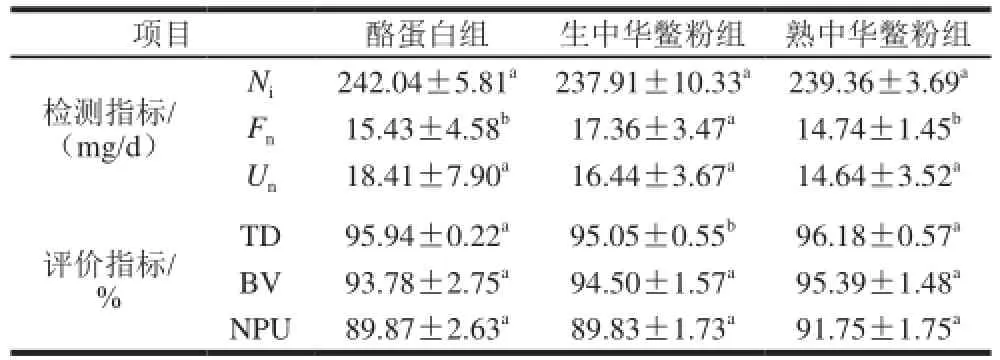
表6 热处理前后中华鳖蛋白质体内消化实验营养评价指标(x±s,n=8)Table6 Nutritional assessment indicators showing the in vivo digestibility of Chinese soft-shelled turtle protein (x±s,n= 8)
体外消化实验数据说明中华鳖腿肉蛋白质具有较好的消化性,且经过热处理中华鳖腿肉蛋白质的消化率呈现出显著性提升。为此,实验又进一步通过体内消化实验对结果进行了验证。实验结果如表6所示。热处理后中华鳖粉蛋白质消化率为96.18%,显著高于热处理前的95.05%,与体内消化率研究结果相同,进一步验证了热处理可以提高蛋白质消化率这一结论。对比酪蛋白组消化率,熟中华鳖粉与酪蛋白之间的消化率差异不显著,但两者均显著高于生中华鳖粉,说明热处理后的中华鳖腿肉蛋白质品质与酪蛋白相当,但低于牛肉的98%[5]。蛋白质生物价(BV)是反映食物蛋白质消化吸收后被机体利用程度的指标,BV值越高,说明被机体利用程度较高。中华鳖腿肉热处理前,其BV值为94.50%,略高于酪蛋白93.78%,差异不显著,但明显高于鱼肉(83%)、牛肉(76%)、猪肉(74%)[3]等肉类蛋白质。蛋白质净利用率(NPU)在BV的基础上,进一步考虑了在消化过程中未吸收而丢失的氮,将生物价乘以消化率。热处理前后中华鳖腿肉的NPU值与酪蛋白组均没有显著性差异。综上所述,中华鳖腿肉的TD、BV、NPU 3 个评价指标均表明其蛋白质具有较高的营养价值,可作为优质蛋白的来源。2.4 蛋白质消化率校正的氨基酸评分
PDCAAS是基于氨基酸组成与消化率的蛋白质评价指标,该指标综合考虑氨基酸评分及真实消化率,能较好的评价蛋白质品质。PDCAAS最大为100%,当PDCAAS大于100%时则认定为100%,表示蛋白质在消化后能够提供给机体需求的100%氨基酸[6,22]。由表3的氨基酸评分及表6的TD值分析得出,热处理前其PDCAAS为100%,热处理后中华鳖腿肉PDCAAS为76.94%。热处理前中华鳖腿肉蛋白质的PDCAAS与乳清蛋白、酪蛋白、鸡蛋蛋白、大豆蛋白等优质蛋白一致,高于牛肉92%[5],表明其营养价值高,易于消化吸收[23]。
3 结 论
中华鳖腿肉氨基酸组成、体内外消化实验及PDCAAS等研究结果均表明其蛋白质为优质蛋白质来源。中华鳖腿肉各必需氨基酸评分均高于100,且其PDCAAS得分为100%。热处理后的腿肉蛋白质由于蒸煮过程,一部分营养物质流失到汤汁中,总氨基酸含量减少,PDCAAS得分为76.94%。虽然热处理前后氨基酸组成发生了变化,但其TEAA/TAA、TEAA/TNEAA比值均符合FAO/WHO推荐的理想模式。
体外消化实验通过胃蛋白酶-胰酶消化模型模拟了食物在人体消化道内的消化过程,实验先后测定热处理前后中华鳖腿肉蛋白质在模拟胃液、模拟肠液消化率及总消化率。结果表明,中华鳖腿肉消化率为83.68%,热处理后其消化率显著提高(87.04%)。体内消化实验又通过大鼠粪氮平衡实验进一步对结果进行验证,热处理后蛋白质体内消化率96.18%高于热处理前蛋白质消化率95.05%。体内外消化消化实验表明热处理能提高中华鳖腿肉蛋白质消化率,更容易被人体消化吸收。
参考文献:
[1] FAO. Cultured Aquatic Species Information Programme Trionyx sinensis (Weigmann, 1834)[DB/OL]. http://www.fao.org/fishery/ statistics/global-aquaculture-production/query/en.
[2] 张丹, 王锡昌. 中华鳖肉蛋白质营养特征分析及评价[J]. 食品工业科技, 2014, 35(15): 236-239.
[3] 林洪. 水产品营养与安全[M]. 北京: 化学工程出版社, 2007: 25.
[4] 孙敏杰, 木泰华. 蛋白质消化率测定方法的研究进展[J]. 食品工业科技, 2011, 32(2): 382-385.
[5] FAO/WHO. Protein quality evaluation[C]//FAO food and nutrition paper No. 51. Rome: Food and Agriculture Organizations of the United Nations, 1991: 26-38.
[6] SCHAAFSMA G. The protein digestibility-corrected amino acid score[J]. The Journal of Nutrition, 2000, 130(Suppl 7): 1865-1867.
[7] 莫英杰, 张欣然, 王苏, 等. 国内外婴幼儿食品中蛋白质质量评价方法的对比研究[J]. 中国食品学报, 2011, 11(3): 168-173.
[8] 张丹, 王锡昌, 刘源. 中华鳖营养、风味及功能特性研究进展[J]. 食品工业科技, 2013, 34(24): 392-395.
[9] 刘彦, 刘承初. 甲鱼的营养价值与保健功效研究[J]. 上海农业学报, 2010, 26(2): 93-96.
[10] 中国预防医学科学院营养与食品卫生研究所. GB/T 5009.124— 2003 食品中氨基酸的测定[S]. 北京: 中国标准出版社, 2003.
[11] 吴芳, 郭卫东, 张润, 等. 荧光法测定微藻中色氨酸的含量[J]. 海洋科学, 2005, 29(10): 1-4.
[12] AKESON W R, STAHMANN M A. A pepsin pancreatin digest index of protein quality evaluation[J]. The Journal of Nutrition, 1964, 83(3): 257-261.
[13] WONG K, CHEUNG P C, ANG JR P O. Nutritional evaluation of protein concentrates isolated from two red seaweeds: Hypnea charoides and Hypnea japonica in growing rats[J]. Hydrobiologia, 2004, 512(1/3): 271-278.
[14] 邓泽元, 乐国伟. 食品营养学[M]. 南京: 东南大学出版社, 2007: 32-37.
[15] FAO/WHO Ad Hoc Expert Committee. Energy and protein requirments[M]. FAO Nutrition Meeting Report Series, 1973, 52: 40-73.
[16] 汤峥嵘, 王道尊, 谭玉钧. 中华鳖生化组成的分析: Ⅲ. 肌肉氨基酸的组成[J]. 水生生物学报, 1998, 22(4): 307-313.
[17] 张怡洁, 何芳, 俞吉, 等. 带鱼纯鱼肉重组工艺以及制品蛋白质体外消化的研究[J]. 食品与发酵工业, 2012, 38(6): 17-21.
[18] 孙远明. 食品营养学[M]. 北京: 中国农业大学出版社, 2010: 22.
[19] SUN Minjie, MU Taihua, ZHANG Miao, et al. Nutritional assessment and effects of heat processing on digestibility of Chinese sweet potato protein[J]. Journal of Food Composition and Analysis, 2012, 26(1/2): 104-110.
[20] 张敏, 李宏军, 高忠诚. 挤压膨化加工对食品中营养成分的影响[J].北方园艺, 2003(3): 63-64.
[21] CARIAS D, CIOCCIA A M, HEVIA P. Effect of food intake on protein quality measured in chicks by traditional or biochemical methods[J]. Journal of the Science of Food and Agriculture, 1998, 78(4): 479-485.
[22] BOYE J, WIJESINHA-BETTONI R, BURLINGAME B. Protein quality evaluation twenty years after the introduction of the protein digestibility corrected amino acid score method[J]. British Journal of Nutrition, 2012, 108(Suppl 2): 183-211.
[23] 李洁莹. 蛋白质粉的营养价值评价及对老年大鼠的抗衰老研究[D].广州: 南方医科大学, 2013: 32.
Digestibility in vitro and in vivo of Chinese Soft-Shelled Turtle Protein
ZHANG Dan, WANG Xi-chang*
(College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
The nutritional value of Chinese soft-shelled turtle leg muscle protein before and after heat treatment was evaluated based on amino composition, in vitro and in vivo digestibility and protein digestibility-corrected amino acid score (PDCAAS). The results showed that the contents of essential amino acids were 36.84% and 34.55%, respectively before and after heat treatment. The ratios of total essential amino acids to total amino acids (TEAA/TAA) were 41.12% and 40.20%, respectively, meeting the FAO/WHO standard. The in vitro and in vivo digestibility of Chinese soft-shelled turtle protein were 83.68% and 95.05%, and increased to 87.04% and 96.18%, respectively after heat treatment. These results suggested that heat treatment signif i cantly increased the in vitro and in vivo digestibility (P < 0.05). The PDCAAS of Chinese softshelled turtle, as calculated by multiplying the limiting amino acid score by protein digestibility, reduced from 100% to 76.94% due to the nutrient losses during cooking.
Chinese soft-shelled turtle; in vitro digestibility; in vivo digestibility; protein digestibility-corrected amino acid scores (PDCAAS)
TS254.1
A
1002-6630(2014)21-0113-05
10.7506/spkx1002-6630-201421022
2014-06-30
上海市科委工程中心建设项目(11DZ2280300);上海市教委重点学科建设项目(J50704);上海高校知识服务平台《上海海洋大学水产动物遗传育种中心》项目(ZF1206)
张丹(1990—),女,硕士研究生,研究方向为食品营养与安全。E-mail:546392607@qq.com
*通信作者:王锡昌(1964—),男,教授,博士,研究方向为食品营养与安全。E-mail:xcwang@shou.edu.cn
