三步沉淀法纯化 鸡卵类黏蛋白
2014-03-08吴子健王素英刘建福
王 帅,吴子健,*,王素英,刘建福,张 伟,帖 航,荣 强
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津市青年职业技术学院烹 饪系,天津 300191)
三步沉淀法纯化 鸡卵类黏蛋白
王 帅1,吴子健1,*,王素英1,刘建福1,张 伟1,帖 航1,荣 强2
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津市青年职业技术学院烹 饪系,天津 300191)
鸡卵类黏蛋白(hen’s e gg ovomucoid,HOVM)是鸡蛋清中最重要的过敏原蛋白,探讨三步沉淀(一步三氯乙酸沉淀以及两步硫酸铵盐析沉淀)从鸡蛋清中提取并纯化HOVM的工艺条件,并利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳以及高效液相色谱(high performance liquid chromatography,HPLC)技术检测纯化效果。结果表明:用等体积去离子水稀释的鸡卵清液加入质量分数10%三氯乙酸去除大部 分杂蛋白后,所得上清液加入硫酸铵至终饱和度50%,盐析沉淀进一步去除非HOVM的杂蛋白,上清液中最后再追加硫酸铵至终饱和度80%,离心所得沉淀再经过透析冻干即为高纯度的HOVM;HPLC(检测波长220nm)检测所获HOVM的纯度为99.202%,此工艺条件下得到HOVM的提取率约为27.05%。
鸡卵类黏蛋白;三步沉淀;盐析
鸡卵类黏蛋白(hen’s egg ovomucoid,HOVM)是一种单亚基糖蛋白,等电点约为4.1,约占鸡蛋清蛋白总量的11%,分子质量约为28 kD。该蛋白中蛋白部分约占75%~80%[1-2],含186 个氨基酸残基以及9 个二硫键;而糖基部分约占20%~25%[3-4]。HOVM是目前已知鸡蛋中变态反应原性最强的蛋白[4-6],由于其结构紧密,且具耐热、耐酸碱以及抗胰蛋白酶消化等特性[5-6],因而其致敏性难以克服,且作用持久。更甚之,即便利用蛋白酶酶解将其降解成肽段,这些降解后的片段仍具有一定抗原性和过敏原性。这些都严重威胁着过 敏人群(特别是婴幼儿)的机体健康,甚至是生命安全[7-8]。研究分析该分子的结构与性质,特别是其结构与其过敏原性的关系,以及如何消减其过敏原性等基础研究需要一定量的高纯度HOVM(最佳纯度不小于99%),因此能简便地获取高纯度HOVM对于后续的研究与应用具有十分重要的意义。
目前文献报道的HOVM分离纯化方法包括沉淀法[9-10](有机溶剂沉淀法和盐析法)、层析法[11-12](离子交换层析法和分子筛层析法)、双水相萃取法[13-14]和电泳法[15]等。其中双水相萃取法和电泳法处理量小且不具有实际应用价值[16-17];分子筛层析不仅成本高,且处理量很小,而离子交换层析的处理量有一定的提升,但其规模仍难以满足规模化制备的需要,且所用树脂介质较贵,技术也较为繁琐;目前分离纯化HOVM的沉淀技术多是利用二步沉淀法[9-10],即:第一步利用有机溶剂(如三氯乙酸(trichloroacetic acid,TCA))除去杂蛋白,然后利用盐析或有机溶剂沉淀法获得HOVM,该法处理量大、成本低、操作简便,但沉淀法的选择性较小, 目前利用该法分离所得的HOVM纯度均低于90%,还需利用其他技术,如层析技术或高效液相色谱(high performance liquid chromatography,HPLC)技术,进一步纯化,如史晓霞[18]利用TCA沉淀法结合丙酮沉淀法制备得到HOVM粗品,进一步通过离子交换层析纯化才能得到纯度约为95.3%的HOVM。为克服现有两步沉淀法获得HOVM普遍纯度低于90%的缺点,本研究以鸡蛋清为原料,利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和HPLC技术的检测手段,确定三步沉淀法获得高纯度HOVM的过程中各步骤的工艺条件。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋 市售;标准Marker(PageRuler Prestained Protein Ladder#Sm0672) 美国Fermentas公司;HOV M标 准品、考马斯亮蓝G-250、考马斯亮蓝R-250、四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED)、三羟甲基氨基甲烷(Tris)、SDS、丙烯酰胺(acrylamide,ACR)、甲叉双丙烯酰胺(bis-acrylamide,Bis)、过硫酸铵(ammo nium peroxydisulfate,AP)、甘油、β-巯基乙醇、三氟乙酸(色谱纯)、溴酚蓝 美国Sigma公司;乙腈(色谱纯) 美国J.T.Baker公司;去离子水、超纯水 实验室自制;其他试剂均为国产分析纯。
1.2 仪器与设备
2000ES全自动四元梯度高效液相色谱仪(配套UV1000紫外检测仪) 美国Allteach公司;FDU-810型EYELA冷冻干燥机 日本东京理化公司;3-18K低温高速离心机 德国Sigma公司;AUW120D型电子天平日本Shimadzu公司;164-5052电泳仪、164-8003小型垂直电泳槽 美国Bio-Rad公司;FiveEasy Plus™ pH计瑞士Mettler Toledo公司;78-1型磁力加热搅拌器 杭州仪表电机厂;新飞冷藏冷冻冰箱 河南新飞电器有限公司;TGL-16G型台式离心机 上海安亭科学仪器厂;KQ5200E型超声波清洗器 昆山市超声仪器有限公司;XW-80A微型漩涡混合仪 上海沪西分析仪器厂有限公司;电热恒温干燥箱 上海跃进医疗器械厂;214TP C4色谱柱 美国Grace Vydac公司。
1.3 方法
1.3.1 HOVM提取工艺流程
手工分离蛋清与蛋黄→蛋清预处理降低黏度→加入一定量10% TCA溶液(pH 1.15)并混合均匀→用1.0 mol/L NaOH溶液调节混合液pH值→4 ℃条件下静置4 h →离心(4℃,4 000×g)15 min→弃沉淀取上清液→量取上清液体积→4 ℃条件下24 h透析除去TCA →上清液中加入硫酸铵至一定饱和度→ 4 ℃条件下静置4 h →离心(4℃,4 000×g)15 min→弃沉淀取上清液→上清液中继续加入硫酸铵至更高的饱和度→4 ℃条件下再次静置4 h→再次离心(4 ℃,4 000×g)15 min→沉淀透析冻干→得到HOVM样品→SDS-PAGE电泳或HPLC检测纯度
1.3.2 鸡蛋清液的预处理
参照Guérin-Dubiard[19]、张晴晴[20]等的方法,略有改动,具体过程为:手工分离蛋清与蛋黄,得到蛋清并量取体积,加入等体积去离子水,4 ℃条件下磁力搅拌2.0 h,离心(4 ℃,4 000×g)15 min,弃沉淀与不溶物,上清液即为所得蛋清预处理液。
1.3.3 TCA法沉淀去除杂蛋白条件优化
按照史晓霞[18]的方法,略有改动。具体步骤如下:一定体积的蛋清预处理液中缓慢加入一定体积10% TCA溶液(pH 1.15)并混合均匀,其中预处理蛋清溶液与TCA溶液的体积比分别为1∶0.5、1∶1.0、1∶1.5、1∶2.0以及1∶2.5;并用NaOH溶液(1.0 mol/L)调节混合溶液pH值(分别为2.5、3.0、3.5、4.0和4.5),室温条件下静置4 h以上,离心(4℃,4 000×g)15 min,所得上清液透析去除TCA,再经冻干得到HOVM粗品。各条件下所得的样品,均复溶于同样体积的水中,再分别按照1.3.5节和1.3.6节方法进行SDS-PAGE和HPLC分析检测蛋白纯度。
1.3.4 两步盐析法纯化HOVM
选取1.3.3节所得的最佳预处理蛋清溶液与TCA溶液体积比,并用NaOH溶液调节至1.3.3节所得的最佳初始pH值,制备所得的HOVM粗提液中加入一定量的硫酸铵(饱和度分别为30%、40%、50%、60%、70%),4 ℃条件下静置4 h,离心(4℃,4 000×g)15 min后弃沉淀取上清液,并分别按照1.3.5节和1.3.6节方法进行SDSPAGE和HPLC分析检测蛋白纯度。
选取第一步盐析的最佳饱和度所得的蛋白上清液,继续加入一定量硫酸铵(饱和度分别至65%、70%、75%、80%以及100%),4 ℃条件下静置4 h后离心(4 ℃,4 000×g)15 min,弃上清液取沉淀,沉淀复溶于20.0 mL去离子水中,过夜透析后冻干。所得蛋白样品按照1.3.5节和1.3.6节方法进行SDS-PAGE和HPLC分析检测样品。
1.3.5 SDS-PAGE检测[21]
SDS-PAGE检测蛋白质样品条件:质量分数12%分离胶、5%浓缩胶、上样量10 μL、200 V恒压电泳1 h。
1.3.6 HPLC检测蛋白纯度[22]
色谱柱:Vydac 214TP C4(250 mm×4.6 mm,5 μm);柱温30 ℃,检测波长220 nm,进样量20 μL;流动相A:含0.1%三氟乙酸的水溶液,流动相B:含0.1%三氟乙酸的乙腈溶液。线性梯度洗脱程序:0.0 min,50%B;7.0 min,57%B;9.1 min,58%B;11.1 min,60%B;13.1 min,61%B;17.1 min,63%B。流速0.3 mL/min。
2 结果与分析
2.1 TCA添加量对HOVM纯化效果的影响

图1 TCA沉淀除杂蛋白时TCA添加量对HOVM提取效果的影响Fig.1 Effect of the amount of TCA added to remove non-HOVM proteins on the recovery of HOVM
鸡蛋清富含蛋白,除HOVM以外,含量较多蛋白质还包括卵白蛋白(含量约54%~69%)、卵转铁蛋白(含量约12%~13%)、溶菌酶(含量约3.4%~3.5%)、卵黏蛋白(含量约1.5%~3.5%)、球蛋白G2(含量约4.0%)和球蛋白G3(含量约4.0%)[23-24]。蛋清经预处理可有效去除卵黏蛋白,但仍含有大量的非HOVM蛋白[19]。因此接下来提取HOVM过程中利用沉淀法除去非HOVM的杂蛋白。HOVM具有特殊的溶解性能,能对TCA沉淀作用具有一定的抗性,即使在3%~5%的TCA溶液中也具有很好的溶解性,而此条件下蛋清中其他的蛋白溶解度却大大降低[9-10],因此可以利用TCA除去大部分杂蛋白。从图1A可以看出,2~6电泳道中具有一条较宽的电泳带,且颜色较深。HOVM含有20%~25%的糖基,含有如此高糖基含量的蛋白在做SDS-PAGE时,通常其条带较宽[17,25],本研究也验证了这点。从图1A还可知:当预处理的蛋清溶液与10% TCA溶液体积比为1∶0.5(图1A中第6电泳道)时,上清液中仍然含有一定量的杂蛋白,而通过HPLC检测发现在保留时间为10.385 min时有69.053%的杂蛋白,通过与标准分子质量蛋白Marker比对,发现此时主要的杂蛋白为分子质量约45k D的蛋白,推测其可能为白蛋白。电泳道2~5(分别代表预处理蛋清溶液与10% TCA溶液的体积比为1∶2.5、1∶2、1∶1.5和1∶1)所示的实验结果来看,这些条件下去除非HOVM的杂蛋白的效果基本相同,而通过HPLC检测结果可知(图1B、C),预处理蛋清溶液与10% TCA溶液的体积比例为1∶1时该蛋白的纯度最高,因此可以选取预处理蛋清溶液与10% TCA溶液的体积比1∶1,这个比例也与Lineweaver等[9]的结果一致。
2.2 TCA沉淀时pH值对分离HOVM效果的影响
不同pH值条件下HOVM耐受有机溶液沉淀的性能有一定的差别,中性或偏酸性条件下耐受性较高,而在碱性条件下耐受性差,且Fredericq等[10]发现若TCA质量分数在3%~5%范围内,此时在pH 2.8~4.9时,HOVM溶解度会在12.60~16.15 g/L范围有一定的变化。按照1.3.3节方法,将蛋清预处理液与10% TCA溶液按照体积比1∶1混匀后,以pH值为单因素条件,利用 NaOH(1 mol/L)溶液将混合液pH值调节至2.5、3.0、3.5、4.0、4.5后静置并离心,收集上清液再经透析除去TCA,冻干,各条件下 所得样品都复溶成同样体积的溶液,因此所得SDS-PAGE电泳图,既能体现其纯度,也能体现其浓度,各个样品的SDS-PAGE图谱如图2A所示,HPLC检测图谱如图2C所示。结果表明,pH值为4.5、4.0、3.5条件下(图2A中的电泳道2~4),HOVM存在于上清液中的量基本相同,但pH 4.5和pH 4.0条件下,非HOVM的杂蛋白在上清液中含量较高,由HPLC检测图谱2C5、C4可知,在保留时间分别为10.388min和10.378min时出现杂蛋白,推测这些非HOVM的蛋白,一种可能是分子质量约为45 kD的卵清白蛋白,另一种可能是分子质量为32~36 kD的核黄素结合蛋白;而pH 3.0和pH 2.5条件下(图2A中的电泳道5和6),上清液中的HOVM纯度虽然较好,但是HOVM在上清液中的含量明显降低,并由图2B可知,在pH 3.5条件下该蛋白纯度最高,纯度为96.831%。因此用NaOH溶液将蛋清预处理液与10% TCA的混合液的pH值调为3.5,TCA法沉淀除去非HOVM的杂蛋白的效果较好。可能的原因为卵清白蛋白虽然在卵清中的含量很高,但是卵清白蛋白的等电点(pI 4.5)高于HOVM的等电点(pI 4.0),在pH 3.5条件下,卵清白蛋白带有更多正电荷,更易与TCA所带有负电荷中和而沉淀[11]。本研究与1949年Fredericq等[10]的研究结果也一致。


图2 TCA沉淀除杂蛋白时pH值对分离HOVM效果的影响Fig.2 Effect of pH on the recovery of HOVM and the removal of no n-HOVM proteins
2.3 第一步盐析法去除非HOVM杂蛋白的效果
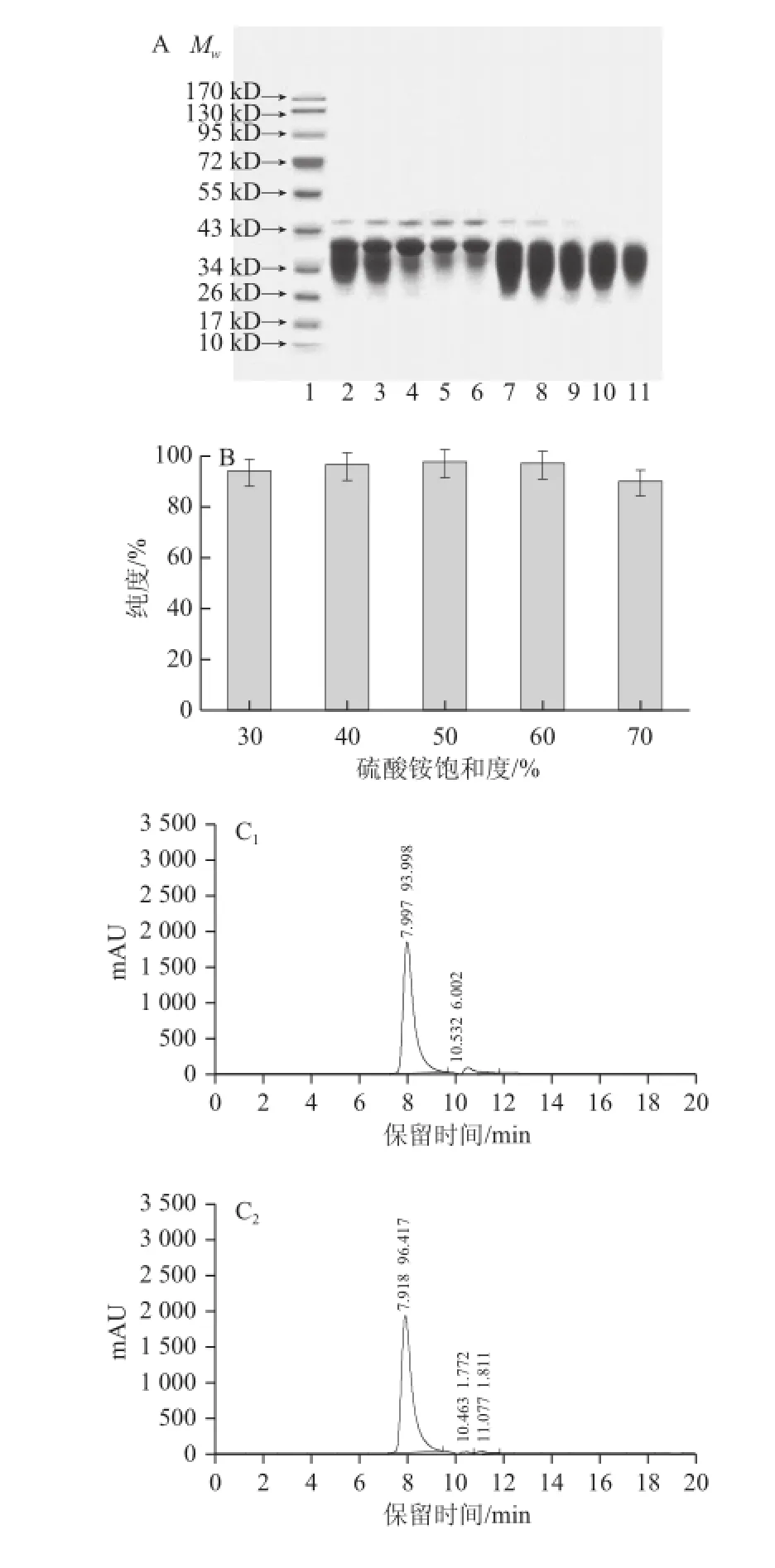
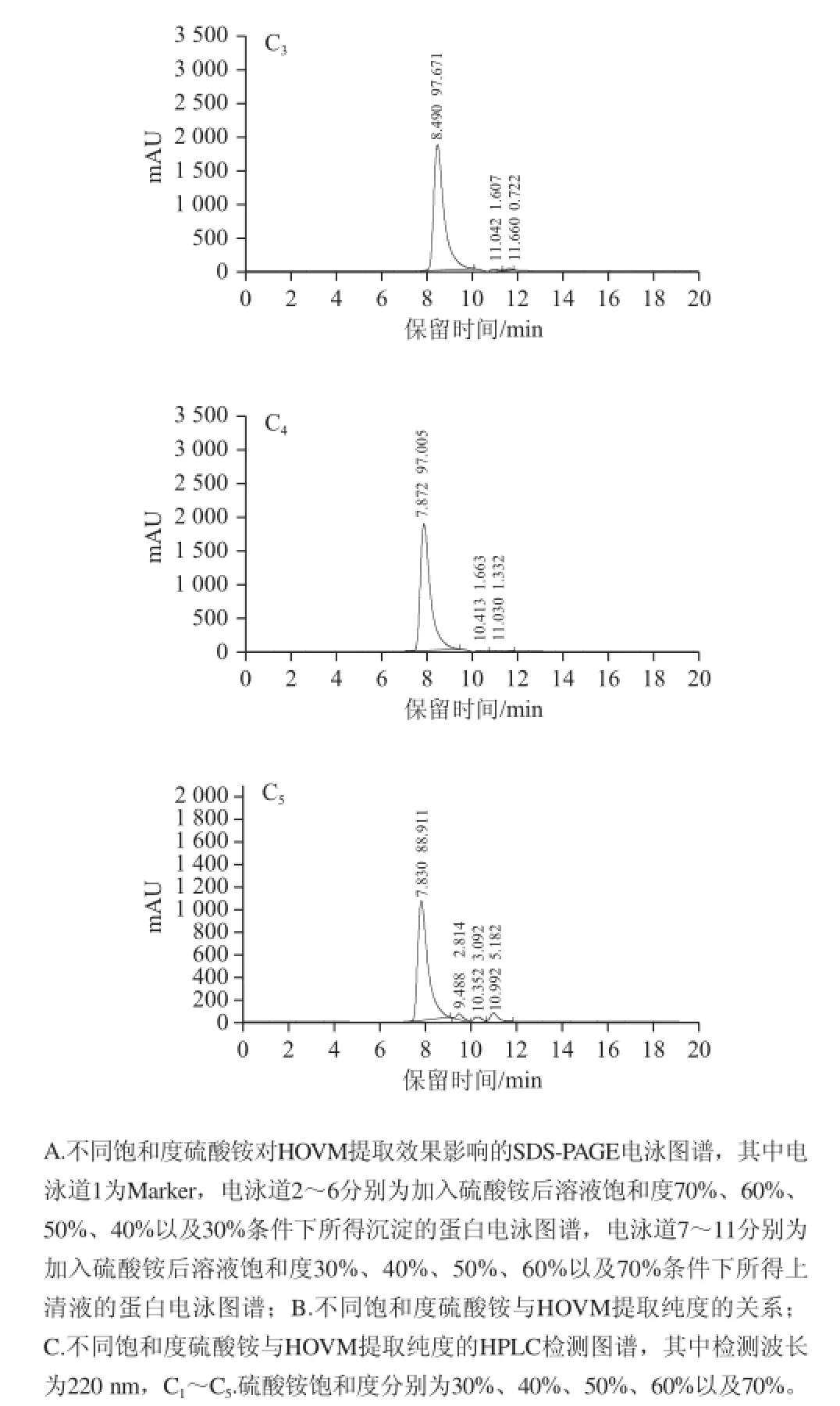
图3 第一步盐析时不同硫酸铵饱和度对分离HOVM效果的影响Fig.3 Effect of ammonium sulfate concentration on the recovery of HOVM at the first step of salting-out
预处理所得蛋清溶液与TCA溶液混合,可以除去大部分的非H OVM的蛋白,但仍有杂蛋白(可能是卵清白蛋白和核黄素结合蛋白)存在,如Lineweaver等[9]在TCA除杂蛋白后,直接用丙酮沉淀法,所得HOVM的纯度仅仅为80%左右;Fredericq等[10]在TCA除杂蛋白后,直接用乙醇析出法,所得HOVM的纯度也仅达到90%;而史晓霞[18]通过TCA和丙酮两步沉淀所得到的HOVM制品再通过离子交换层析才能得到纯度约为95.3%的样品。因此在制备更高纯度的HOVM样品过程中,还利用有一步去除杂蛋白的步骤。SDS-PAGE图谱如图3A所示,硫酸铵饱和度在30%~70%,沉淀中会有非HOVM的杂蛋白出现,由HPLC检测图谱(图3C)可知硫酸铵饱和度为30%~50%时,随着硫酸铵饱和度的增加杂蛋白含量降低,但是硫酸铵饱和度不小于60%时,杂蛋白含量随着硫酸铵饱和度的增加而增高,说明50%的硫酸铵饱和度就能够较为有效地去除非HOVM的杂蛋白;另一个方面盐析所得上清液的以及HPLC检测图谱也验证了沉淀中蛋白分布的检测结果,SDS-PAGE图谱中硫酸铵饱和度为30%~70%时,上清液中的非HOVM杂蛋白较少,其中硫酸铵饱和度不小于50%,上清液中几乎没有非HOVM的杂蛋白,由HPLC检测图谱可知,当硫酸铵饱和度为50%时蛋白纯度为97.671%,该条件下所得蛋白纯度最高。综合上清液与沉淀中蛋白质分布以及纯度检测情况,说明利用一次盐析除去非HOVM杂蛋白是必要,且该步硫酸铵饱和度可确定为50%。
2.4 第二步盐析沉淀纯化HOVM的效果
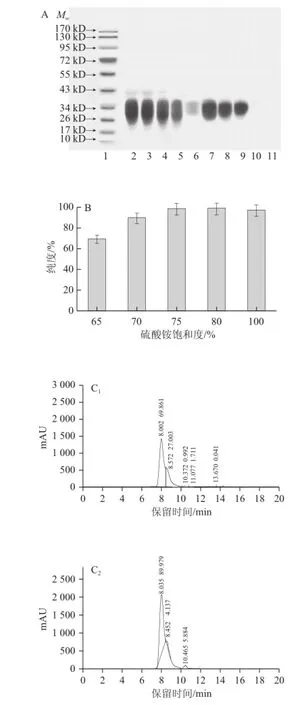

图4 第二步盐析时不同硫酸铵饱和度对分离HOVM效果的影响Fig.4 Effect of ammonium sulfate concentration on the recoverys of HOVM at the second step of salting-out
图4A结果表明,当硫酸铵饱和度在65%~80%范围内,硫酸铵饱和度增加会不断提高HOVM在沉淀中的产量,而此时上清液中HOVM的存在量不断减少,其中硫酸铵饱和度为80%时,上清液中几乎没有蛋白,说明此饱和度条件下HOVM蛋白基本都转入到沉淀中了,进一步提高饱和度至100%时,所得沉淀与上清液的电泳结果与硫酸铵饱和度80%所得结果几乎无差别,由HPLC检测图谱中可知,硫酸铵饱和度为65%~80%时,随着硫酸铵饱和度的增加,蛋白纯度逐渐增高,但当硫酸铵饱和度由80%增至100%时,与硫酸铵饱和度80%时相比较蛋白纯度有所降低,说明第二步盐析若追加硫酸铵至饱和度80%就可充分将HOVM蛋白沉淀出来。

图5 HPLC纯度检测图谱Fig.5 Purity an alysis of recovered HOVM in comparison to standard from Sigma by HPLC
为了进一步检验所得样品的纯度以及样品是否为HOVM,按照1.3.6节方法,利用HPLC技术进行检测,并与HOVM标品进行对比,所得HPLC检测结果如图5所示。HOVM标品的保留时间约为7.792 min,而本研究所得HOVM样品的保留时间为7.662 min,两者的出峰时间与结束时间基本一致,可以判断提取的蛋白为HOVM;另外纯度检测结果表明,本研究所得HOVM样品的纯度为99.202%,略高于标品的纯度(99.016%)。并且100 mL蛋清液中可以提取约0.300 g的HOVM,若按照根据文献[26]参考值(HOVM占蛋清蛋白的11%),本提取工艺所得HOVM的提取率约为27.05%。
3 结 论
本研究得出了一种通过三步沉淀法从蛋清中纯化得到HOVM纯品的工艺路线,具体过程如下:蛋清液预处理按照体积比为1∶1加入10% TCA溶液(pH 1.15),混匀后用NaOH溶液(1.0 mol/L)调节pH值至3.5后经两步盐析(第1步盐析硫酸铵饱和度为50%,第2步盐析硫酸铵饱和度为80%)后得到HOVM样品。
通过该工艺所得到的HOVM样品的纯度为99.202%,提取率为27.05%。三步沉淀法操作简单且处理量大,所得HOVM蛋白的纯度很高。而如何提高其提取率还有待进一步研究。
[1] COOKE S K, SAMPSON H A. Allergenic properties of ovomucoid in man[J]. The Journal of Immunology, 1997, 159(4): 2026-2032.
[2] KATO I, SCHRODE J, KOHR W J, et al. Chicken ovomucoid: determination of its amino acid sequence, determination of the trypsin reactive site, and preparation of all three of its domains[J]. Biochemistry, 1987, 26(1): 193-201.
[3] BEELEY J G. The isolation of ovomucoid variants differing in carbohydrate composition[J]. Biochemical Journal, 1971, 123: 399-405.
[4] KATO I, KOHR W J, LASKOWSKI M Jr.,. Evolution of avian ovomucoids[J]. Proc FEBS Meet, 1978, 47: 197-206.
[5] MILLER H, CAMPBELL D H. Skin test reactions to various chemical fractions of egg white and their possible clinical significance[J]. Journal of Allergy, 1950, 21(6): 522-524.
[6] BARKHOLT V, BESLER M, SAMPSON H A. Hens egg white (Gallus domesticus)[C]//Internet Symposium on Food Allergens. Hamburg, 2000: 1-29.
[7] PATRIARCA G, SCHIAVINO D, NUCERA E, et al. Food allergy in children: results of a standardized protocol for oral desensitization[J]. Hepato Gastroenterology-Current Medical and Surgical Trends, 1998, 45(19): 52-58.
[8] 佟平, 高金燕, 陈红兵. 鸡蛋清中主要过敏原的研究进展[J]. 食品科学, 2007, 28(8): 565-568.
[9] LINEWEAVER H, MURRAY C W. Identification of the trypsin inhibitor of egg white with ovomucoid[J]. Journal of Biological Chemistry, 1947, 171(2): 565-581.
[10] FREDERICQ E, DEUTSCH H F. Studies on ovomucoid[J]. Journal of Biological Chemistry, 1949, 181(2): 499-510.
[11] TANKRATHOK A, DADUANG S, PATRAMANON R, et al. Purification process for the preparation and characterizations of hen egg white ovalbumin, lysozyme, ovotransferrin, and ovomucoid[J]. Preparative Biochemistry and Biotechnology, 2009, 39(4): 380-399.
[12] 麻小娟, 陈红兵, 高金燕. 鸡蛋清中卵白蛋白和卵类粘蛋白的高效分离[C]//中国食品科学技术学会第六届年会暨第五届东西方食品业高层论坛论文摘要集, 2009: 111.
[13] de OLIVEIRA F C, dos REIS COIMBRA J S, da SILVA L H M, et al. Ovomucoid partitioning in aqueous two-phase systems[J]. Biochemical Engineering Journal, 2009, 47(1): 55-60.
[14] 许沙沙, 李斌, 宋儒坤, 等. 鸡蛋卵类黏蛋白研究进展[J]. 中国家禽, 2011, 33(16): 35-37.
[15] MELAMED M D. Electrophoretic properties of ovomucoid[J]. Biochemistry, 1967, 103: 805-810.
[16] YOUSIF A N, KAN J W. Visualization of chicken ovomucoid in polyacrylamide gels[J]. Analytical Biochemistry, 2002, 311(1): 93-97. [17] ABEYRATHNE E, LEE H Y, AHN D U. Separation of ovotransferrin and ovomucoid from chicken egg white[J]. Poultry Science, 2014, 93(4): 1010-1017.
[18] 史晓霞. 蛋清卵类粘蛋白分离纯化、结构表征及其过敏原性的研究[D]. 武汉: 华中农业大学, 2012: 18-24.
[19] GUÉRIN-DUBIARD C, PASCO M, HIETANEN A, et al. Hen egg white fractionation by ion-exchange chromatography[J]. Journal of Chromatography A, 2005, 1090(1): 58-67.
[20] 张晴晴, 侯惠静, 刘爱国, 等. 醇析法结合离子交换法提取分离卵转铁蛋白[J]. 食品研究与开发, 2013, 33(11): 90-92.
[21] 辛普森 L J. 蛋白质与蛋白质组学实验指南[M]. 北京: 化学工业出版社, 2006: 35-79.
[22] GALLAGHER E P, GARDNER J L, BARBER D S. Several glutathione-transferase isozymes that protect against oxidative injury are expressed in human liver mitochondria[J]. Biochemical Pharmacology, 2006, 71(11): 1619-1628.
[23] KOVACS-NOLAN J, PHILLIPS M, MINE Y. Advances in the value of eggs and egg components for human health[J]. Journal of Agricultural and Food Chemistry, 2005, 53(22): 8421-8431.
[24] ALLEONI A C C. Albumen protein and functional properties of gelation and foaming[J]. Scientia Agricola, 2006, 63(3): 291-298.
[25] KOVACS-NOLAN J, ZHANG Jiewei, HAYAKAWA S, et al. Immunochemical and structural analysis of pepsin-digested egg white ovomucoid[J]. Journal of Agricultural and Food Chemistry, 2000, 48(12): 6261-6266.
[26] 李灿鹏, 吴子健. 蛋品科学与技术[M]. 北京: 中国标准出版社, 2013: 1-2.
Purification of Hen’s Egg Ovomucoid by Three-Step Precipitation
WANG Shuai1, WU Zi-jian1,*, WANG Su-ying1, LIU Jian-fu1, ZHANG Wei1, TIE Hang1, RONG Qiang2
(1. Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China; 2. Cuisine Department, Tianjin Youth Professional Technology Institute, Tianjin 300191, China)
Hen’s egg ovomucoid (HOVM) is the dominant allergenic protein from chicken egg white, and obtaining highpurity HOVM is the prerequisite for understanding its structure and characteristics and reducing its allergenicity. This study presented a three-step precipitation procedure (precipitation with 10% trichloroacetic acid (TCA) followed by two-step fractional precipitation with ammonium sulfate) for purifying HOVM. The purification efficiency was evaluated by SDSPAGE and HPLC. It was found that after most of the protein impurities in the 2-fold diluted egg white were removed by adding 10% TCA, the centrifugal supernatant was added with ammonium sulfate to saturation (50%) for further removal of non-HOVM proteins by salting-out. Finally, additional ammonium sulfate was added to the supernatant fraction until saturation (80%). After centrifugation, the precipitation fraction was dialyzed and freeze-dried to obtain high-purity HOVM product. HPLC analysis (at 220 nm) showed that the purity of the HOVM was 99.202%, with a yiel d of 27.05%.
hen’s egg ovomucoid; three-step precipitation; salting-out
R392.1
A
1002-6630(2014)24-0074-07
10.7506/spkx1002-6630-201424014
2014-06-30
天津市应用基础与前沿技术研究计划面上项目(14JCYBJC30900);天津市高等学校创新团队项目(TD12-5049)
王帅(1990—),女,硕士研究生,研究方向为食品生物技术。E-mail:wswangshuaiws@126.com
*通信作者:吴子健(1973—),男,副教授,硕士,研究方向为食品生物技术。E-mail:wzjian@tjcu.edu.cn
