胃癌中p-Stat3活化和SOCS3表达的临床病理意义及其对预后的影响*
2014-03-08陈海云李秀明张文杰
陈海云,张 楠,从 丽,陶 林,赵 瑾,李秀明,张 微,张文杰
(石河子大学医学院病理学系/地方与民族高发病教育部重点实验室,新疆石河子832002)
胃癌是全球范围内威胁人类健康的最常见恶性肿瘤之一。受环境、遗传、感染等多种因素影响,胃癌发病机制十分复杂。近年随着分子生物学研究的不断深入,发现乳腺癌、宫颈癌、前列腺癌等多种恶性肿瘤细胞中,存在Jak-Stat3信号传导通路的原发性异常活化,而这种异常活化可能在恶性肿瘤的增殖、浸润和转移中发挥重要作用。信号传导与转录激活因子3(signal transducer and activator of transcription 3,Stat3)是一种重要的核转录因子,它的活化是Jak-Stat3信号传导通路激活的“开关”[1]。细胞因子信号转导抑制蛋白3(suppressor of cytokine signaling 3,SOCS3)是细胞因子信号传导负调控蛋白家族的成员之一,是Jak-Stat3信号传导通路的重要抑制因子。目前研究发现,SOCS3表达缺失或减少可能是导致恶性肿瘤发生的重要原因之一[2]。然而,Stat3和SOCS3在胃癌的发生、发展和预后中的作用尚不明确,迄今报道甚少。本研究通过检测胃癌及癌旁组织中活化的Stat3(p-Stat3)及SOCS3的表达水平,结合患者的临床病理及随访资料,探讨Stat3信号通路及其调节因子SOCS3在胃癌的发生、发展中的作用以及对患者预后的影响,现报道如下。
1 材料与方法
1.1 材料 选自石河子大学附属第一医院2003年1月至2007年12月手术切除的标本胃癌组织53例(胃癌组),全部病例术前均未行放、化疗,资料完整,胃癌组织分期参照AJCC(2010)的TNM分期标准[3],其中男36例,女17例,年龄29~79岁,平均62岁;有淋巴结转移31例,无淋巴结转移者22例,发生远处转移2例。根据WHO(2000年)病理组织学分类:高分化管状腺癌5例,中分化管状腺癌16例,低分化管状腺癌24例,黏液腺癌4例,印戒细胞癌4例。选取其中27例胃癌患者的癌旁组织(切缘距离癌组织5cm以外的非癌组织)作为对照组。对所有资料进行随访,生存时间为自手术当日至患者死亡或截止到随访日期,随访日期截止到2012年12月31日。
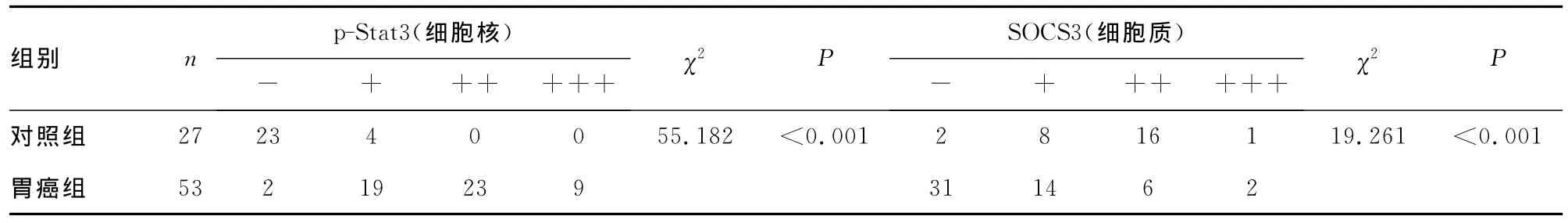
表1 p-Stat3及SOCS3的表达水平(n)
1.2 方法
1.2.1 实验方法 所有组织标本均置于10%中性福尔马林固定,然后石蜡包埋,以4μm厚度连续切片。免疫组织化学染色法采用Envision两步法。特异性抗体:第一抗体分别为兔抗人p-Stat3(Tyr 705)单克隆抗体(美国 Abcam公司,ab76315,稀释度1∶200)和兔抗人SOCS3单克隆抗体(美国Abcam公司,ab119313,稀释度1∶150)。其余试剂均购自北京中杉金桥生物有限公司。分别用已知p-Stat3染色阳性的乳腺癌组织及已知SOCS3染色阳性的肾癌组织作为阳性对照;PBS液为阴性对照。
1.2.2 结果判定 由2名高年资病理医师采用双盲法,参照1996年全国免疫组织化学技术与诊断标准化专题研讨会意见独立阅片。定义p-Stat3为组织切片中的细胞核呈浅黄色至棕褐色颗粒为阳性观察对象,SOCS3为组织切片中的细胞质呈浅黄色至棕褐色颗粒为阳性观察对象。400倍光学显微镜下随机选取10个不同视野,每个视野分别计数100个同类细胞。染色得分由阳性染色细胞占细胞总数的百分比与染色强度计分的乘积判断。按阳性细胞数计分:<5%为0分;6%~25%为1分;26%~50%为2分;51%~75%为3分;76%~100%为4分。按染色强度计分:无着色为0分;浅棕黄色为1分;棕黄色为2分;棕褐色为3分。两项结果相乘:0~1分为(-),2~4分为(+),5~8分为(++),9~12分为(+++);(-)为阴性,(+)为弱阳性,(++~+++)为强阳性[4]。
1.3 统计学处理 采用SPSS 17.0统计软件进行分析。两个免疫组织化学指标在癌与非癌差异间的比较采用χ2检验;两个免疫组织化学指标在临床生物学行为差异之间的比较采用χ2检验和Fisher确切概率法;两指标之间的相关性采用Spearman等级相关分析;采用Kaplan-Meier法对生存曲线和生存期进行描述,以P<0.05为差异有统计学意义。
2 结 果
2.1 p-Stat3及SOCS3的表达水平 两种免疫组织化学指标在细胞质、细胞核中均有阳性表达。正常胃组织中p-Stat3的阳性信号主要位于细胞质,胃癌中p-Stat3的阳性信号主要位于细胞核,肿瘤组织中p-Stat3的染色较深;SOCS3的阳性信号主要定位于上皮细胞的细胞质,胃癌中SOCS3的表达范围较小,但染色较深(图1、2)。胃癌组织的细胞核中p-Stat3的阳性率为60.4%,癌旁组织细胞核中p-Stat3的阳性率为14.8%,胃癌组织细胞核中p-Stat3水平明显高于相应癌旁组织;胃癌组织细胞质中SOCS3的阳性率为41.5%,癌旁组织细胞质中SOCS3的阳性率为92.6%,胃癌组织细胞质中SOCS3的表达明显低于癌旁组织,差异有统计学意义(P<0.05),见表1。
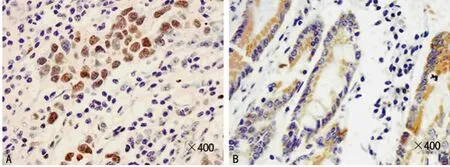
图1 胃癌及癌旁组织中p-Stat3的表达(Envision法,×400)
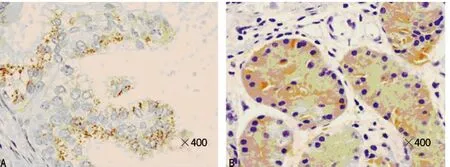
图2 胃癌及癌旁组织中SOCS3的表达(Envision法,×400)
2.2 胃癌组织中p-Stat3及SOCS3的表达水平与临床病理特征的关系 胃癌组织细胞核中p-Stat3呈强活化水平,强阳性率为60.4%。p-Stat3水平与患者年龄、性别中无明显相关性,差异无统计学意义(P>0.05);浸润深度T1+T2(即肿瘤未侵达浆膜层)中p-Stat3的强阳性率低于浸润深度T3(即肿瘤侵及浆膜层)中,二者差异有统计学意义(P<0.05);有淋巴结转移组p-Stat3的强阳性率明显高于无淋巴结转移组,差异无统计学意义(P>0.05);组织学分型中高分化组p-Stat3的强阳性率明显低于中+低分化组,差异有统计学意义(P<0.05)。p-Stat3的活化水平与肿瘤的TNM分期呈正相关(P<0.05)。SOCS3在胃癌组织表达水平较低,阳性率为41.5%。SOCS3的表达与肿瘤患者的年龄、性别无相关性(P>0.05);T1+T2中SOCS3的阳性率明显高于T3,二者差异有统计学意义(P<0.05);有淋巴结转移组SOCS3阳性率低于无淋巴结转移组,差异有统计学意义(P<0.05);临床分期Ⅰ+Ⅱ期SOCS3的阳性率高于Ⅲ+Ⅳ期,差异有统计学意义(P<0.05);SOCS3的表达与远处转移及组织学分化差异无相关性(P>0.05),见表2。
2.3 胃癌中p-Stat3活化与SOCS3表达的相关性 Spearman等级相关分析,结果显示两指标显著负相关(r=-0.492,P<0.05)。
2.4 生存分析 53例胃癌患者中,34例存活,19例死亡,中位生存时间为80.00个月(约6.7年);细胞核中p-Stat3(-~+)的患者,中位生存时间为72.00个月,细胞核中p-Stat3(++~+++)的患者,中位生存时间为33.04个月;细胞质中SOCS3(-)表达的患者中,中位生存时间只有28.38个月,细胞质中SOCS3(+~+++)表达的患者中,中位生存时间为84.00个月;Kaplan-Meier生存分析结果显示:细胞核中p-Stat3的活化水平与胃癌患者的生存时间呈显著负相关(χ2=-5.05,P<0.05);细胞质中SOCS3的表达与胃癌患者的生存时间呈显著正相关(χ2=10.852,P<0.05),见图3、4。
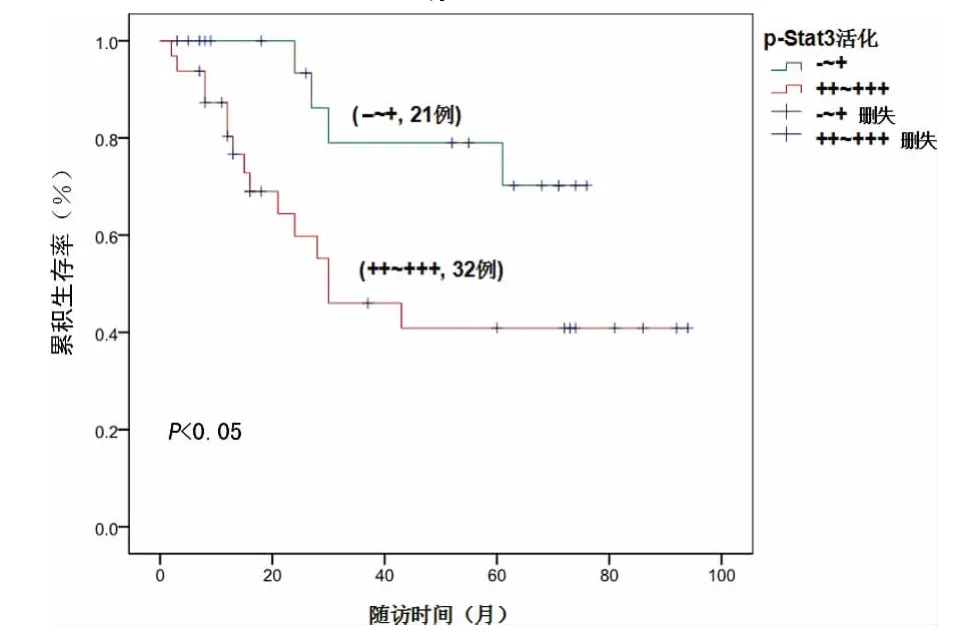
图3 p-Stat3水平与生存时间呈负相关
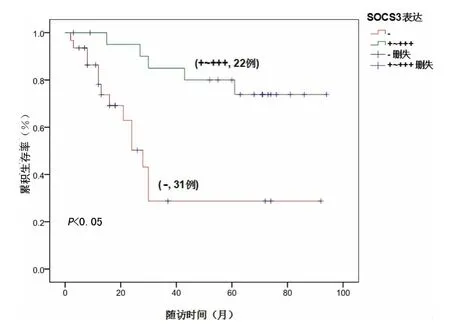
图4 SOCS3表达与生存时间呈正相关
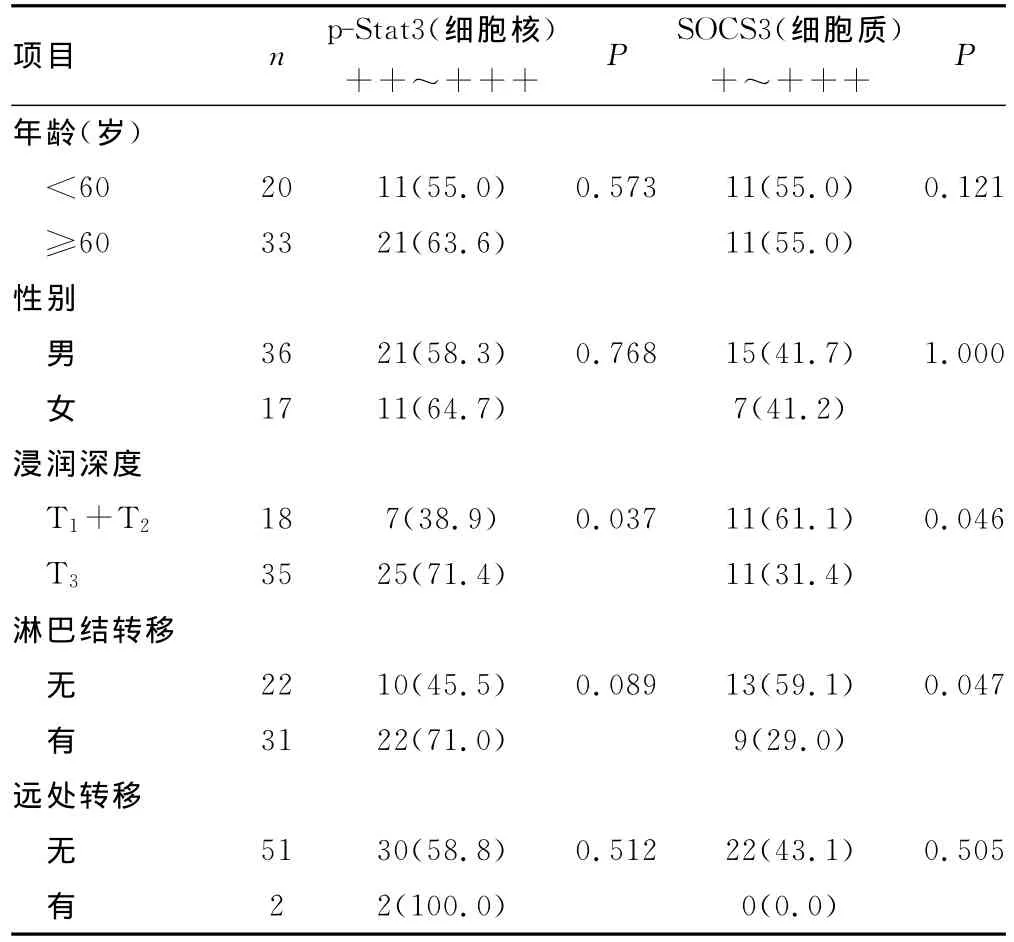
表2 p-Stat3、SOCS3与胃癌患者临床病理特征的关系[n(%)]
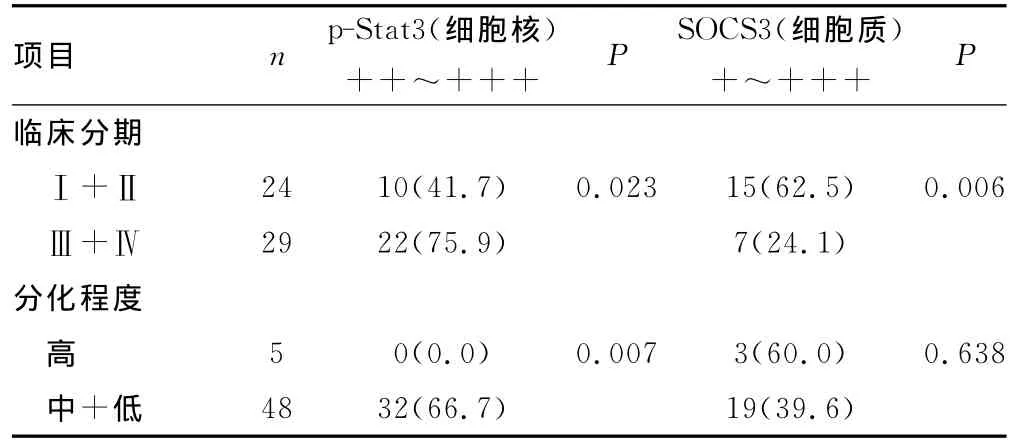
续表2 p-Stat3、SOCS3与胃癌患者临床病理特征的关系[n(%)]
3 讨 论
研究发现原发性异常活化的p-Stat3与多种恶性肿瘤密切相关。外界刺激因子如IL-6,作用于细胞膜上相应的细胞因子受体(gp130)后,激活细胞质内的Jak酪氨酸激酶,使Stat3蛋白活化为p-Stat3。p-Stat3有进入细胞核的能力,可以激活下游一系列的原癌基因,加重肿瘤的恶性行为[1]。SOCS3也是p-Stat3的下游分子,通过细胞核内的p-Stat3激活。正常情况下,存在于细胞核的SOCS3激活后转移到细胞质,负反馈调节上游Jak-Stat3信号转导通路,抑制Jak-Stat3的异常激活[2]。因此,细胞核中的p-Stat3有促进细胞恶化的潜能;细胞质中的SOCS3有抑制Stat3信号通路激活的能力。所以,本免疫组织化学定义:p-Stat3为组织切片中的细胞核呈浅黄色至棕褐色颗粒为阳性观察对象,SOCS3为组织切片中的细胞质呈浅黄色至棕褐色颗粒为阳性观察对象。
本研究结果发现,胃癌中p-Stat3的阳性信号主要位于细胞核,呈强活化状态。癌旁组织细胞核中p-Stat3的活化水平明显低于胃癌组织,可见Stat3过度活化可以增强胃癌细胞瘤性转化的能力,对胃癌的启动起到的明显促进作用。这一点在Tye的裸鼠实验中也得到证实[5]。活化的Stat3可以启动下游基因的表达,包括Cyclin D1、BCL-XL、VEGF以及Pim3等,进一步影响肿瘤细胞的增殖、浸润、转移能力。本结果显示,胃癌中p-Stat3的活化水平与肿瘤的浸润深度、临床分期显著相关。胃癌发展的早期p-Stat3的活化水平明显低于晚期胃癌。然而笔者发现,无淋巴结转移组p-Stat3的强阳性率虽然高于无淋巴结转移组,但差异无统计学意义(P>0.05)。Deng等[6]的研究发现,胃癌中Stat3的活化水平与淋巴结转移有关,与本研究结果不一致。分析可能由于样本量的差异,后期将扩大样本量,进行相关探讨。本研究结果显示,SOCS3的阳性信号主要定位于上皮细胞的细胞质,与癌旁组织相比,胃癌组织细胞质中SOCS3表达水平较低。研究表明,SOCS3的DNA启动子区甲基化是SOCS3表达缺失的重要原因[7]。贾芙蓉等[8]用RT-PCR检测胃癌组织及胃癌细胞中SOCS3的mRNA表达情况,同样显示胃癌中SOCS3的表达显著低于胃正常组织。所以,SOCS3表达的减少可能参与了胃癌的启动。本研究结果显示,SOCS3的表达缺失与肿瘤的浸润深度、淋巴结转移、临床分期呈负相关关系,随着SOCS3表达的缺失,胃癌细胞的生物学行为也在逐渐恶化。推测可能由于SOCS3的表达减弱,影响了促癌基因的表达。有结果发现SOCS3表达缺失可以促进VEGF的表达[9]。关于SOCS3与胃癌的发展关系,目前研究较少,有必要进行更加深入地探讨。
机制研究表明,SOCS3可以通过负反馈作用于Jak-Stat3信号转导通路来抑制Stat3活化,体外实验发现沉默SOCS3可以减弱这种负反馈作用,增强Stat3的活化能力。本研究探讨了胃癌中p-Stat3活化和SOCS3表达的相关性,结果证实Stat3活化和SOCS3表达存在明显的负相关关系,与目前的结论一致。也就是说,Stat3活化水平异常增高及SOCS3表达缺失可能协同参与了胃癌的发展。但由于免疫组织化学方法的限制,引起p-Stat3活化与SOCS3缺失的具体机制尚不明确,有待进一步研究。
Kaplan-Meier生存分析结果显示,细胞核中Stat3的活化水平越高的胃癌患者,其生存时间越短(χ2=-5.05,P<0.05)。Xiong等[10]的研究结果也表明Stat3的高活化状态可能与胃癌患者的预后差相关。本研究首次提出胃癌患者的生存时间与细胞质中SOCS3的表达缺失有关(χ2=10.852,P<0.05),随着SOCS3表达下降,胃癌患者的生存时间逐渐缩短。这些结果提示,SOCS3的表达,特别是高表达,可能是影响胃癌患者预后的保护性因素;而p-Stat3水平增高则是胃癌预后的不利因素,二者相互作用,影响胃癌的发生、发展[11]。
p-Stat3水平异常增高及SOCS3表达缺失可能协同参与胃癌的发展及转移进程,提示p-Stat3和SOCS3信号传导通路分子在癌变及癌进展中具有重要作用,为胃癌的靶向性治疗提供新靶标。同时,他们对胃癌患者存活的影响表明,p-Stat3和SOCS3也可能作为胃癌患者预后的参考指标。
[1] Kamran MZ,Patil P,Gude RP.Role of STAT3in cancer metastasis and translational advances[J].Biomed Res Int,2013,2013:421821.
[2] Inagaki-Ohara K,Kondo T,Ito M,et al.SOCS,inflammation,and cancer[J].JAKSTAT,2013,2(3):e24053.
[3] 汤钊猷.现代肿瘤学[M].3版.上海:复旦大学出版社,2011:847-848.
[4] 许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[5] Tye H,Kennedy CL,Najdovska M,et al.STAT3-driven upregulation of TLR2promotes gastric tumorigenesis independent of tumor inflammation[J].Cancer Cell,2012,22(4):466-478.
[6] Deng J,Liang H,Zhang R,et al.STAT3is associated with lymph node metastasis in gastric cancer[J].Tumour Biol,2013,34(5):2791-2800.
[7] Molavi O,Wang P,Zak Z J,et al.Gene methylation and silencing of SOCS3in mantle cell lymphoma[J].Br J Haemato,2013,161(3):348-356.
[8] 贾芙蓉,周劲松,张哲雄,等.SOCS-3mRNA在胃癌组织及胃癌细胞系中的表达[J].中国实验诊断学,2006,5(10):446-448.
[9] Yokogami K,Yamashita S,Takeshima H.Hypoxia-induced decreases in SOCS3increase STAT3activation and upregulate VEGF gene expression[J].Brain Tumor Pathol,2013,30(3):135-143.
[10] Xiong H,Du W,Wang J L,et al.Constitutive activation of STAT3is predictive of poor prognosis in human gastric cancer[J].J Mol Med (Berl),2012,90(9):1037-1046.
[11] 沈凯,申占龙,王成钢,等.果蝇zeste基因增强子2和信号转导与转录激活子3在人胃癌组织中的表达[J].中华消化外科杂志,2013,12(11):873-878.
