奥扎格雷合成路线图解
2014-03-08张立娟宋铁兵张晓友
张立娟,宋铁兵,杨 姣,张晓友
(1.佳木斯大学药学院,黑龙江佳木斯154002;2.大庆市大庆油田总医院临床药学科,黑龙江大庆163001)
·工业药学·
奥扎格雷合成路线图解
张立娟1,宋铁兵2,杨 姣2,张晓友2
(1.佳木斯大学药学院,黑龙江佳木斯154002;2.大庆市大庆油田总医院临床药学科,黑龙江大庆163001)
奥扎格雷是抗血小板聚集的一类药物,在临床上应用广泛,为了找到低毒性、高收率的方法来合成奥扎格雷以及其盐类,本文对奥扎格雷的合成路线进行了综述,以便为奥扎格雷的合成提供借鉴。
奥扎格雷;合成;综述
奥扎格雷(1),化学名为(E)-3-[4-(1H-咪唑-1-甲基)苯基]-2-苯丙烯酸,商品名为Cataclot,是第一个上市的血栓素合成酶A2(TXA2)抑制剂[1,2]。原研公司为日本小野药品工业株式会社,上市的盐类有奥扎格雷钠(2)和盐酸奥扎格雷两种,前者治疗急性血栓性脑梗死和脑梗死所伴随的运动障碍;后者具有抗血小板聚集和扩血管作用,可用于蛛网膜下腔出血手术后血管痉挛及其并发脑缺血症状的改善,对于治疗支气管哮喘和心绞痛疗效较好。现对奥扎格雷及其中间体对甲溴基肉桂酸甲酯(3)的合成综述如下。
1 奥扎格雷的制备
1.1 以对溴甲基肉桂酸甲酯为原料 以对溴甲基肉桂酸甲酯(3)和咪唑为原料,DMF为溶剂在NaH催化下缩合得(E)-对(1H-咪唑-1-甲基)肉桂酸甲酯(4),收率为79%。最后在碱性条件下得到奥扎格雷钠(2)[3]。总收率为85%;或者3和咪唑在KOH做缚酸剂条件下得4,再将4调节pH=5得到奥扎格雷(1)。总收率为81.2%[4]。前者用到的NaH价格较金属钠高,从降低成本的角度考虑后者可以作为合成奥扎格雷较为理想的方法,收率也较高。
也可以3为原料,在氮气保护下与N-乙酰基咪唑(5)反应得到咪唑溴盐(6),再经碳酸钠水解得到4,总收率为96%。在这条路线中,此法不适于工业化生产,因为1-取代咪唑价格高且不易保存,反应中用到乙腈毒性大[5]。
以3为原料在氮气保护下与羰基二咪唑(CDI)(7)反应得到咪唑溴鎓盐(8),经过碱性条件下水解、酸化得盐酸奥扎格雷,总收率为81.5%。但是CDI的成本高,只适于实验室合成[6]。合成路线见图1。
1.2 以4-羧甲基苯甲醛为原料 以4-羧甲基苯甲醛(9)为原料,与新戊二醇在甲基磺酸的作用下进行生成环状缩醛(10)保护醛基的亲核加成反应,经硼氢化钠还原得到11,经甲磺酰氯卤代得到12,与咪唑在三乙胺作用下发生N-烃化反应得到13,在硫酸作用下脱去新戊二醇得到4-(1H-咪唑-1-亚甲基)苯甲醛(14),与丙二酸在吡啶或吡啶-哌啶作用下发生克脑文格尔反应得到奥扎格雷(1),再经氢氧化钠水解、盐酸成盐得到奥扎格雷盐酸盐[7]。此条路线较为繁琐,原料种类多,相对来说成本高,不适于工业化生产。合成路线见图1。
1.3 以对甲基苯甲醛为原料 对甲基苯甲醛(15)和溴单质或NBS在CCl4中回流得对溴甲基苯甲醛(16),然后以CHCl3作为溶剂,在碳酸钾作用下与咪唑反应得到14,以甲苯作为溶剂,吡啶作为催化剂的条件下与丙二酸反应,与稀盐酸作用得到奥扎格雷盐酸盐[8],总收率为87%。此方法中甲苯有毒性,但是总体上可以作为合成奥扎格雷一种可用的方法。
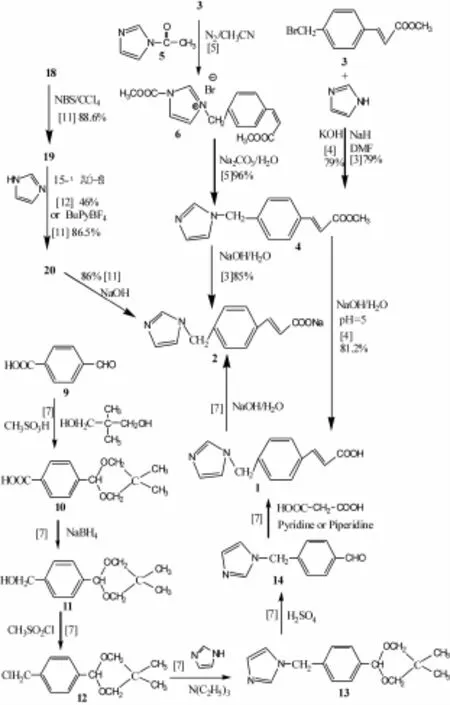
图1 奥扎格雷钠盐合成路线图
或者15与丙二酸作用生成对甲基肉桂酸(17),接着与对甲苯磺酸无水乙醇作用得E-对甲基肉桂酸乙酯(18),再与NBS进行溴代得到对溴甲基肉桂酸乙酯(19),与咪唑在NaH的催化下得(E)-对(1H-咪唑-1-甲基)肉桂酸乙酯(20),最后再水解得盐酸奥扎格雷[9],总收率为63%。
15还可以与1,3-二溴-5,5-二甲基海因(DBDMH)在偶氮二异丁腈(AIBN)的引发下进行溴代生成16,进而在CsCl做促进剂的条件下与咪唑进行N-烷基化反应产生14,最后在甜菜碱盐酸盐-尿素低共熔溶剂的作用下与醋酐产生1[10]。合成路线见图2。
1.4 对甲基肉桂酸乙酯为原料 以对甲基肉桂酸乙酯(18)为原料与NBS在过氧化苯甲酰引发下合成19,然后在离子液体BuPyBF4中与咪唑、无水碳酸钠反应得到20,在氢氧化钠作用下得奥扎格雷钠(2)[11],总收率为86%;或在离子液体15-冠醚-5中与咪唑反应生成20[12],总收率为86%。但离子液体价格高,仅具有实验室制备的意义。合成路线见图2。
2 中间体对甲基肉桂酸甲酯的合成
A法:以对甲基苯甲醛(15)和溴乙酸甲酯(21)作为起始原料,在正丁基磷(或砷)、四三苯基膦钯或催化量的锌粉作用下得到E-3-(4-甲基苯基)-2-丙烯酸(22)。三种催化剂的收率均在88%左右。此反应简化了Witting反应,一步得到烯烃且不需要加碱处理,但产物要经过柱层析方法纯化[13~16]。22在硫酸的作用下和甲醇通过甲酯化反应得到E-3-(4-甲基苯基)-2-丙烯酸甲酯(23),23与溴化剂N-溴代丁二酰亚胺(NBS)在自由基引发剂过氧化苯甲酰的作用下得到对溴甲基肉桂酸甲酯3[9,17]。总收率为50%。
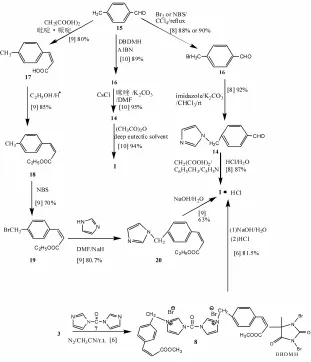
图2 奥扎格雷盐酸盐(1·HCl)合成路线图
B法:以15和丙二酸(24)在吡啶或吡啶-哌啶催化下经克脑文格尔缩合反应得到22。此反应速度快收率好纯度高[18,19]。两篇文献的收率分别为61%和68%。
C法:15与甲氧基羰甲基亚磷酸二乙酯(25)在超声下,氢氧化钡催化经过Wittig-Horner反应得到22,此反应可以在室温下进行,但是需要电子转移催化剂(ETC)激活反应[20],收率为61%。
D法:1-氯(或溴)甲基-4-甲苯(26)与2-苯基亚硫酰基乙酸甲酯(27)在相转移催化剂(三乙基苄基氯化铵)、碘化钾或碳酸钾作用下经过烷基消除反应得到22,收率为97%。此反应产率高,但是需要柱层析方法纯化[21]。
E法:在钯复合物催化下,丙烯酸乙酯(28)与N-对苯甲基-N-N-对甲苯磺酰基偶氮氧化物(29)经芳基取代反应得到22,反应中钯复合物的立体选择性较好,收率为89%。但苯作为溶剂毒性大,钯复合物价格也较昂贵[22]。不适于工业生产。
F法:15可以在钠和乙醇存在下与乙酸甲酯通过克莱森缩合生成23,23在紫外光照的条件下与NBS反应得到3,此步收率为78.1%[4]。此方法是较为理想的合成方法。合成路线见图3。
3 总结
在以上几条合成路线中,从降低毒性提高产率方面考虑,以对溴甲基肉桂酸甲酯和以对甲基苯甲醛为原料进行反应是合成奥扎格雷的首选路线,但是从对于原料易得以及降低成本的角度考虑,氢化钠价格较高,综合考虑文献[4]以对甲基苯甲醛和NBS作用最终得到奥扎格雷盐酸盐是较为理想的途径,适合工业生产。
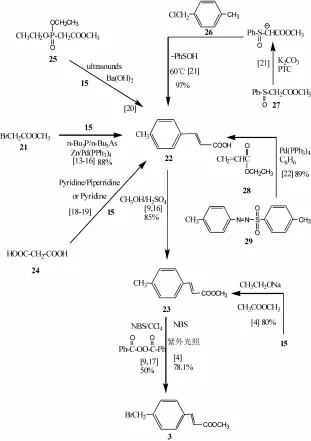
图3 中间体对甲基肉桂酸甲酯的合成路线图
[1]杨萍,周雪艳,李岚,等.奥扎格雷改善急性冠脉综合症患者血小板和内皮功能的作用[J].中国临床药理学杂志,2004,20(4):303-304.
[2]Wu H,Yu W,Huang L,et al.Effect of sodium ozagrel on the activity of rat CYP2D6[J].Eur JPharmacol,2007,573(1-3):55-59.
[3]陈芬儿.有机药物合成法(第一卷)[M].北京:中国医药科技出版社,1999:102-107.
[4]薛叙明,吕春绪.奥扎格雷合成工艺[J].化工进展,2009,28(11):2024-2027.
[5]Kamijo T,Yamamoto R,Harada H,etal,An Improved and Convenient Procedure for the Synthesis of l-Substituted Imidazoles[J].CPB,1983,31(4):1213.
[6]Guo C,Liu XD,Xie ZG,et al.An Improved and Convenient Procedure for the Synthesis of Ozagrel[J].Chinese Chemical Letters,2006,17(2):180-182.
[7]刘晓丹.TXA2合成酶抑制剂奥扎格雷的合成工艺研究[D].沈阳:沈阳药科大学,2005.
[8]Yu CL,Zhao BH,Zhao YH,et a.A new route for the synthesis of ozagrel hydrochloride[J].Org Prep Proced Int, 2010,42(2):183-185.
[9]周自金,罗荣,刘晓峰,等.血栓素合成酶抑制剂-奥扎格雷的合成研究[J].南昌大学学报(理科版),1998,22(3):228-290.
[10]李玉文,马翠丽.一种奥扎格雷的化学合成方法[P].CN 103613546 A,2014-3-5.
[11]王道林,刘伟禄,徐姣,等.奥扎格雷钠的合成[J].中国医药工业杂志,2007,38(5):325-326.
[12]郑信福,尹升镇,赵龙铉.奥扎格雷钠的合成[J].中国医药工业杂志,1995,26(5):196-197.
[13]Shen Y,Xin Y,Zhao J.A new method for carbon-carbon double bond formation promoted by tri-n-butylphosphine and zinc[J].Tetrahedron Lett,1988,29(47):6119-6120.
[14]Shen Y,Zhou Y.Palladium-catalyzed conversion of aldehydes to alkenes in the presence of tri-n-butylphosphine[J].Tetrahedron Lett,1991,32(4):513-514.
[15]Shen Yanchang,Yang Baozheng,Yuan Gang.Novel conversion of aldehydes to alkenesmediated by tri-n-butylarsine and zinc[J].JChem Soc Chem Commun,1989(2):144.
[16]Shi Lilian,Wang Weibo,Wang Yucheng,et al.The first example of a catalytic witting-type reaction tri-n-butylarsine and zinc[J].JCSCC,1989,54(9):2027-2028.
[17]汪润瑛,任云峰.肿瘤的化学治疗ⅩⅪ.对、间及邻[双-(2-氯乙基)氨甲基]-苯丙烯酸盐酸盐及其酯类的合成[J].药学学报,1964,11(9):591-595.
[18]Liu Jiaming,Young Jennjong,Li Yujang,et al.Synthesis of Substituted 1,2-Dihy-droisoquinolines by the Intramolecular 1,3-Dipolar Alkyl Azide-olefin Cycloaddition[J].JOC,1986,51:1120-1123.
[19]Cope AC,Liss TA,Smith DS.Cyclic Polyolefins.XLI.Reaction of Acetyl Bromide and Propionyl Chloride with Cyclooctatetraene[J].JAm Chem Soc,1957,79(1):241-243.
[20]Fuentes A,Marinas JM,Sinisterra JV.Witting-Horner reaction catalyzed by activated barium hydroxide in the presence of ultrasound[J].Tetrahedron Lett,1987,28(26):2951-2954.
[21]Xu CY,Liu GJ,Zhang Z.Phase-transfer catalyzed alkylative elimination of methyl 2-phenylsulfinylacetate.A one-pot synthesis of substitute cinnamates[J].Synth Commun,1987,17(15):1839-1843.
[22]Kamigata N,Satoh M,Fukushima T.Reactions of Arylazoxy Aryl Sulfones withα,β-Unsaturated Esters and Nitriles in the Presence of a Palladium Catalyst[J].Bull Chem Soc Jpn,1990,63(7):2118-2120.
Graphical synthetic route of ozagrel
ZHANG Li-juan1,SONG Tie-bing2,YANG Jiao2,ZHANG Xiao-you2
(1.College of Pharmacy,Jiamusi University,Jiamusi154002,China;2.Department of Clinical Pharmacy,Daqing Oil Field General Hospital,Daqing 163001,China)
Ozagrel is amedicine of antiplateletaggregate,and widely used in clinical practice.In order to find low toxicity and high yield method to synthesize ozagrel or it′s salts.We have a reviewed to synthetic routes of ozagrel,and it provide a reference for ozagrel synthesis.
Ozagrel;Synthesis;Review
TQ460.31
A
2095-5375(2014)12-0736-003
张立娟,女,研究方向:药物合成,E-mail:1536408862@qq.com
张晓友,男,主任药师,研究生导师,研究方向:药物合成,Tel:13359834567,E-mail:zlj0903@yeah.net
