琥珀酸美托洛尔缓释片的制备及体外释放度考察
2014-03-08何盛江平其能
宋 力,何盛江,平其能
(1.中国药科大学,江苏南京210009;2.广东省中药研究所,广东广州510520)
·制剂研究·
琥珀酸美托洛尔缓释片的制备及体外释放度考察
宋 力1,何盛江2,平其能1
(1.中国药科大学,江苏南京210009;2.广东省中药研究所,广东广州510520)
目的制备与倍他乐克释放行为一致的琥珀酸美托洛尔缓释片。方法采用正交试验优化琥珀酸美托洛尔缓释片的处方工艺,通过高效液相色谱法测定体外释放度,并考察处方工艺的重复性,并与市售片进行F2相似因子比较。结果自制片3批次各取样点释放度的SD值均小于2%,F2值分别为92.6、91.5、87.2。结论本处方工艺稳定且释放行为与市售片相似。
琥珀酸美托洛尔;缓释片;体外释放
琥珀酸美托洛尔是β-肾上腺素能受体阻滞剂,主要用于高血压、心绞痛、心肌梗死、心律失常等心血管疾病[1]。琥珀酸美托洛尔的选择性是剂量依赖的,由于缓释片血药浓度的峰值明显低于同剂量的普通片,使该剂型有相对更高的β1受体选择性,且吸收速度缓慢而均衡可持续24 h恒定的血药浓度,几乎不受进食或其他因素影响,具有非常突出的治疗效能[2,3],为临床医师实际选择提供更广泛的空间。阿斯利康研发出琥珀酸美托洛尔缓释片(倍他乐克)最先上市,其制备方法为微丸压片,通过微丸包衣上药后包缓释包衣层的方法控制药物的释放[4]。我们在前人基础上采用直接压片法得到与倍他乐克的相似的体外释放,提出工艺更为简单,重复性良好的琥珀酸美托洛尔缓释片的一种制备方法。
1 仪器与材料
1.1 仪器 ZPS-8旋转压片机(上海天祥健台制药机械有限公司);YPD-300C片剂硬度测定仪、CJY-300D片剂脆碎度测定仪(上海黄海药检仪器有限公司);ZRS-8G溶出仪(天津市天大天发科技有限公司);Waters e2695高效液相色谱仪(美国Waters公司);BS214D型电子天平(北京赛多利斯天平有限公司)。
1.2 材料 琥珀酸美托洛尔(MS)原料药(含量99.3%,批号:H120303,湖北康宝泰精细化工有限公司);羟丙基甲基纤维素(HPMC,上海昌为医药辅料技术有限公司);交联羧甲基纤维素钠(交联CMC-Na,安徽山河药用辅料股份有限公司);硬脂酸镁(安徽山河药用辅料股份有限公司);乳糖(德国美剂乐集团);甲醇、磷酸和乙腈为色谱纯,水为高纯水,其余试剂均为分析纯。
2 试验方法
2.1 琥珀酸美托洛尔缓释片制备方法 将处方量的琥珀酸美托洛尔和60%HPMC K100M,CMC-Na(600~1 000 mPa·s)过筛混合均匀后用80%乙醇溶液制粒,55~60℃干燥,18目筛网整粒,加入剩余的40%HPMC K100M和二氧化硅混合均匀后加入硬脂酸镁混合后压片。
2.2 含量测定
2.2.1 色谱条件 以0.1%磷酸(其中含十二烷基磺酸钠1.3 g·L-1)-乙腈(60:40)为流动相;流速为0.9 mL·min-1;柱温为30℃;检测波长为223 nm;进样体积为10μL。
琥珀酸美托洛尔在6.6 min处出峰,峰形良好,无杂质干扰,理论塔板数和分离度均符合测定要求。专属性实验表明,所用片剂辅料不影响琥珀酸美托洛尔的测定,如图1所示。
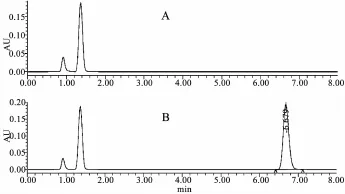
图1 琥珀酸美托洛尔缓释片HPLC图谱
2.2.2 标准曲线的建立 精密称定琥珀酸美托洛尔对照品约25 mg,置25 mL量瓶中,加80%甲醇溶液溶解并稀释至刻度,摇匀,作为母液。精密量取母液1、2、4、5、6、8、12 mL,分别置100 mL量瓶中,加流动相稀释至刻度,摇匀,配制成为浓度分别为10、20、40、50、60、80、120μg·mL-1的溶液。分别精密移取上述浓度溶液10μL,注入液相色谱仪,记录色谱图。用浓度C对峰面积A进行线性回归,得回归方程为A=34 802 C-159,r2=0.999 9,表明本品进样浓度在10~120μg·mL-1范围内呈良好线性。
2.2.3 精密度测定 取标准曲线项下浓度50 μg·mL-1溶液,连续进样6次,记录峰面积并计算相对标准偏差,结果RSD=0.2%,符合含量测定要求。
2.2.4 回收率试验 分别精密称取琥珀酸美托洛尔对照品25 mg各3份,置于25 mL量瓶中,按“2.2.2”项下操作配制3份母液。分别移取母液1、5、12 mL,于100 mL量瓶中,加入空白辅料约40 mg,加80%甲醇适量,超声20min后,定容,得低、中、高浓度系列溶液。按“2.2.1”项下色谱条件测定,记录峰面积,计算回收率。3个浓度的平均加样回收率为99.8%,RSD为0.97%。
2.2.5 样品稳定性研究 精密称定琥珀酸美托洛尔对照品约10 mg,置10 mL量瓶中,加80%甲醇溶液溶解并稀释至刻度,摇匀,作为母液,精密量取母液5 mL加纯化水稀释至刻度,摇匀,配制成为浓度50μg·mL-1样品溶液,测定其在1、2、4、8、12、24 h时的峰面积,计算其RSD为0.41%,表明样品溶液24 h内稳定。
2.2.6 释放度测定 采用桨法绘制释放曲线,以磷酸盐缓冲(pH 6.8)为释放介质,转速为50 rpm,温度为(37±0.5)℃;在1、2、3、4、6、8、10、12、14、16、18、20、22、24 h分别取溶液5 mL,滤过并及时补充相同温度、相同体积的释放介质,分别取续滤液测定峰面积,并计算每片在不同时间的释放量,绘制释放曲线。
2.3 处方优化 琥珀酸美托洛尔骨架片体外释放行为受诸多因素的影响。在单因素实验的基础上,采用正交试验[5~7]将较为关键的3个因素HPMC K 100M、CMC-Na的含量,以及片剂硬度作为考察对象,以释放曲线相似因子(F2)作为考察指标优化处方,采用直观分析所得结果。正交实验因素水平详见表1。表2中的极差R数值反应各因素对指标的影响程度,极差越大,影响程度越大[8],由结果可知A>B>C。由表2可知各因素的最佳水平分别为:A:2>1>3;B:2>1>3;C:2>3>1。从而得出缓释片的较优处方为A2B2C2。

表1 L9(34)正交实验因素水平表
2.4 处方验证 以正交试验设计优化的最佳处方按上述制备工艺分别制备3批缓释片,每批6片按释放度测定方法操作,检查批与批之间的重复性,及各批样品各取样时间点的均一性,考察制备工艺的稳定性,并计算与倍他乐克的相似因子F2。自制片3批次各取样点释放度的SD值均小于2%,F2值分别为:92.6、91.5、87.2。提示该处方工艺重复性好。且释放行为与倍他乐克相似。
Preparation and in vivo release comparation of M etoprolol Succinate Extended-release Tablets
SONG Li1,HE Sheng-jiang2,PINGQi-neng1
(1.China Pharmaceutical University,Nanjing 210009,China;2.Guangdong Research Institute of Traditional Chinese Medicine,Guangzhou 510520,China)
ObjectiveTo prepare Metoprolol Succinate Extended-release Tablets that release profile is similar with Betaloc.M ethodsUsing orthogonal test to optimize the prescription of Metoprolol Succinate Extended-release Tablets;Drawing the in-vitro release profile by HPLC,and calculating the value of F2.ResultsThe SD value of each sampling time of the three batcheswas less than 2%,the values of F2were 92.6,91.5,87.2,respectively.ConclusionThe results showed that the prescription was stability and release profile was similar to the commercially available tablets.
Metoprolol succinate;Extended-release tablets;In vitro release
R944.9
A
2095-5375(2014)11-0645-003
宋力,男,博士研究生,研究方向:药物新剂型与新技术,E-mail:songli1973@163.com
