番茄果实特异性LYC-B干扰载体的构建及在不同颜色果实中的表达特异性验证
2014-03-08
(西北农林科技大学园艺学院,陕西杨凌712100)
番茄果实特异性LYC-B干扰载体的构建及在不同颜色果实中的表达特异性验证
王巧丽 梁 燕*张振才 李 翠 李云洲 王玲慧
(西北农林科技大学园艺学院,陕西杨凌712100)
为了研究番茄LYC-B干扰对类胡萝卜素合成主要酶和主要代谢产物的影响,构建了果实特异性的番茄红素β-环化酶LYC-B干扰载体,并验证了其在不同颜色番茄果实中的有效性。依据X13437.1扩增番茄果实特异启动子E8,构建了果实特异性载体E8-pBI121,其在粉色、红色、绿色和紫色的番茄果实中均能表达。依据X86452.1扩增番茄LYC-B从61~861 bp 间长度为801 bp的片段LYC-B1和从 480~781 bp 间长度为302 bp的片段 LYC-B2,构建了以CaMV 35S为启动子的LYC-B干扰表达载体pBI121-B1B2,以E8替换CaMV 35S,构建了果实特异性干扰载体E8-pBI121-B1B2。采用农杆菌注射法分别侵染番茄叶片和果实,GUS染色显示,pBI121-B1B2在叶片、果实和种子中均表达,E8-pBI121-B1B2只在果实和种子中表达。
番茄;类胡萝卜素;E8启动子;CaMV 35S启动子;GUS染色
据统计,至2010年全球番茄产量达14.1亿t(Branthôme,2010)。随着人们生活水平的提高,番茄的营养和保健作用越来越受到重视,其中最重要的一类功能物质就是类胡萝卜素(Fraser&Bramley,2004)。
番茄类胡萝卜素合成代谢途径的研究已经较为明晰(姜娜娜 等,2007;Cazzonelli&Pogson,2010)。在番茄果实类胡萝卜素代谢中有两个关键调控点:一是八氢番茄红素合成酶,作用于牻牛儿基牻牛儿基焦磷酸,启动类胡萝卜素合成代谢;二是番茄红素环化酶,作用于番茄红素,启动番茄红素降解为含环和含氧的类胡萝卜素。番茄体内八氢番茄红素合成酶由PSY1和PSY2编码,PSY1在花和果实中特异性表达,PSY2本底水平表达(Ray et al.,1987;Bartley et al.,1992;Fraser et al.,1999;Giorio et al.,2008)。已有一系列试验研究了PSY1对类胡萝卜素合成代谢基因表达和物质积累的影响(Fraser et al.,2002,2007; Gady et al.,2012;Robertson et al.,2012;Fantini et al.,2013)。番茄红素环化酶分别由LYC-B、 LYC-E和 CYC-B编码,其中CYC-B只在花和果实中特异性表达(Dalal et al.,2010),LYC-B和LYC-E组成型表达,三者均在果实成熟时下调表达(Pecker et al.,1996;Ronen et al.,1999,2000)。在果实未成熟时,番茄果实中牻牛儿基牻牛儿基焦磷酸沿着不同代谢途径合成植醇、赤霉素、类胡萝卜素和脱落酸等;当果实开始转色时,PSY1表达水平成倍增加,这时牻牛儿基牻牛儿基焦磷酸主要合成类胡萝卜素(Giuliano et al.,1993),同时番茄红素环化酶基因表达下降,开始积累番茄红素(Bramley,2002)。
番茄红素环化酶的研究主要集中在两个方面,一是抑制红色或者粉色番茄中番茄红素环化酶的表达,提高番茄红素含量(万群 等,2007;徐加新和梁燕,2009; 马超 等,2010);二是通过上调番茄红素β-环化酶的表达,提高维生素A源物质含量(Apel&Bock,2009)。前人研究均侧重于获得番茄红素或者维生素A源物质含量较高的番茄,但关于番茄红素β-环化酶干扰对整个类胡萝卜素代谢影响的研究仅限于Rosati等(2000)的研究。Rosati等(2000)用番茄PDS的启动子和拟南芥LYC-B构建番茄红素β-环化酶正义表达载体(OE)和反义表达载体(AS),测定了转基因和对照Money Maker番茄中番茄红素、β-胡萝卜素含量和总的类胡萝卜素含量及PSY1、PSY2、PDS、ZDS和LYC-B基因的表达水平。获得的OE和AS转基因植株果实内总的类胡萝卜素含量均增加;5个OE转基因系OE1~OE5的β-胡萝卜素含量与番茄红素含量的比值均增加,6个AS转基因系AS1~AS6的β-胡萝卜素含量与番茄红素含量的比值均下降。OE1~OE4果实PSY1、PSY2、PDS基因表达水平上升,而ZDS和LYC-B(除OE1外)基因表达水平下降;4个AS系(只测了AS3~AS6)中AS5和AS6中基因表达变化同OE系,AS3和AS4中这些基因表达水平均下降。
由于未知原因,Rosati等(2000)获得的OE系其基因表达水平和AS系有某些相似之处,即PSY1、PSY2、PDS基因表达水平上升,而ZDS和LYC-B基因表达水平下降,这与OE和AS系中色素含量的不同有矛盾之处。由于当时色素测量技术的局限性,Rosati等只测了番茄红素和β-胡萝卜素的含量,无法将基因表达和色素积累对应起来。随着高效液相色谱技术的发展,C30反相柱性能的改良,类胡萝卜素代谢上所有中间产物的测定均成为可能(Fraser et al.,2007;Fantini et al.,2013)。番茄以果实为产品器官,因此本试验拟构建在番茄果实特异性E8启动子下的番茄LYC-B干扰载体,沿着前人基础深入研究LYC-B干扰对类胡萝卜素代谢主要酶和代谢物质的具体影响。
近年来的研究表明不同颜色果实中所含的色素不同(孟凡娟 等,2006;曲瑞芳 等,2006;王蕾等,2011;赵润洲和刘鸣韬,2011)。红色和粉色番茄果实中含有大量番茄红素和少量的β-胡萝卜素。绿色番茄果实中仅含有少量β-胡萝卜素和叶黄素,但含有大量叶绿素。紫色番茄果实中含较多番茄红素和β-胡萝卜素,同时含有大量叶绿素。黄色果实中以ζ-胡萝卜素或β-胡萝卜素为主。不同果实颜色与类胡萝卜素代谢基因息息相关(金凤媚 等,2006),利用不同颜色果实一起进行研究,更能明确LYC-B干扰对类胡萝卜素代谢可能具有的正向或者反向调控位点。本试验以红色、粉色、黄色、绿色和紫色的番茄果实为材料,拟构建番茄果实特异性E8启动子启动的LYC-B干扰表达载体,并通过GUS报告基因对其在不同果色番茄果实中的表达进行载体有效性验证。
1 材料与方法
1.1 材料与试剂
供试材料 S2、S3、S5及S77均为樱桃番茄(Solanum lycopersicum L. var cerasiforme Alef.),果实成熟时颜色分别为粉色、紫色、绿色和红色,由西北农林科技大学园艺学院番茄种质资源课题组提供。
试剂pMD®18-T Vector购自TaKaRa宝生物工程(大连)有限公司,pBI121质粒、大肠杆菌DH5α感受态和农杆菌GV3101感受态由本课题组保存。Trizol试剂盒购自北京索莱宝科技有限公司;反转录试剂盒、pfu DNA聚合酶和dNTP购自上海生工生物工程公司;限制性内切酶和T4 DNA连接酶购自Fermentas公司;引物合成与测序由上海生工生物工程公司完成;DNA纯化回收试剂盒和质粒提取试剂盒购于天根生化科技有限公司,抗生素和X-Gluc购于Amresco;其他常规试剂采用国产分析纯。
1.2 载体构建
1.2.1 番茄基因组DNA和RNA提取 采用CTAB法提取番茄基因组DNA。Trizol法提取总RNA,用PrimeScript RT reagent Kit反转录试剂盒合成cDNA第一条链(吴江敏 等,2011)。
1.2.2 E8启动子的扩增 根据GenBank中樱桃番茄的E8序列X13437.1设计引物如下:
上游引物 E8F:
5′ GAAGGAATTTCACGAAATCGGC 3′
下游引物 E8R:
5′ TCTTTTGCACTGTGAATGATTAG 3′
50 μL PCR反应体系: 5 μL 10×pfu buffer,1 μL dNTP,2 μL E8F引物(10 μmol·L-1),2 μL E8R引物(10 μmol·L-1),模板DNA 2 μL(1 200 ng·μL-1),加双蒸水至50 μL。 PCR反应条件为94 ℃预变性5 min;94 ℃变性30 s,47℃退火30 s,72 ℃延伸80 s,35个循环;最后72℃延伸10 min。
1.2.3 LYC-B基因片段B1、B2的扩增、克隆载体的构建及测序 根据GenBank中X86452.1设计两对特异性引物。其中P1F和P1R用于克隆从61~861 bp的LYC-B1片段,P2F 和P2R用于克隆从480~781 bp的LYC-B2片段,B1反向和B2正向连接能形成发卡结构。
引物序列如下:
P1F 5′GGCGCGCCAGGACCCCATTTGAAGTT TTCTTG 3′,5′引入Asc I酶切位点
P1R 5′GTGCTCTTCCACTTCAGCCA 3′
P2F 5′GGCGCGCCCTATGGTGTTTGGGTGGA TG 3′,5′引入Asc I酶切位点
P2R 5′CTAGAGAAGCCAGTTGCATC 3′
B1片段PCR反应50 μL体系:5 μL 10×pfu buffer,1 μL dNTP,2 μL P1F引物(10 μmol·L-1),2 μL P1R引物(10 μmol·L-1),cDNA 200 ng,加DEPC水至50 μL。PCR反应条件为94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s,35个循环;最后72 ℃延伸10 min。B2片段PCR反应体系与反应条件基本同上,但需要将引物改为P2F与P2R,退火温度为55 ℃,变性退火及延伸时间均为30 s。
克隆载体的构建及测序参考姜娜娜等(2007)的方法。
1.2.4 果实特异性干扰载体构建 质粒酶切反应体系及条件参考Fermentas酶切体系说明(单酶切http://www.thermoscientificbio.com/restriction-andmodifying-enzymes/restriction-enzymes/conventional,双酶切http://www.thermoscientificbio.com/webtools/ doubledigest/)。载体构建过程参考徐加新和梁燕(2009)的方法。
1.2.5 载体的酶切验证 构建的载体采用冻融法转化农杆菌GV3101,在含有50 μg·mL-1Kan、50 μg·mL-1Gen和10 μg·mL-1Rif的LB固体培养基上,28 ℃暗培养2 d。挑选阳性克隆在含有50 μg·mL-1Kan、50 μg·mL-1Gen和10 μg·mL-1Rif的LB液体培养基上扩繁,菌液PCR验证正确后提取质粒进行酶切验证。
1.3 载体在不同果色番茄中瞬时表达验证
将阳性克隆菌液摇至OD600在0.4~0.6之间,4 000 r·min-1离心5 min,用1/2MS液体培养基悬浮,在28 ℃ 50 r·min-1的摇床上暗培养3 h,用悬浮液注射番茄活体果实和叶片。
活体果实注射:塑料大棚内选取转色期番茄果实,用1 mL注射器吸取菌液,沿着果顶垂直插入果实中轴中,缓缓注入菌液至菌液沿着果实萼片交界处溢出为止(约0.5 mL)。7 d后采果,用打孔器垂直横穿果实中部取样,用小刀将长圆柱形样品切成短圆柱形,进行GUS染色。
活体叶片注射:塑料大棚内选取番茄中上部约5 cm长的小叶片,一手持载玻片,将叶片中部正面朝下平铺在载玻片上,在叶片背面用1 mL注射器针头沿主叶脉扎1个小孔,去掉注射器针头,从小孔处注入菌液,菌液注入后叶片颜色比未注射的叶片颜色明显变深,呈现暗绿色。7 d后用打孔器取样,进行GUS染色。
GUS染色参考吴江敏等(2011)的方法。
2 结果与分析
2.1 E8,LYC-B1,LYC-B2的克隆
以番茄基因组DNA为模板,用根据GenBank中X13437.1设计的引物E8F和E8R,PCR扩增得到长度为1 181 bp的番茄果实特异性启动子E8目的片段。以番茄cDNA为模板,用根据X86452.1设计的两对特异引物P1F、P1R和P2F、P2R,扩增得番茄LYC-B从61~861 bp 间长度为801 bp的片段即LYC-B1和从 480~781 bp 间长度为302 bp的片段即 LYC-B2。将上述3个片段分别与pMD®18-T载体连接,挑选阳性克隆,摇菌测序。测序结果显示,E8与X13437.1相似度为99%,PLANCE分析发现,扩增得到的E8序列与X13437.1相比,少了7个重复元件(表1),多了8个新元件(表2)。LYC-B1和LYC-B2与X86452.1相应序列100%相同。后续可以用连接好的质粒pMD-E8、pMD-B1和pMD-B2来构建番茄果实特异性干扰表达载体。
2.2 CaMV 35S启动子载体pBI121-B1B2的构建
用Asc I和BamH I双酶切pMD-LYC-B1(图1),用Asc I和Sma I双酶切pMD-LYC-B2(图2),分别回收818 bp(808 bp的目的片段和少量载体序列)和325 bp(302 bp的目的片段和部分载体序列)片段。两片段有一端均为Asc I酶切末端,在T4连接酶作用下,实现B1反向B2正向连接,回收约1 140 bp的连接片段(图3)。用BamH I和Sma I双酶切pBI121,回收大片段,与B1B2连接产物进行连接,转化并筛选阳性克隆,酶切验证插入了目的片段(图4),即为pBI121-B1B2。
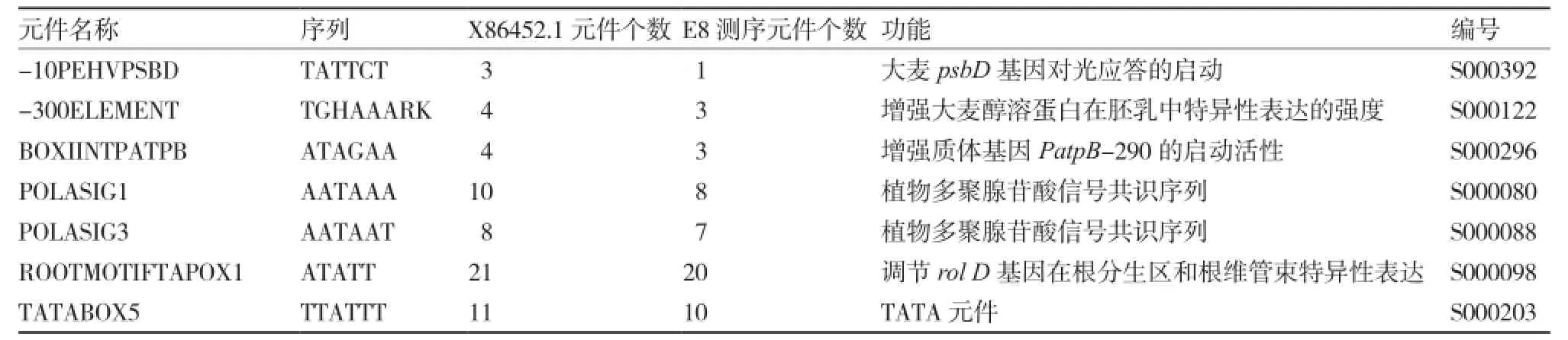
表1 X13437.1与克隆E8的序列元件比较

表2克隆的E8序列上出现的新元件
2.3 E8果实特异性启动子表达载体E8-pBI121-B1B2的构建
用HindⅢ和Xba I双酶切pMD-E8(图5),回收1148 bp片段,用HindⅢ和Xba I双酶切pBI121回收13 893 bp片段,两回收片段以质量比约为1∶1进行连接转化并筛选阳性克隆,提取质粒用HindⅢ和Xba I进行酶切验证,显示E8已经取代CaMV 35S插入pBI121启动子区,该质粒即为E8-pBI121(图6)。E8-pBI121和pBI121-B1B2分别用BamH I进行单酶切,并以质量比约为1∶1进行连接,酶切验证质粒获得番茄LYC-B果实特异性干扰载体E8-pBI121-B1B2(图7)。
2.4 E8-pBI121、pBI121-B1B2和E8-pBI121-B1B2在番茄不同颜色果实中的表达
E8-pBI121、pBI121-B1B2和E8-pBI121-B1B2分别通过冻融法转化农杆菌GV3101,用阳性菌落摇菌,制备农杆菌注射液,分别对番茄材料进行叶片和果实注射,并对注射后的叶片和果实进行GUS染色,见图8和图9。
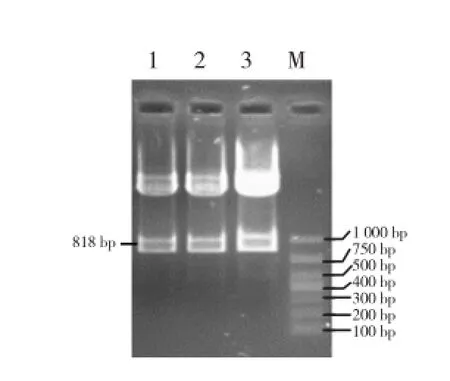
图1 pMD-LYC-B1质粒Asc I和BamH I双酶切谱图
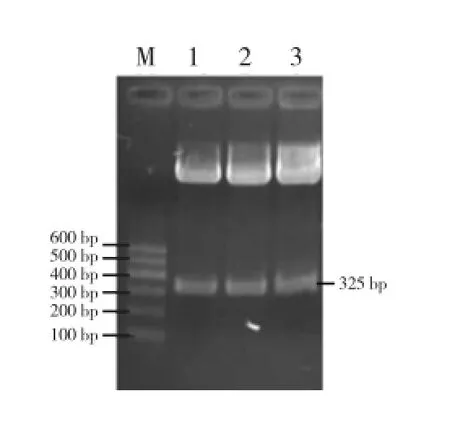
图2 pMD-LYC-B2质粒Asc I和Sma I双酶切图谱
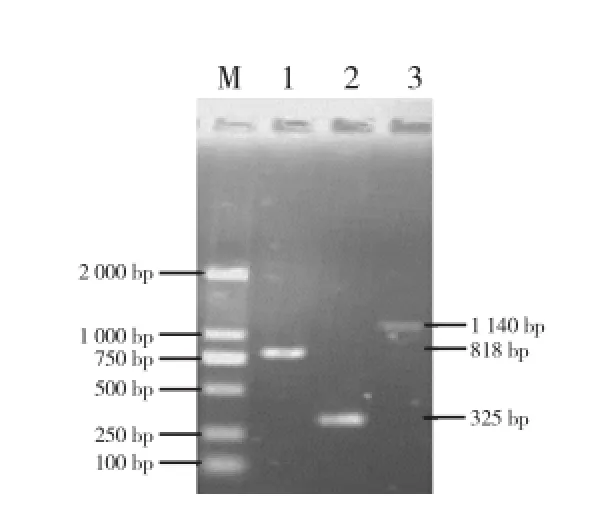
图3 LYC-B1、LYC-B2和B1B2连接回收产物
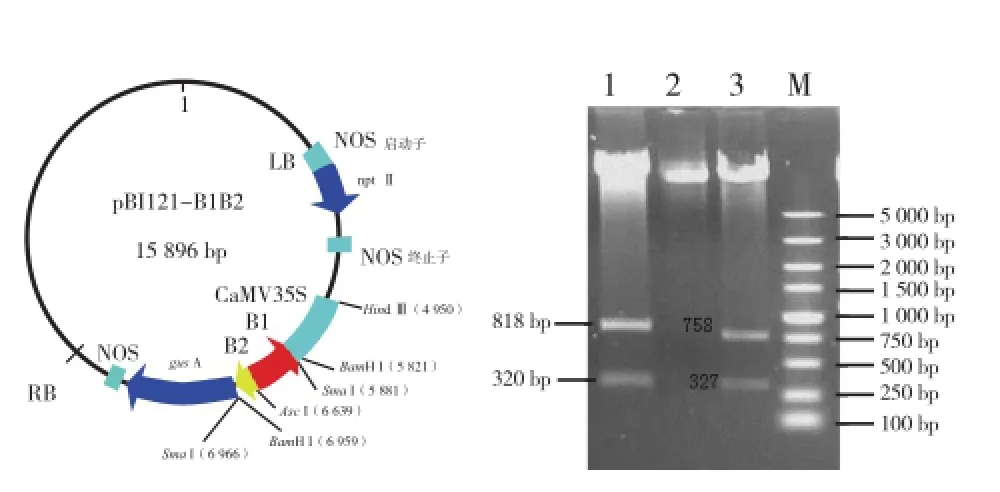
图4 pBI121-B1B2质粒结构图及酶切验证
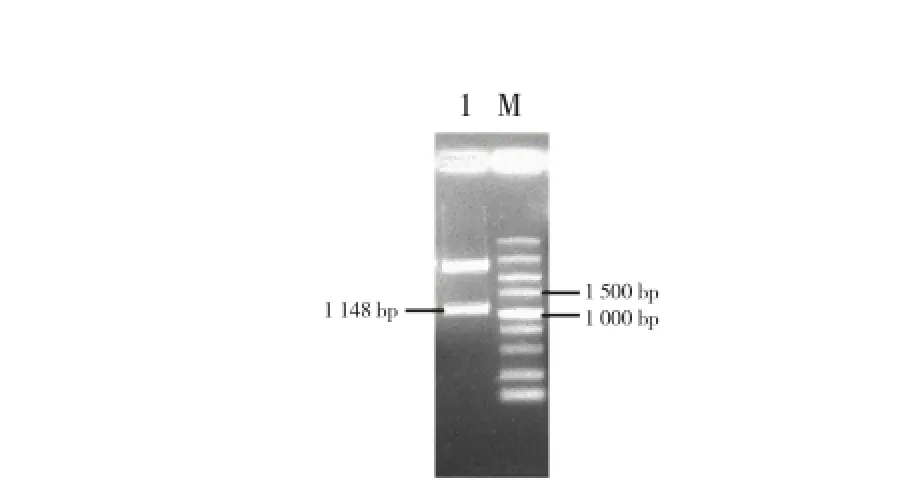
图5 pMD-E8质粒HindⅢ和Xba I双酶切图谱
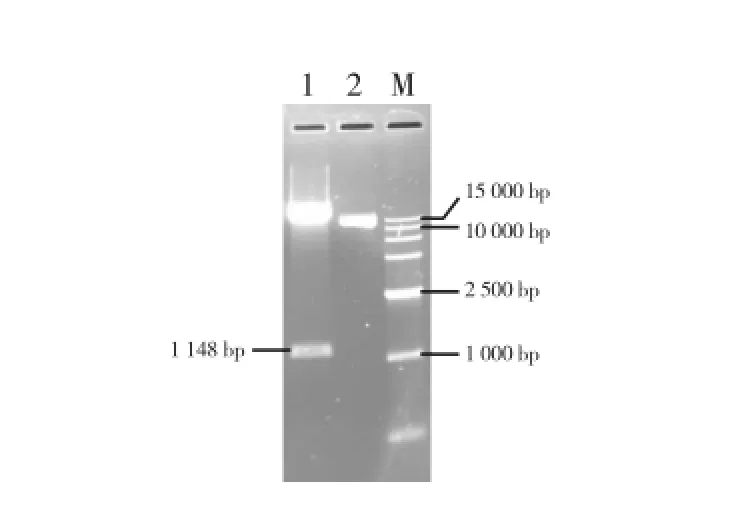
图6 E8-pBI121质粒Hin dⅢ和Xba I双酶切验证
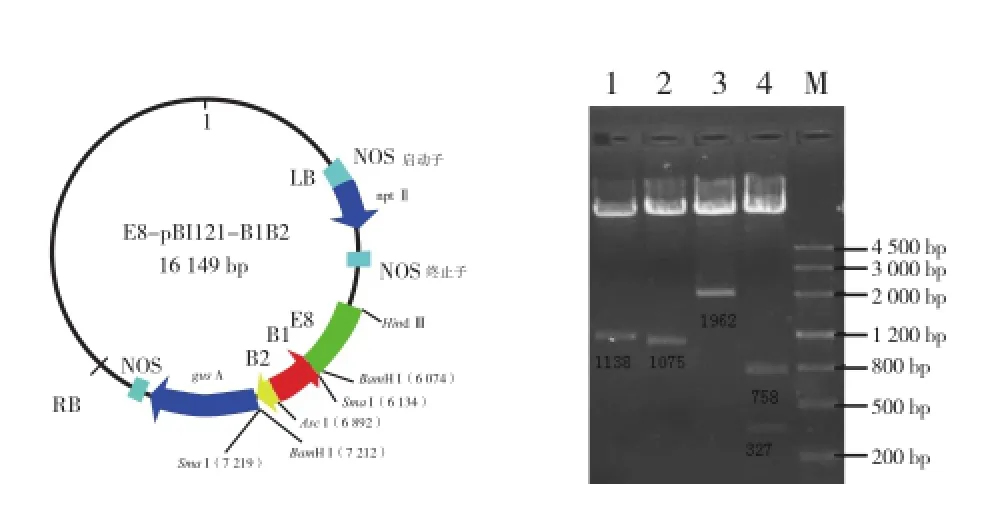
图7 E8-pBI121-B1B2质粒结构图和酶切验证
由图8可以看出,用含E8-pBI121质粒的农杆菌菌液注射S2(粉色)、S3(紫色)、S5(绿色)、S77(红色)4种不同颜色番茄果实后,果肉中GUS染色颜色都呈现蓝色,而未经过注射的对照果实果肉没有蓝色呈现,说明本试验所克隆的E8在这4个材料果实中均有表达,可以作为番茄果实特异性启动子使用。
由图9可以看出,以CaMV 35S为启动子的pBI121-B1B2质粒转化的农杆菌菌液注射的S77(红色),GUS染色后叶片、果皮、果肉、种子和种皮被毛均呈现蓝色(图9),而未经pBI121-B1B2侵染的对照相应的各个器官均无蓝色呈现,说明以CaMV 35S作为启动子的pBI121-B1B2中GUS在植株的叶片、果实、种子均能表达。E8-pBI121-B1B2在S77果实瞬时表达后,GUS染色结果为果皮、果肉、种子和种皮被毛均被染色成蓝色,与pBI121-B1B2不同的是叶片没有呈现蓝色,再次验证了本试验中克隆的E8为果实特异性启动子。在S2、S3和S5中有相同的GUS染色结果。
图8和图9呈现的结果共同证明所构建E8-pBI121-B1B2果实特异性表达载体的有效性和果实特异性。载体E8-pBI121-B1B2可以用于研究LYC-B干扰对番茄不同颜色果实中类胡萝卜素代谢的具体影响。

图8 E8-pBI121瞬时表达于不同颜色番茄材料果实的GUS染色结果
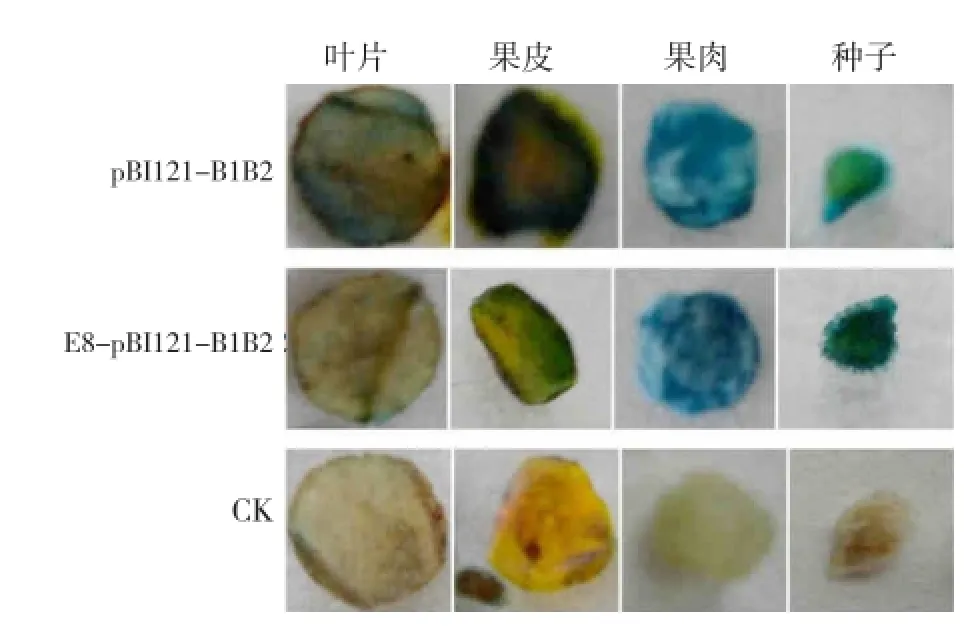
图9 pBI121-B1B2和E8-pBI121-B1B2瞬时表达于S77不同部位的GUS染色结果
3 结论与讨论
本试验所用载体为pBI121,以CaMV 35S为启动子。CaMV 35S启动子是双子叶植物表达载体中广泛使用的组成型启动子,其可驱动外源基因在转基因植株的所有部位和发育阶段持续表达,使植物体内有限的资源在无用的组织和发育阶段中浪费,造成植株不正常生长。如CaMV 35S驱动PSY1过表达致使植株体内赤霉素含量过少,植株出现矮化,不能正常发育(Fray et al.,1995)。周晓红等(2004)把CaMV 35S改造为E35S使其有更强的组成型启动子功能,3株转基因番茄在同等的实验条件下进行转化筛选诱导成苗,同步进行栽种,有2株果实形态偏离了正常,呈现小棉桃型。为避免组成型启动子造成的类似弊端,加之番茄以果实作为主要食用器官和商品器官,所以本试验采用了果实特异性的启动子。番茄果实特异性启动子有PSY1、CYC-B、PDS(Corona et al.,1996)、E8(Deikman&Fischer,1988,1992)、PG(Nicholass et al.,1995)等基因的启动子。以往研究发现PDS启动子上可能存在着与其他类胡萝卜素基因转录相关的反式作用因子(Rosati et al.,2000)。本试验研究的是番茄果实类胡萝卜素代谢,选用了E8启动子。
Zhao等(2009)从7个番茄亚种共16个材料中分别克隆了E8启动子,发现E8启动子序列长度从2 101 bp到2 256 bp不等,序列相似性为69.9%。Deikman和Fischer(1988)及Deikman等(1992)对一个全长为2 181 bp的E8的启动子序列进行分析,发现E8有两个组成部分:第一部分是从转录起始位点到-1 088处的 “核心区域”,在果实成熟时启动特异性转录;第二部分则是转录起始位点-1 088到-2 181处的 “辅助区域”,含有乙烯反应性的转录元件,能够增强E8启动子的转录效率。只要有“核心区域”E8就能在果实中表达。本试验依据樱桃番茄E8启动子(GenBank ID X13437.1)克隆了约1.1 kb E8序列,测序显示两者同源性为99%。GUS染色结果表明,CaMV 35S启动子在叶片和果实中均表达,而E8只在果实中表达,与已有的研究结果一致(周晓红,2004;丁淑丽 等,2006;Kesanakurti et al.,2012),证明了本试验所构建的番茄果实特异性干扰载体E8-pBI121-B1B2的有效性。
本课题组现拥有不同果实颜色的番茄材料,E8-pBI121-B1B2在不同果色番茄中均有果实特异性,这对于番茄类胡萝卜素代谢的研究提供了方便,本试验构建的载体对不同果实颜色番茄进行转化为揭示番茄红素β-环化酶对类胡萝卜素代谢酶和物质的具体影响及调控位点做了一个铺垫。
丁淑丽,李建勇,邹宜静,卢钢,曹家树.2006.酵母SAMDC基因表达载体构建以及农杆菌介导转化番茄的研究.浙江大学学报:农业与生命科学版,32(6):621-627.
姜娜娜,李长生,王绛辉,毕玉平,王兴军.2007.番茄类胡萝卜素的研究.安徽农业科学,35(34):10979-10980.
金凤媚,薛俊,郏艳红,刘仲齐.2006.番茄果实颜色相关基因的研究进展.天津农业科学,12(4):3-6.
马超,何娟,郝青南,王蕾,鲁晓燕,马兵钢.2010.构建番茄红素β/ε环化酶基因RNAi植物表达载体及其表达分析.核农学报,24(3):482-489.
孟凡娟,许向阳,李景富.2006.番茄果实色素含量和表面颜色相关性研究.东北农业大学学报,37(4):459-462.
曲瑞芳,梁燕,巩振辉,杨永政.2006.番茄不同品种间番茄红素含量变化规律的研究.西北农业学报,15(3):121-123.
万群,张兴国,宋明.2007.果实特异性RNAi介导的基因沉默来增加番茄中番茄红素的含量.生物工程学报,23(3):429-433.
王蕾,岳英,鲁晓燕,马兵钢.2011.不同色泽番茄品种类胡萝卜素含量的HPLC分析.石河子大学学报:自然科学版,29(4):442-447.
吴江敏,孙亚东,梁燕,徐加新.2011.番茄红素-β-环化酶(LYC-b)反义基因在番茄转基因后代的表达及其遗传稳定性.农业生物技术学报,19(5):801-807.
徐加新,梁燕.2009.LYC-b基因反义表达对番茄果实番茄红素含量的影响.西北农林科技大学学报:自然科学版,37(12):127-132.
赵润洲,刘鸣韬.2011.番茄果实色泽与色素组成的关系.河南农业科学,40(9):98-100.
周晓红.2004.弓形虫MAG和tSAG1在转基因番茄中的表达研究〔博士论文〕.广州:第一军医大学.
Apel W,Bock R.2009.Enhancement of carotenoid biosynthesis in transplastomic tomatoes by induced lycopene-to-provitamin A conversion.Plant Physiol,151(1):59-66.
Bartley G E,Viitanen P V,Bacot K O,Scolnik P A.1992.A tomato gene expressed during fruit ripening encodes an enzyme of the carotenoid biosynthesis pathway.Journal of Biological Chemistry,267(8):5036-5039.
Bramley P M.2002.Regulation of carotenoid formation during tomato fruit ripening and development.Journal of Experimental Botany,53(377):2107-2113.
Branthôme F X.2010.Trends in tomato products consumption compared to total tomato consumption city.(http://www.chilealimentos.com/medios/Servicios/noticiero/EstudioMercadoCoyuntura2011/ Conservas/Fresh_vs_processed_tomato_consumption_study_ January_2011.pdf.)
Cazzonelli C I,Pogson B J.2010.Source to sink:regulation of carotenoid biosynthesis in plants.Trends Plant Sci,15(5):266-274.
Corona V,Aracri B,Kosturkova G,Bartley G E,Pitto L,Giorgetti L,Scolnik P A,Giuliano G.1996.Regulation of a carotenoid biosynthesis gene promoter during plant development.The Plant Journal,9(4):505-512.
Dalal M,Chinnusamy V,Bansal K C.2010.Isolation and functional characterization of lycopene β-cyclase(CYC-B) promoter from Solanum habrochaites.BMC Plant Biology,10(1):1-15.
Deikman J,Fischer R L.1988.Interaction of a DNA binding factor with the 5′-flanking region of an ethylene-responsive fruit ripening gene from tomato.EMBO J,7(11):3315-3320.
Deikman J,Kline R,Fischer R L.1992.Organization of ripening and ethylene regulatory regions in a fruit-specific promoter from tomato(Lycopersicon esculentum).Plant Physiology,100(4):2013-2017.
Fantini E,Falcone G,Frusciante S,Giliberto L,Giuliano G.2013.Dissection of tomato lycopene biosynthesis through virus-induced gene silencing.Plant Physiology,163(2):986-998.
Fraser P D,Bramley P M.2004.The biosynthesis and nutritional uses of carotenoids.Progress in Lipid Research,43(3):228-265.
Fraser P D,Kiano J W,Truesdale M R,Schuch W,Bramley P M.1999.Phytoene synthase-2 enzyme activity in tomato does not contribute to carotenoid synthesis in ripening fruit.Plant Molecular Biology,40:687-698.
Fraser P D,Romer S,Shipton C A,Mills P B,Kiano J W,Misawa N,Drake R G,Schuch W,Bramley P M.2002.Evaluation of transgenic tomato plants expressing an additional phytoene synthase in a fruit-specific manner.Proceedings of the National Academy of Sciences,99(2):1092-1097.
Fraser P D,Enfissi E M A,Halket J M,Truesdale M R,Yu D ,Gerrish C,Bramley P M.2007.Manipulation of phytoene levels in tomato fruit:effects on isoprenoids,plastids,and intermediary metabolism.Plant Cell,19(10):3194-3211.
Fray R G,Wallace A,Fraser P D,Valero D,Hedden P,Bramley P M,Grierson D.1995.Constitutive expression of a fruit phytoene synthase gene in transgenic tomatoes causes dwarfism by redirecting metabolites from the gibberellin pathway.The Plant Journal,8(5):693-701.
Gady A L F,Vriezen W H,Mhbj V d W,Huang P P,Bovy A G,Visser R G F,Bachem C W B.2012.Induced point mutations in the phytoene synthase 1 gene cause differences in carotenoid content during tomato fruit ripening.Molecular Breeding,29(3):801-812.
Giorio G,Stigliani A L,D' Ambrosio C.2008.Phytoene synthase genes in tomato(Solanum lycopersicum L.) -new data on the structures,the deduced amino acid sequences and the expression patterns.Febs Journal,275(3):527-535.
Giuliano G,Bartley G E,Scolnik P A.1993.Regulation of carotenoid biosynthesis during tomato development.Plant Cell,5(4):379-387.
Kesanakurti D,Kolattukudy P E,Kirti P B.2012.Fruit-specific overexpression of wound-induced tap1 under E8 promoter in tomato confers resistance to fungal pathogens at ripening stage.Physiologia Plantarum,146(2):136-148.
Nicholass F,Smith C S,Schuch W,Bird C,Grierson D.1995.High levels of ripening-specific reporter gene expression directed by tomato fruit polygalacturonase gene-flanking regions.Plant Molecular Biology,28(3):423-435.
Pecker I,Gabbay R,Cunningham F X.1996.Cloning and characterization of the cDNA for lycopene beta-cyclase from tomato reveals declease in its expression during fruit ripening.Plant Mol Biol,30(4):807-819.
Ray J,Bird C,Maunders M,Grierson D,Schuch W.1987.Sequence of pTOM5,a ripening related cDNA from tomato.Nucleic Acids Research,15(24):10587.
Robertson F P,Kaisa K P,Christopher G,Halket J M,Patel R K P,Fraser P D,Bramley P M.2012.Proteome changes in tomato lines transformed with phytoene synthase-1 in the sense and antisense orientations.Journal of Experimental Botany,63(16):6035-6043.
Ronen G,Cohen M,Zamir D,Hirschberg J.1999.Regulation ofcarotenoid biosynthesis during tomato fruit development:expression of the gene for lycopene epsilon cyclase is down regulated during ripening and is elevated in the mutant delta.Plant Journal,1(7):341-351.
Ronen G,Carmel-Goren L,Zamir D,Hirschberg J.2000.An alternative pathway to β-carotene formation in plant chromoplasts discovered by map-based cloning of Beta and old-gold color mutations in tomato.Proceedings of National Academy of Sciences,97:11102-11107.
Rosati C,Aquilani R,Dharmapuri S,Pallara P,Marusic C,Tavazza R,Bouvier F,Camara B,Giuliano G.2000.Metabolic engineering of beta-caroteneand lycopene content tomato fruit.Plant Journal,24(3):413-419.
Zhao Lingxia,Lu Liya,Zhang Lida,Wang Aoxue,Wang Ning,Liang Zhuobin,Lu Xiaowen,Tang Kexuan.2009.Molecular evolution of the E8 promoter in tomato and some of its relative wild species.Journal of Biosciences,34(1):71-83.
Construction of Cherry Tomato Fruit Specific LYC-B Interference Vector and Validation of Its Specific Expression in Fruits of Discrepant Colors
WANG Qiao-li,LIANG Yan*,ZHANG Zhen-cai,LI Cui,LI Yun-zhou,WANG Ling-hui
(College of Horticulture,Northwest Agriculture & Forestry University,Yangling 712100,Shaanxi,China)
The experiment will be conducted to research the specific impacts of lycopene β-cyclase interference on carotenoid metabolism,cherry tomato(Solanum lycopersicum L. var. cerasiforme Alef.) fruitspecific lycopene β-cyclase interference vector was constructed,and the validity in different color fruits were verified. Cherry tomato fruit-specific promoter E8 was amplified according to X13437.1 and fruit-specific vector of E8-pBI121 was constructed,which could be expressed in cherry tomato fruits of pink,red,green and purple colors. According to X86452.1,two different lycopene β-cyclase sequences B1 and B2 were amplified,LYC-B1 with 801 bp from 61 bp to 861 bp and LYC-B2 with 302 bp from 480 bp to 781 bp of LYC-B. The interference vector of pBI121-B1B2 with CaMV 35S promotor and the fruit-specific expression interference vectors of E8- pBI121-B1B2 with E8 promotor were constructed. E8-pBI121,pBI121-B1B2 and E8-pBI121-B1B2 were transferred into Agrobacterium tumefaciens GV3101 with the freeze-thaw method,then transformed into living cherry tomato fruits and leaves by injection. The results of GUS staining 7 days after injection showed that E8-pBI121 expressed in pink,red,green and purple cherry tomato fruits;pBI121-B1B2 expressed in leaves,fruits and seeds,while E8- pBI121-B1B2 expressed just in fruits and seeds.
Cherry tomato;Carotenoid;E8 promoter;CaMV 35S promoter;GUS
王巧丽,女,硕士研究生,主要从事番茄遗传育种研究工作,E-mail:wangql0704@163.com
*通讯作者(Corresponding author):梁燕,女,教授,博士生导师,主要从事番茄新品种选育与蔬菜种质资源创新研究工作,E-mail:liangyan@nwsuaf.edu.cn
2013-12-26;接受日期:2014-03-10
陕西省科技统筹创新工程计划项目(2011KTCL02-03),西北农林科技大学农业科技推广基金项目(TGZX2012-02)
