弓形虫酵母双杂交c DNA文库构建及与AMA1羧基端相互作用蛋白的筛选
2014-03-08程子英贾洪林
程子英,高 洋,王 铭,郑 君,贾洪林*,赵 权
(1.吉林农业大学 动物科学技术学院,吉林 长春 130118;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室-美国密西根州立大学天然免疫联合实验室,黑龙江 哈尔滨 150001;3.延边大学 农学院动物医学系,吉林 延吉 133000;4.东北农业大学 动物医学院,黑龙江 哈尔滨 150030)
弓形虫病是由刚地弓形虫引起的一种重要的人畜共患寄生虫病。受弓形虫感染的孕妇可将其垂直传播给胎儿,造成孕妇流产、早产、死胎及先天性弓形虫病;是造成免疫缺陷病人致死的机会性感染或引起先天性弓形虫病的重要原因[1-2]。同样,弓形虫病对家畜也会造成相同危害[3]。因此弓形虫的防治尤为重要。
AMA1(Apical membrane antigen 1,AMA1)是弓形虫的微线蛋白,该基因具有一个较短的羧基末端细胞质尾巴和一个较大的氨基末端胞外区域[4],在弓形虫入侵宿主细胞及其在细胞中复制起着重要的作用[5-6]。最初AMA1 羧基端(AMA1c)被认为仅提供蛋白运输的信号[7],近期研究表明其并无细胞器分泌的靶向作用[8],而是对虫体的侵入机制和细胞周期的调控机制产生一定的影响。这些研究表明,AMA1c 不仅对虫体侵入宿主细胞有作用,而且对虫体在细胞内的复制也有影响[9-10]。这些均为AMA1c的功能研究提供了新的线索。
酵母双杂交系统是一种简便有效、准确快捷的研究蛋白间相互作用的方法,廖亚金等利用该方法筛选出17 个与CSFV E2 相互作用的蛋白[11]。本实验构建了弓形虫酵母双杂交文库,通过酵母双杂交技术共筛选得到13 个与AMA1c 相互作用的蛋白,为进一步对AMA1c 的功能研究奠定了基础。
1 材料和方法
1.1 菌株及主要试剂 弓形虫RH 株为日本北海道带广畜产大学原虫病研究中心玄学南教授惠赠;大肠杆菌DH5α 由本研究室保存;Make Your Own"Mate&Plate" Library System 和 MatchmakerTMGold Yeast Two-Hybrid System 试剂盒及各种酵母缺陷型培养基均购自Clontech 公司;限制性内切酶购自TaKaRa 公司;DNA 聚合酶KOD 购自TOYOBO 公司;RNeasy Plus Mini Kit 购自QIAGEN 公司。
1.2 基因的克隆与鉴定 收集弓形虫RH 株虫体,利用RNeasy Plus Mini Kit 提取弓形虫总RNA。以oligo dT 为引物进行反转录PCR,以获得的cDNA为模板,采用引物 5'-CCGGAATTCTGCTACT TCGCGAAGAGGTTGGACA-3'(Eco R Ⅰ)和5'-CGC GGATCCTTAGTAATCCCCCTCGACCATAACA-3'(Bam HⅠ)扩增AMA1c 基因片段。将扩增的PCR 产物连接至pGBKT7,转化DH5α 感受态,通过含有卡那的LB 平板37 ℃培养过夜,菌落PCR 初步筛选后提取质粒,酶切鉴定正确后将阳性克隆进行测序分析。
1.3 弓形虫RH株酵母双杂交文库的构建 按照Clontech 公司提供的说明书进行弓形虫总RNA 的抽提,合成cDNA 第一条链,进行dsDNA 的扩增及纯化,之后进行文库构建。
1.4 重组诱饵蛋白毒性及自激活检测 根据MatchmakerTMGold Yeast Two-Hybrid System 说明书方法制备及转化酵母感受态细胞。将诱饵质粒pGBKT7-AMA1c 以及作为阳性对照的共转质粒pGBKT7-53 和pGADT7-T,分别转化酵母感受态细胞,涂 于SD/-Trp,SD/-Trp/X-α-Gal,SD/-Trp/X-α-Gal/AbA 固体培养基,30 ℃培养3 d~5 d,验证诱饵蛋白的毒性及自激活活性。
1.5 酵母双杂交 筛选相互作用蛋白挑取白色单菌落活化,按照酵母双杂交系统说明书方法,加入弓形虫RH 株文库进行杂交。20 h~24 h 后,1 000 r/min 离心收集菌体,8 mL 0.5×YPDA 重悬菌体,取200 μL 涂布于SD/Leu-Trp-His-Ade(SD/4)固体培养基,30 ℃培养3 d~5 d,获得的白色菌落进一步在SD/4/X-α-Gal/AbA 平板上划线培养筛选,产生的蓝色菌落即为阳性克隆。PCR 鉴定并测序分析。
1.6 共转化验证 筛选的阳性克隆根据测序比对结果提取重组阳性质粒,转化至大肠杆菌DH5α,纯化捕获重组质粒。将其与pGBKT7-AMA1c 共转化至酵母感受态中,同时设pGBKT7-53 和pGADT7-T为阳性对照,pGBKT7-λ 和pGADT7-T 为阴性对照,pGBKT7 和pGADT7 为空白对照。
1.7 筛选蛋白分析 在ToxoDB 数据库中检索目的蛋白,应用BLAST 进行GO 分析。
2 结果
2.1 弓形虫RH株酵母文库构建及滴度的检测 电泳鉴定结果表明,制备的双链cDNA 大多集中在500 bp~2 000 bp,滴度为4.26×107cfu/mL。应用pGBKT7-AMA1c 筛选得到的阳性克隆经PCR 鉴定,得到的片段大小集中在500 bp~2 000 bp(图1)。
2.2 AMA1c互作蛋白的回转验证 经培养观察,显示诱饵质粒pGBKT7-AMA1c 无毒性,并且无自激活作用。根据酵母双杂交系统筛选得到约300 个阳性候选菌落,根据PCR 鉴定结果及测序分析,经BLAST 比对后显示有13 个与AMA1c 相互作用的虫体蛋白(图2)。
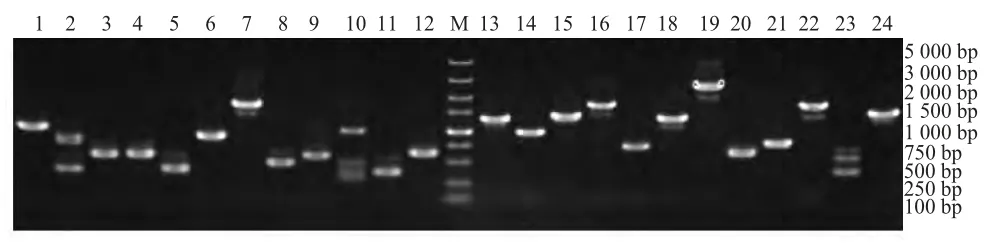
图1 AMA1c 筛选的阳性克隆PCR 鉴定结果(部分)Fig.1 Identification of the positive clones by PCR(Partial)

图2 AMA1c 相互作用蛋白的回转验证Fig.2 Identification of the AMA1c-interacting celluar proteins by co-transformation
2.3 筛选蛋白分析 根据ToxoDB 数据库的分析结果表明,筛选得到的13 个蛋白中有6 个假定蛋白,一个ATP 依赖性RNA 解旋酶,一个6 磷酸葡萄糖脱氢酶,一个驱动蛋白,一个磷酸二酯酶,一个环脂蛋白,一个tRNA 假尿嘧啶合酶D,一个SDS 域蛋白(表1)。

表1 与AMA1c 相互作用蛋白的GO 分析Table 1 AMA1c-interacting proteins with GO analysis
3 讨论
在弓形虫入侵宿主细胞过程中,AMA1 被分泌至虫体表面,胞外区域水解切割并脱落,而AMA1c留在虫体内[12]。AMA1c 具体功能还不明确,本研究应用酵母双杂交技术筛选与AMA1c 相互作用的蛋白,进行AMA1c 功能的研究。
本实验将诱饵重组质粒转化至酵母菌株Y2H中,经表型筛选法检测,结果表明,pGBKT7-AMA1c 无毒性及自激活活性。本研究根据酵母双杂交系统,从构建的弓形虫RH 株文库中筛选获得13个与AMA1c 相互作用的蛋白,表明本研究构建的酵母表达文库具有较高的质量。将筛选获得的13 个蛋白进行GO 分析,结果显示,其中蛋白1 和222均为发育调控基因,Cleary 等使用弓形虫cDNA 微阵列研究表明蛋白1 和222 均参与弓形虫缓殖子与速殖子之间转录水平的变化[13];蛋白243 则与寄生虫的生长发育相关[14],其与AMA1c 的相互作用可能影响寄生虫蛋白合成下调和干扰同源信使的表达;蛋白161 为磷酸二酯酶,主要参与水解细胞内的第二信使,目前成为抗原虫药物开发很有吸引力的作用靶点[15]。AMA1c 与这些蛋白的相互作用为进一步研究AMA1c 的功能奠定了基础。
[1]Echeverria P C,Matrajt M,Harb O S,et al.Toxoplasma gondii Hsp90 is a potential drug target whose expression and subcellular localization are developmentally regulated[J].J Mol Biol,2005,350(4):723-734.
[2]Ramos J M,Milla A,Rodríguez J C,et al.Seroprevalence of Toxoplasma gondii in fection among immigrant and native pregnant women in Eastern Spain[J].Parasitol Res,2011,109(5):1447-1452.
[3]汪明.人畜共患寄生虫病危害与公共卫生意义(中)[J].动物保健,2006,109(9):22-25.
[4]Gaffar F R,Yatsuda A P,Franssen F F,et al.Erythrocyte invasion by Babesiabovis merozoites is inhibited by polyclonal antisera directed against peptides derived from a homologue of Plasmodium falciparum apical membrane antigen 1[J].InfectImmun,2004,72(5):2947-2955.
[5]Triglia T,Healer J,Caruana S R,et al.Apical membrane antigen 1 plays a central role in erythrocyte invasion by Plasmodium species[J].Mol Microbiol,2000,38(4):706-718.
[6]Kato K,Mayer D C G,Singh S,et al.Domain III of Plasmodium falciparum apical membrane antigen 1 binds to the erythrocyte membrane protein Kx[J].Proc Natl Acad Sci U S A,2005,102(15):5552-5557.
[7]Di Cristina M,Spaccapelo R,Soldati D,et al.Two conserved amino acid motifs mediate protein targeting to the micronemes of the apicomplexan parasite Toxoplasma gondii[J].Mol Cell Biol,2000,20(19):7332-7341.
[8]Sheiner L,Santos J M,Klages N,et al.Toxoplasma gondii transmembranemicroneme proteins and their modular design[J].Mol Microbiol,2010,10(1111):1365-2958.
[9]Santos J M,Ferguson D J P,Blackman M J,et al.Intramembrane cleavage of AMA1 triggers Toxoplasma to switch from an invasive to a replicative mode[J].Science,2011,331(6016):473-477.
[10]Buguliskis J S,Brossier F,Shuman J,et al.Rhomboid 4(ROM4)affects the processing of surface adhesins and facilitates host cell invasion by Toxoplasma gondii[J].PLoS Pathog,2010,6(4):e1000858.
[11]廖亚金,李素,贺番,等.猪外周血单个核细胞cDNA 酵母表达文库的构建及与猪瘟病毒E2 蛋白相互作用细胞蛋白的筛选[J].中国预防兽医学报,2013,35(9):707-710.
[12]Howell S A,Fleck S L,Kettleborough C,et al.A single malaria merozoite serine protease mediates shedding of multiple surface proteins by juxtamembrane cleavage[J].J Biol Chem,2003,278(26):23890-23898.
[13]Cleary M D,Singh U,Blader I J,et al.Toxoplasma gondii asexual development:identification of developmentally regulated genes and distinct patterns of gene expression[J].Eukaryot Cell,2002,1(3):329-340.
[14]Pradhan A,Tuteja R.Bipolar,dual plasmodium falciparum helicase 45 expressed in the intraerythrocytic developmental cycle is required for parasite growth[J].J Mol Biol,2007,373(2):268-281.
[15]Seebeck T,Sterk G J,Ke H.Phosphodiesterase inhibitors as a new generation of antiprotozoan drugs:exploiting the benefit of enzymes that are highly conserved between host and parasite[J].Future Med Chem,2011,3(10):1289-1306.
