稳定表达绵羊肺腺瘤病毒受体Hyal-2蛋白细胞系的建立
2014-03-08于立新么宏强周建华马学恩
刘 畅,李 磊,于立新,么宏强,周建华,马学恩*
(1.内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018;2.农业部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特 010018;3.中国农业科学院 哈尔滨兽医研究所,黑龙江 哈尔滨 150001)
绵羊肺腺瘤(Ovine pulmonary adenomatosis,OPA)是由绵羊肺腺瘤反转录病毒(Jaagsiekte retrovirus,JSRV)引起的一种慢性、进行性及接触传染性的肺脏肿瘤性疾病。JSRV 受体为透明质酸酶-2(hyaluronoglucosaminidase 2,Hyal-2)[1],是JSRV 进入细胞时所需的受体,当JSRV 感染肺上皮细胞时,与其受体相结合,JSRV 会在肺上皮细胞内高度增殖,可以引发OPA 的发生。Hyal-2 是一种糖基磷脂酰肌醇键(GPI)锚定蛋白,其以锚定形式存在于细胞表面,并且在培养的细胞中表现出较低透明质酸酶活性。其不仅局限于肺上皮细胞膜上,也存在于多种细胞的质膜上[1-2],因此Hyal-2 受体并不是JSRV感染的唯一决定性因素[2-4]。有研究表明,Hyal-2 不仅可以作为JSRV 及地方鼻肿瘤病毒的受体,而且还是内源性JSRV 的受体[5]。NIH 3T3 小鼠成纤维细胞具有强烈的接触抑制作用,所以能够明确地识别已发生转化的细胞,可以应用于JSRV 致瘤机制的研究。
本研究通过构建含有绵羊Hyal-2 基因的真核重组表达质粒pcDNA-Hyal2-HA,转染NIH 3T3 细胞,建立了稳定表达Hyal-2 的NIH 3T3 细胞系,为进一步研究JSRV 与其受体的相互作用机制奠定了基础。
1 材料和方法
1.1 主要实验材料 NIH 3T3 细胞由中国农业科学院哈尔滨兽医研究所提供;含有JSRV env 基因的真核表达重组质粒pcDNA3.1-env 由本实验室构建并保存。pcDNA3.1(+)真核表达载体购自Invitrogen 公司;E.coli DH5α 感受态细胞购自天根生化科技(北京)有限公司。
1.2 主要试剂和工具酶 Hin d Ⅲ、XbaⅠ、pMD18-T、T4 DNA Ligase、SYBR®Premix Ex TaqTM、CellAmp®Direct RNA Prep Kit for Real-time RT-PCR 等购自TaKaRa 公司;PmlⅠ购自NEB 公司;脂质体转染试剂Lipofectamine 2000 购自Invitrogen 公司;G418 购自Gibco 公司;抗血细胞凝集素(HA)单克隆抗体(MAb)购自Cell Signaling 公司;辣根过氧化物酶标记的羊抗小鼠IgG(IgG-HRP)、山羊抗小鼠IgGFITC、超敏发光试剂购自上海碧云天生物技术有限公司;cDNA 合成试剂盒、质粒提取试剂盒及胶回收纯化试剂盒等购自天根生化科技(北京)有限公司。
1.3 引物设计 根据GenBank 中登录的绵羊Hyal-2 mRNA 序列(NM_001009754)设计两对引物,将其分为互相重叠的两段。前一段引物为QHyal2-F:5'-CAAATGACACTGACTTCCTGCAG-3'和QHyal2-R:5'-GAACTCAAACTCATACTGCGCCT-3',扩增产物大小为583 bp。后一段引物为HHyal2-F:5'-ACCGG CTGGGCATGTATCCAC-3' 和HHyal2-R:5'-GCTGG GTGAGACCCTTACGA-3',扩增产物大小为1 195 bp。在目的片段全长中引入酶切位点及5' 末端融入HA标记,上游引物Hyal2-F:5'-CCAAGCTTCCTGCA GCCCCCAGCA-3'(Hin d Ⅲ),下游引物:Hyal2-R:5'-GCTCTAGATTAGGCGTAATCGGGCACGTCGTA GGGGTACGAAGTCCAGGTGAAG-3'(XbaⅠ),扩增产物大小为1 485 bp。
根据GenBank 中登录的绵羊及小鼠Hyal-2 基因序列,设计特异性强、能够区分二者的定量PCR 扩增引物。绵羊Hyal-2 基因特异性引物为JDHyal2-F:5'-GGTTTACCACCAGCAACG-3' 和JDHyal2-R:5'-G TAATCGGGCACGTCGTA-3',扩增产物大小为450 bp。内参基因β-actin 引物为actin-F:5'-CATCCGTAA AGACCTCTATGCCAAC-3' 和actin-R:5'-ATGGAG CCACCGATCCACA-3',扩增产物大小为170 bp。
1.4 重组表达质粒的构建及鉴定 以绵羊瘤胃组织提取的总RNA 反转录产物cDNA 为模板,利用引物QHyal2-F/QHyal2-R(退火温度:62 ℃)和HHyal2-F/HHyal2-R(退火温度:63.7 ℃),按常规方法进行PCR 反应,分段扩增目的片段QH 和HH,构建重组质粒pMD-QH 和pMD-HH。以Pml Ⅰ和XbaⅠ分别进行双酶切,将QH 片段克隆于pMDHH 中构建含有完整Hyla-2 基因的重组质粒pMDHyal2,并测序鉴定。
以pMD-Hyal2 为模板,Hyal2-F/Hyal2-R(退火温度:63.9 ℃)为引物,进行PCR 扩增。将扩增后含有融合HA 标记的目的基因进行纯化,克隆于pcDNA3.1(+)中构建含有融合HA 标签序列的真核重组表达质粒pcDNA-Hyal2-HA,并测序鉴定。
1.5 建立稳定表达Hyal2-HA的NIH 3T3细胞系
1.5.1 G418 工作浓度确定 采用终浓度为100 mg/L~900 mg/L G418 加入NIH 3T3 细胞单层中,于37 ℃5%CO2条件下培养,每3 d 换液一次,共培养15 d~20 d,观察NIH 3T3 细胞生长情况。以细胞完全死亡的G418 最小浓度为筛选的最佳工作浓度。
1.5.2 稳定表达Hyal2-HA 细胞系的建立 按转染试剂Lipofectamine 2000 说明书方法,将0.8 μg pcDNA-Hyal2-HA 重组质粒转染至90 %~95 %融合的单层NIH 3T3 细胞中,以转染pcDNA3.1(+)为对照。转染48 h 后,以最佳工作浓度G418 完全培养液进行筛选。筛选4 d 后,以有限稀释法传代于96 孔板中继续培养,7 d 后挑选含有1 个细胞集落的孔,相继在24 孔板、6 孔板和细胞培养瓶中扩大培养,以间接免疫荧光(IFA)方法检测Hyal2-HA 的表达情况。对阳性转染细胞克隆进行连续3 次克隆纯化,使其免疫荧光阳性率达90 %以上。阳性克隆以150 mg/L 的G418 扩增培养传代,并于液氮冻存。
1.6 稳定表达Hyal2-HA细胞系的鉴定
1.6.1 实时荧光定量PCR 检测 采用试剂盒提取稳定表达Hyal2-HA 细胞系的总RNA,以反转录的cDNA 为模板,利用特异性引物JDHyal2-F/JDHyal2-R(退火温度:57 ℃)和内参基因引物actin-F/actin-R(退火温度:57 ℃),按三步法进行实时荧光定量PCR 检测。以未转染的NIH 3T3 细胞cDNA 为阴性对照。
1.6.2 IFA 检测 将稳定表达Hyal2-HA 的细胞株以2×105个细胞/孔接种至24 孔板,同时以空载体转染的细胞为阴性对照;未做任何处理的NIH 3T3 细胞作为空白对照。以HA MAb(1∶100)为一抗,羊抗鼠IgG-FITC(1∶500)为二抗,进行IFA 检测。
1.6.3 Western blot 检测 收集表达Hyal2-HA 的细胞,经RIPA 细胞裂解液提取细胞总蛋白,经SDS-PAGE 分离后,转印至PVDF 膜上,以HA MAb(1∶1 000)为一抗,羊抗小鼠IgG-HRP(1∶1 000)为二抗,ECL 发光显影进行western blot 检测。
1.7 JSRV囊膜蛋白诱导转化NIH 3T3-Hyal2-HA细胞系 按转染试剂Lipofectamine 2000 说明书方法,将28 μg pcDNA3.1-env 质粒分别转染NIH 3T3细胞和NIH 3T3-Hyal2-HA 细胞系,并设转染空载体pcDNA3.1(+)作为阴性对照,仅转染试剂作为空白对照。转染约12 h 后,以PBS 漂洗细胞3 次,并为细胞更换完全培养基,随后每3 d 为细胞换液并在显微镜下观察其形态。
2 结果
2.1 重组质粒pcDNA-Hyal2-HA的构建 以绵羊瘤胃组织cDNA 为模板,分段扩增Hyal-2 基因。结果显示,扩增产物QH 约600 bp 和HH 约1 200 bp,与预期大小相符(图略),并将其克隆至pMD18-T 载体中得到重组质粒pMD-QH、pMD-HH。双酶切处理并连接,经鉴定得到含有目的基因Hyla-2 重组质粒pMD-Hyal2(图 略)。以 pMD-Hyal2 为模板,Hyal2-F/Hyal2-R 为引物进行PCR 扩增,得到融合有HA 标签的Hyal-2 基因,全长约为1 500 bp,与预期大小相符(图略)。将目的基因与pcDNA3.1(+)连接,构建重组质粒pcDNA-Hyal2-HA。阳性克隆进行核苷酸序列测定。结果显示,目的基因的读码框架和插入方向正确,与预期相符(图略)。
2.2 稳定表达Hyal2-HA细胞系的建立及鉴定 将重组质粒pcDNA-Hyal2-HA 转染NIH 3T3 细胞,以G418 最佳工作浓度300 mg/L 进行筛选。挑取G418抗性细胞克隆,经3 次有限稀释法纯化后,建立了稳定表达Hyal2-HA 细胞系NIH 3T3-Hyal2-HA。
提取NIH 3T3 细胞及第15 代的NIH 3T3-Hayl2-HA 细胞系总RNA,经反转录后进行三步法实时荧光定量PCR,以β-actin cDNA 作为内参进行相对定量,检测目的基因是否稳定高表达。结果显示,未转染的NIH 3T3 细胞未检测到绵羊Hyal-2 cDNA,而NIH 3T3-Hayl2-HA 细胞系检测到较高的绵羊Hyal-2 cDNA 表达量(图1)。
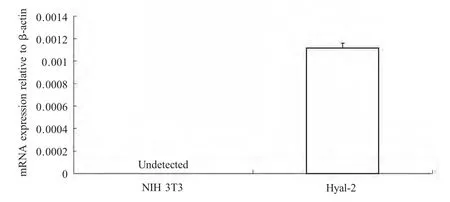
图1 实时荧光定量PCR 检测Hyal2-HA 在NIH 3T3-Hyal2-HA 中的表达Fig.1 Identification of Hyal2-HA protein expressed in NIH 3T3-Hyal2-HA cells by real-time PCR
将NIH 3T3-Hyal2-HA 细胞裂解后提取总蛋白,以抗HA MAb 进行western blot 检测。结果显示,在55 ku 处可见特异性条带,大小与预期相符,而未转染的NIH 3T3 细胞空白对照未见阳性反应条带(图2)。
以HA MAb 为一抗,羊抗鼠IgG-FITC 为二抗,分别对NIH 3T3-Hayl2-HA 细胞系和NIH 3T3 细胞进行IFA 检测,结果显示,NIH 3T3-Hayl2-HA 细胞转染后第一代即能呈现较强的绿色荧光,并且荧光主要集中于细胞膜上,在胞核及胞质中仅见微弱荧光,对照细胞则无荧光(图3A)。将该细胞克隆传代至15 代,其仍能够稳定表达Hyal2-HA 蛋白(图3B),而且阳性细胞率在可见范围内为100 %(图3C)。

图2 Western blot 检测Hyal2-HA 在NIH 3T3-Hyal2-HA 中的表达Fig.2 Identification of Hyal2-HA protein expressed in NIH 3T3-Hyal2-HA cells by western blot

图3 IFA 检测Hyal2-HA 在NIH 3T3 细胞中的表达Fig.3 Identification of Hyal2-HA expressed in NIH 3T3 cells by IFA
2.3 JSRV囊膜蛋白诱导转化NIH 3T3-Hyal2-HA细胞系 重组质粒pcDNA3.1-env 转染3 周后,在显微镜下分别观察NIH 3T3 细胞和NIH 3T3-Hyal2-HA细胞系的细胞形态。结果显示,JSRV 囊膜蛋白可以诱导NIH 3T3 细胞形成典型的转化聚积灶(图4A);而JSRV 囊膜蛋白对NIH 3T3-Hyal2-HA 细胞系无影响,并未使其形成转化聚积灶(图4B)。表明在NIH 3T3 细胞中,绵羊Hyal-2 蛋白抑制了JSRV囊膜蛋白的诱导转化作用。

图4 JSRV 囊膜蛋白诱导转化NIH 3T3 细胞及NIH 3T3-Hyal2-HA 细胞系Fig.4 Envelope protein of JSRV induced NIH 3T3 cells and NIH 3T3-Hyal2-HA cell line
3 讨论
近年来研究表明,在NIH 3T3 细胞中,JSRV囊膜蛋白(Env)与鼠Hyal-2 不结合,并且其不表达鼠源RON/Stk,过表达鼠Hyal-2 对JSRV Env 转化能力无影响[6];而在表达人Hyal-2 的NIH 3T3 细胞中,JSRV Env 的转化能力却受到了明显的抑制[7]。由此推断,在NIH 3T3 细胞中,不同种属来源的Hyal-2对JSRV Env 转化能力的影响存在差异。因此,只有在表达绵羊Hyal-2 的NIH 3T3 细胞中,才能更具体的了解绵羊Hyal-2 对JSRV Env 诱导转化能力的影响。
NIH 3T3 小鼠成纤维细胞自身表达鼠源Hyal-2,并且绵羊与小鼠Hyal-2 的氨基酸序列同源性较高,因此需要特异性较好、无种属间交叉免疫反应的MAb 才能够将二者在蛋白水平上加以区分。目前市场上商品化的主要是Hyal-2 多克隆抗体,不同种属间存在交叉免疫反应,不适用于区分不同种属来源的Hyal-2。本实验选取对目的蛋白功能影响较小,只有9 个氨基酸的HA 标签,融合表达于Hyal-2 的C 端,构建了含有绵羊Hyal-2 基因编码区全长的pcDNA-Hyal2-HA 真核表达重组质粒;利用该重组质粒建立了稳定表达JSRV 受体绵羊Hyal-2 的NIH 3T3 细胞系NIH 3T3-Hyal2-HA。并且证明,在该细胞系中,绵羊Hyal-2 蛋白抑制了JSRV 囊膜蛋白诱导转化NIH 3T3 细胞,这与人Hyal-2 蛋白的作用相同[7],但其具体的作用机制还需进一步研究。该细胞系的建立为进一步研究JSRV 与其受体的相互作用致瘤机制奠定了基础。
[1]Rai S K,Duh F M,Vigdorovich V,et al.Candidate tumor suppressor HYAL2 is a glycosylphosphatidylinositol(GPI)-anchored cell-surface receptor for jaagsiekte sheep retrovirus,the envelope protein of which mediates oncogenic transformation[J].Proc Natl Acad Sci U S A,2001,98:4443-4448.
[2]Miller A D.Hyaluronidase 2 and its intriguing role as a cell-entry receptor for oncogenic sheep retroviruses[C].Semin Cancer Biol,2008,18(4):296-301.
[3]Palmarini M,Datta S,Omid R,et al.The long terminal repeat of Jaagsiekte sheep retrovirus is preferentially active in differen-tiated epithelial cells of the lungs[J].J Virol,2000,74(13):5776-5787.
[4]McGee-Estrada K,Palmarini M,Fan H.HNF-3beta is a critical factor for the expression of the Jaagsiekte sheep retrovirus long terminal repeat in type II pneumocytes but not in Clara cells[J].Virology,2002,292(1):87-97.
[5]Dunlap K A,Palmarini M,Adelson D L,et al.Sheep endogenous betaretroviruses(enJSRVs)and the hyaluronidase 2(HYAL2)receptor in the ovine uterus and conceptus[J].Biol Reprod,2005,73(2):271-279.
[6]Miller A D,Van Hoeven N S,Liu S L.Transformation and scattering activities of the receptor tyrosine kinase RON/Stk in rodent fibroblasts and lack of regulation by the jaagsiekte sheep retrovirus receptor,Hyal2[J].BMC Cancer,2004,4:64.
[7]Liu Shan-lu,Duh F M,Lerman M I,et al.Role of virus receptor Hyal2 in oncogenic transformation of rodent fibroblasts by sheep betaretrovirus env proteins[J].J Virol,2003,77:2850-2858.
