马传染性贫血病毒弱毒疫苗gp90多样性及其对病毒体外增殖的影响
2014-03-08秦玉寅王雪峰韦华冕林跃智王晓钧周建华胡建军
秦玉寅,王雪峰,韦华冕,王 帅,林跃智,杜 承,王晓钧,周建华*,胡建军
(1.塔里木大学生命科学学院 塔里木盆地生物资源保护利用省部共建重点实验室,新疆 阿拉尔 843300;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150001;3.塔里木大学动物科学学院兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300)
马传染性贫血病毒(Equine infectious anemia virus,EIAV)弱毒疫苗是首例慢病毒弱毒疫苗,该疫苗可以抵抗同源或异源致病性病毒株的攻击[1]。前期研究显示,EIAV 弱毒疫苗株经过减毒后病毒基因组发生了多位点、多形态和高频度的变异[2-4]。弱毒疫苗在基因构成上,特别是gp90 基因处于一种复杂的基因构成状态,是一个由在基因水平上与亲本强毒存在明显差异,同时个体间也存在一定差异的多种疫苗株个体构成的准种混合体[5-7]。初步体内和体外试验数据显示,准种状态的弱毒疫苗诱导产生的免疫保护要明显优于基于单一疫苗株基因构建的感染性克隆病毒株[5]。为进一步验证EIAV 弱毒疫苗的基因组及免疫原多态性是疫苗诱导免疫保护的关键因素,需要构建一系列不同gp90 基因的弱毒疫苗株感染性克隆,通过比较单一感染性克隆衍生病毒与多种感染性克隆衍生病毒混合免疫马匹后诱导免疫保护效果差异,进而验证EIAV 弱毒疫苗gp90多样性与免疫保护的关系。
本研究从EIAV 驴胎皮肤(FDD)细胞弱毒疫苗(EIAVFDDV13)中扩增了与感染性克隆pLGFD3-8(来源于EIAVFDDV13)存在4.8 %差异的gp90 基因,并将其替换pLGFD3-8 中的gp90 基因,构建了感染性克隆pLGFD13-15,并拯救出衍生病毒。两种衍生病毒的比较对EIAV 致弱机制和免疫诱导机理的研究具有一定的意义。
1 材料和方法
1.1 病毒株、载体、细胞 FDD 细胞、马单核细胞来源的巨噬细胞(eMDM)、EIAVFDDV13、EIAV 感染性克隆质粒pLGFD3-8 均由中国农业科学院哈尔滨兽医研究所慢病毒研究组提供。
1.2 主要试剂 LipofectamineTM2000、M-MLV 购自Invitrogen 公司;反转录酶活性检测试剂盒购自Roche 公司;Taq DNA 聚合酶、T4 DNA 连接酶、限制性内切酶等购自TaKaRa 公司;Plasmid Mini KitⅠ购自OMEGA 公司;蛋白质分子量标准购自Fermentas 公司;抗p26 单克隆抗体(MAb)由本实验制备并保存;DyLight 800 标记羊抗鼠的IgG 购自SIGMA 公司。
1.3 引物设计 利用DNAStar、Mega5.0 等软件对获得的gp90 核苷酸及推导的氨基酸序列进行分析,以感染性克隆pLGFD3-8(GU385361)为参考序列设计引物(表1)。引物由Invitrogen 公司合成。
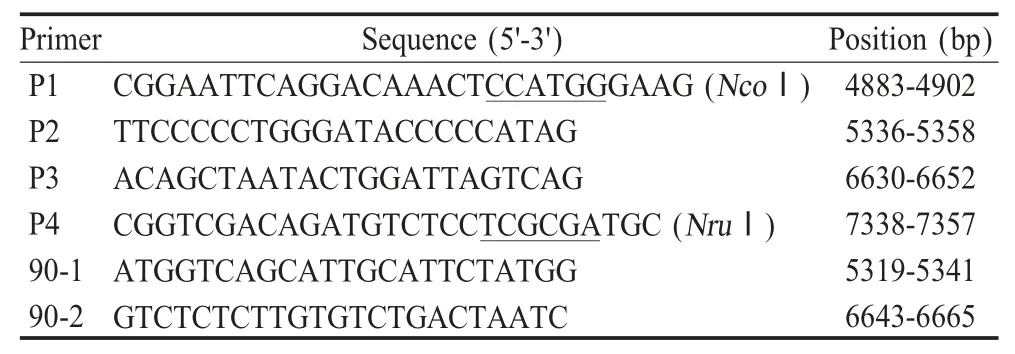
表1 构建感染性克隆所用引物Table 1 Primers designed for construction of infectious clone
1.4 病毒RNA提取与gp90基因扩增 按Qiamp Viral RNA Mini Kit 说明书方法提取病毒RNA,反转录合成cDNA。以cDNA 为模板,利用引物90-1/90-2 扩增完整gp90 基因。反应条件:95 ℃5 min;94 ℃30 s、52 ℃30 s、72 ℃90 s,35 个循环;72 ℃10 min。回收目的片段,并克隆于pMD18-T 载体中,由Invitrogen 公司进行测序。
1.5 感染性克隆pLGFD3-8中gp90基因的替换以pLGFD3-8 为模板,利用引物P1/P2 扩增P1P2 片段,以P3/P4 为引物扩增P3P4 片段,P1P2 片段与gp90 克隆(F13-15)进行融合PCR 扩增P1-90 片段,将P1-90 与P3P4 片段再进行融合PCR 扩增P1P4 片段,利用NcoⅠ和NruⅠ酶切P1P4 片段后替换到pLGFD3-8 构建感染性克隆pLGFD13-15。经PCR 鉴定后,阳性克隆进行测序。
1.6 p LGFD13-15的转染和传代 按照LipofectamineTM2000 说明书操作方法将pLGFD13-15 转染80 %~90 %的FDD 细胞中,5 d 后取细胞上清液接种单层FDD 细胞。8 d~10 d 收获病毒液,-70 ℃冻存。取病毒液接种FDD 细胞,37 ℃培养8 d~10 d,冻融细胞培养物两次,离心收取病毒液。病毒在FDD 细胞盲传3 代获得衍生病毒vpLGFD13-15。
1.7 Western blot检测细胞和病毒颗粒蛋白 将vpLGFD13-15 感染的细胞和上清液超速离心(20 000 g,2 h)后,分别以p26 MAb(1∶10 000)为一抗,DyLight 800 标记羊抗鼠IgG(1∶10 000)为二抗,采用ODYSSEY 激光扫描成像系统扫描成像,进行western blot 检测目的蛋白的表达。以感染性克隆pLGFD3-8 衍生病毒作为阳性对照[5]。
1.8 培养物中病毒粒子的电镜观察 在病毒感染FDD 细胞后,37 ℃培养至细胞出现明显细胞病变(CPE)时收取细胞制备电镜切片,利用透射电镜进行观察。
1.9 病毒体外复制动力学分析 取等量的vpLGFD3-8和vpLGFD13-15 接种到铺有FDD 细胞和eMDM 的96 孔细胞培养板中,37 ℃孵育1 h 后弃去病毒液,PBS 洗涤2 次,加入细胞维持液200 μL。每隔24 h分别收取试验组和对照组3 个孔的细胞培养上清液,于-80 ℃保存。重复3 次,采用反转录酶活性检测试剂盒测定病毒TCID50[5]。
2 结果
2.1 EIAVFDDV13的gp90基因多样性比较 通过RT-PCR 扩增EIAVFDDV13完整的gp90 基因,经克隆后随机选取15 个阳性克隆用于测序和分析。以pLGFD3-8 的gp90 序列作为参考序列进行系统进化分析(图1),对各序列推导氨基酸差异率分析表明,不同克隆间的平均差异是2.7 %(0~5.8 %),变异主要集中在已鉴定的主要变异区[1],其中有2 个克隆在V8 区缺失了3 个氨基酸,这些变异引起部分克隆在V5、V6 和V8 区糖基化位点发生改变。其中克隆F13-15 与感染性克隆pLGFD3-8 的gp90 差异率为4.8 %,二者之间存在21 个在变位点,这些位点集中在V3-V7 区,F13-15 在V5 区的244 位点丢失了糖基化位点,而在位于V6 区的278 位点新增了一个糖基化位点(图2)。本研究将选择F13-15 克隆替换到pLGFD3-8,构建不同的gp90 感染性克隆。
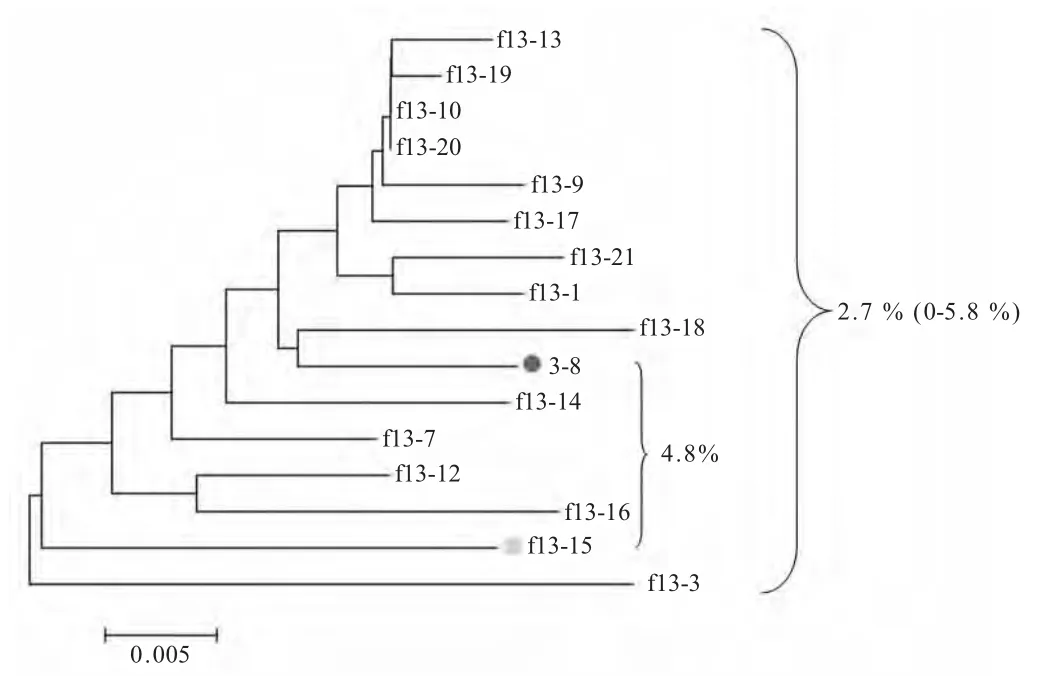
图1 基于EIAVFDDV13不同病毒株gp90 基因推导氨基酸绘制的系统进化树Fig.1 Polygenetic analysis of gp90 amino acid sequences from different clones of EIAVFDDV13
2.2 感染性克隆pLGFD13-15的构建 通过PCR扩增pLGFD3-8 的P1P2 片段、P3P4 片段和F13-15的gp90 片段,利用融合PCR 的方法获得P1P4 片段。利用NcoⅠ和NruⅠ将感染性克隆pLGFD3-8 的gp90 片段替换为 F13-15,获得感染性克隆pLGFD13-15,测序结果与预期相符。
2.3 Western blot检测vp LGFD13-15病毒蛋白将pLGFD13-15 转染FDD 后盲传3 代,利用获得的第3 代vpLGFD13-15 感染FDD 细胞,37 ℃培养8 d后分别收获细胞和上清液。以vpLGFD3-8 作为阳性对照。Western blot 分析显示,在感染的细胞及上清液中均能够检测到病毒蛋白p26 特异性条带(图3)。
2.4 病毒粒子的电镜观察 衍生病毒vpLGFD13-15转染FDD 细胞后,取上清液在FDD 细胞中盲传3代,透射电镜观察到大量球状病毒颗粒,具有锥形核心,为典型的EIAV 粒子(图4),表明vpLGFD13-15 对FDD 细胞具有感染性,可以在FDD 细胞良好的增殖。
2.5 病毒复制动力学测定 以相同病毒含量的细胞培养上清液分别接种FDD 细胞和eMDM,比较vpLGFD3-8 和vpLGFD13-15 在不同细胞中的复制能力的差异。结果表明,与vpLGFD3-8 相比,vpLGFD13-15 在FDD 细胞中能够更快速的复制,在接种病毒后2 d~4 d 内,其细胞培养上清中病毒含量明显高于vpLGFD3-8;但在培养后期,vpLGFD3-8的含量明显上升,而vpLGFD13-15 的含量却趋于平稳。两种病毒在eMDM 中的复制呈现出不同的趋势:相比vpLGFD3-8,vpLGFD13-15 在eMDM 中的复制明显迟缓(图5)。

图2 EIAVFDDV13gp90 推导氨基酸序列比较Fig.2 Comparison of gp90 deduced amino acid sequences between pLGFD13-15 and pLGFD3-8
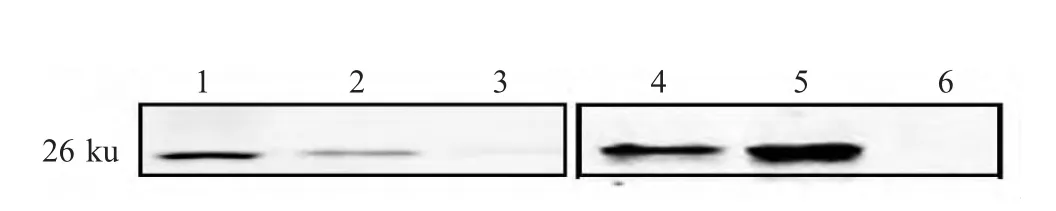
图3 衍生病毒感染细胞及上清液超离产物的western blot 结果Fig.3 Western blot analysis of virus infected cell precipitate and the culture supernatant
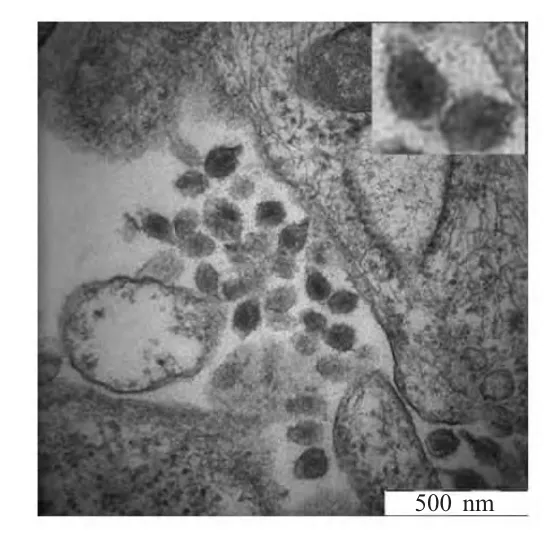
图4 衍生病毒感染FDD 细胞的电镜观察Fig.4 Electron micrograph of EIAV derived from vpLGFD13-15 in FDD cell
3 讨论

图5 病毒复制动力学曲线Fig.5 Replication of vpLGFD3-8 and vpLGFD13-15 in cells of FDD and eMDM
EIAV 疫苗经过体外长期无宿主特异性免疫压力下的传代培养,病毒基因组积累了大量的变异[2]。对EIAVFDDV13的测序结果表明,EIAV 弱毒疫苗并非由相对单一的病毒种群构成,而是一个能够形成多个分支,具有准种特性的病毒种群[3]。gp90 不仅是EIAV 的主要变异区域,也是病毒最重要的免疫原,其包含丰富的免疫识别表位(包括3 个主要中和表位和9 个高活性的Th 表位等)[8-10]。本研究对EIAVFDDV13完整gp90 基因扩增后随机挑选15 个克隆进行测序,序列分析显示,不同克隆间的差异在0~5.8 %,变异主要集中的已鉴定的高变区域,有的变异引起糖基化位点的改变。体内试验表明,基于单一克隆构成的疫苗株衍生病毒株vpLGFD3-8 对马匹的免疫效果要明显弱于亲本疫苗株EIAVFDDV13[2]。表明中国EIAV 弱毒疫苗的这种“多克隆构成”与其诱导良好的免疫保护有着重要的相关性。将构建的含有不同gp90 变异体的弱毒疫苗感染性克隆,通过比较单一感染性克隆和多个感染性克隆病毒组合对马匹的免疫保护效果,进一步验证上述的假设是否成立。
本研究将来源于EIAVFDDV13的gp90 变异体替换到感染性克隆pLGFD3-8,构建了嵌合感染性克隆pLGFD13-15。pLGFD13-15 与pLGFD3-8 在gp90 的差异是4.8 %,有21 个氨基酸位点的变异和2 个糖基化位点的改变。比较二者的衍生病毒在FDD 细胞和eMDM 细胞中的复制情况显示,vpLGFD13-15 在FDD 细胞的复制能力要明显优于vpLGFD3-8,而在eMDM 细胞中却表现出了相反的情况,表明EIAV囊膜蛋白的差异与病毒对不同靶细胞的感染或复制能力相关。结果表明EIAVFDDV13中含有不同gp90 基因的病毒在体外生物学特性存在差异,而这些生物学差异可能是EIAV 准种构成的特点之一。但要研究这两株病毒在诱导免疫应答反应特点及其差异性,还需进行体内试验。本研究为进一步研究EIAV 弱毒疫苗基因多样性的生物学意义提供了一株重要的感染性克隆。
[1]Wang Xue-feng,Wang Shuai,Lin Yue-zhi,et al.Unique evolution characteristics of the envelope protein of EIAV(LN40),a virulent strain of equine infectious anemia virus[J].Virus Genes,2011,42(2):220-228.
[2]Qi Xu,Wang Xue-feng,Wang Shuai,et al.Genomic analysis of an effective lentiviral vaccine-attenuated equine infectious anemia virus vaccine EIAVFDDV13[J].Virus Genes,2010,41(1):86-98.
[3]王雪峰,姜成刚,郭巍,等.马传染性贫血病毒白细胞弱毒疫苗株及其亲本毒驴强毒株前病毒基因组比较分析[J].病毒学报,2008(06):443-449.
[4]Wang Xue-feng,Wang Shuai,Lin Yue-zhi,et al.Genomic comparison between attenuated Chinese equine infectious anemia virus vaccine strains and their parental virulent strains[J].Arch Virol,2010,156(2):353-357.
[5]Ma Jian,Shi Na,Jiang Cheng-gang,et al.A proviral derivative from a reference attenuated EIAV vaccine strain failed to elicit protective immunity[J].Virology,2011,410(1):96-106.
[6]Ma Jian,Jiang Cheng-gang,Lin Yue-zhi,et al.In vivo evolution of the gp90 gene and consistently low plasma viral load during transient immune suppression demonstrate the safety of an attenuated equine infectious anemia virus(EIAV)vaccine[J].Arch Virol,2009,154(5):867-873.
[7]王雪峰,王帅,韩秀娥,等.马传染性贫血弱毒疫苗株致弱过程中表面蛋白gp90 的进化分析[J].中国预防兽医学报,2011,33(2):93-96.
[8]Ball J M,Rushlow K E,Issel C J,et al.Detailed mapping of the antigenicity of the surface unit glycoprotein of equine infectious anemia virus by using synthetic peptide strategies[J].J Virol,1992,66(2):732-742.
[9]Tagmyer T L,Craigo J K,Cook S J,et al.Envelope-specific T-helper and cytotoxic T-lymphocyte responses associated with protective immunity to equine infectious anemia virus[J].J Gen Virol,2007,88(4):1324-1336.
