急性缺血性卒中患者血尿酸水平与脑白质病变的相关性研究
2014-03-08杨得奖谭彧刘兴媛陈小红邓幼清
杨得奖,谭彧,刘兴媛,陈小红,邓幼清
脑白质病变(white matter lesions,WMLs)是由加拿大神经病学家Hachinski于1987年首先提出的影像学概念,为脑室旁和(或)半卵圆中心的斑片或弥散状计算机断层扫描(computed tomography,CT)低密度、磁共振成像(magnetic resonance imaging,MRI)T2加权像及液体衰减反转恢复序列(fluidattenuated inversion recovery,FLAIR)高信号病灶[1]。脑梗死患者常伴发WMLs,其发生不仅与脑梗死初发、复发显著相关,还是患者预后不良的重要危险因素[2]。目前,WMLs发病机制尚不清楚,有研究提示高尿酸血症与老年男性WMLs独立相关[3],但在急性缺血性卒中患者中尚未见类似研究。本研究采用Ylikoski量表[4]对WMLs进行评估,探讨急性缺血性卒中患者血尿酸水平与WMLs的相关性。
1 对象与方法
1.1 研究对象 本研究为横断面研究。连续入选2011年1月~2012年12月南昌市第一医院神经内科住院发病48 h内的首发缺血性卒中患者。研究方案经南昌市第一医院伦理委员会批准,所有患者在参与研究之前均给予告知并签署知情同意书。
1.1.1 入选标准 年龄、性别不限;缺血性卒中首次发作;发病48 h内入院;符合全国第4届脑血管病学术会议制定的缺血性卒中诊断标准[5];经头颅MRI检查证实。
1.1.2 排除标准 近期有食用海鲜等高嘌呤食物(每100 g食物含嘌呤100~1000 mg)者;合并急性感染、风湿结缔组织疾病、免疫性疾病、痴呆、恶性肿瘤、血液病的患者;有严重肝肾功能损害的患者。
1.2 方法
1.2.1 MRI检查 所有患者均接受头颅MRI检查(Siemens Trio System,3.0T),包括轴位T1加权[重复时间(time of repetition,TR)/回波时间(time of echo,TE),400~500 ms/8.9~14 ms]、轴位T2加权(TR/TE,4000~6000 ms/100~120 ms)和冠状位FLAIR成像(TR/TE,8000~9000 ms/90~112 ms),矩阵256×256,视野220 mm,层厚6.0 mm,层距0.6 mm。采用Ylikoski量表(0~48分)对WMLs进行半定量分析,将脑室旁和深部白质分开,按双侧大脑半球额角、侧脑室体、三角区和枕角4个区域分别评分。脑室旁白质高信号(0~24分):0分-无高信号;1分-点状,小灶(轻微);2分-帽状,铅笔样薄层(中度);3分-结节样带,延伸(严重)。半卵圆中心高信号,包括分水岭区(0~24分):0分-无高信号;1分-点状、小的高信号病灶;2分-点状高信号开始融合;3分-高信号融合区的范围较大。将脑室旁白质分数和半卵圆中心高信号分数相加计算总分[4,6]。脑白质评分由2位经过培训的影像科医生采用盲法进行,取两者评分的平均值,若两者评分相差≥4分则进行会议协商,以所有入选患者Ylikoski评分中位数为界点,将Ylikoski评分在界点以上的定义为重度WMLs组,将Ylikoski评分在界点及界点以下的定义为无或轻度WMLs组[7]。
1.2.2 血生化指标检查 所有患者均于入院后次日清晨采集空腹静脉血8 ml,分离上清液,采用日立7020全自动生化分析仪检测血糖、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白-胆固醇(low density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白-胆固醇(high density lipoprotein-cholesterol,HDL-C)、尿酸水平。
1.2.3 诊断标准 高血压定义为在未服降压药物情况下收缩压≥140 mmHg,和(或)舒张压≥90 mmHg[8];或既往有高血压病史者入院时正在服药。糖尿病定义为空腹血糖水平≥7.0 mmol/L[9];糖化血红蛋白水平>6.5%[10];或既往有糖尿病史,目前正在使用胰岛素或降糖药。吸烟史定义为既往吸烟≥3支/天,持续>1年[11]。以男性>420 μmol/L,女性>357 μmol/L为高尿酸血症判断标准[12]。
1.2.4 统计学方法 采用SPSS 20.0软件进行统计学分析,计量资料用s表示,组间比较采用独立样本t检验;计数资料用百分比表示,组间比较采用χ2检验;危险因素分析采用多因素Logistic回归分析,并计算比值比(odds ratio,OR)和95%可信区间(confidence interval,CI),P<0.05为差异有显著性。
2 结果
2.1 两组患者基线资料比较 共入选急性缺血性卒中患者321例,其中男183例,女138例,年龄(66.7±12.9)岁。按照Ylikoski评分标准(中位数为20,四分位数间距为16~30),将患者分为重度WMLs组159例,无或轻度WMLs组162例。重度WMLs组患者年龄、糖尿病发生率及血糖水平均高于无或轻度WMLs组,差异有显著性,两组性别、高血压发生率、收缩压、舒张压、心房颤动发生率、血TG、TC、LDL-C、HDL-C水平及吸烟史比例无显著差异(表1)。
2.2 两组患者血尿酸水平及高尿酸血症发生率比较 重度WMLs组血尿酸水平高于无或轻度WMLs组,高尿酸血症发生率亦高于无或轻度WMLs组(表2),差异均有显著性。
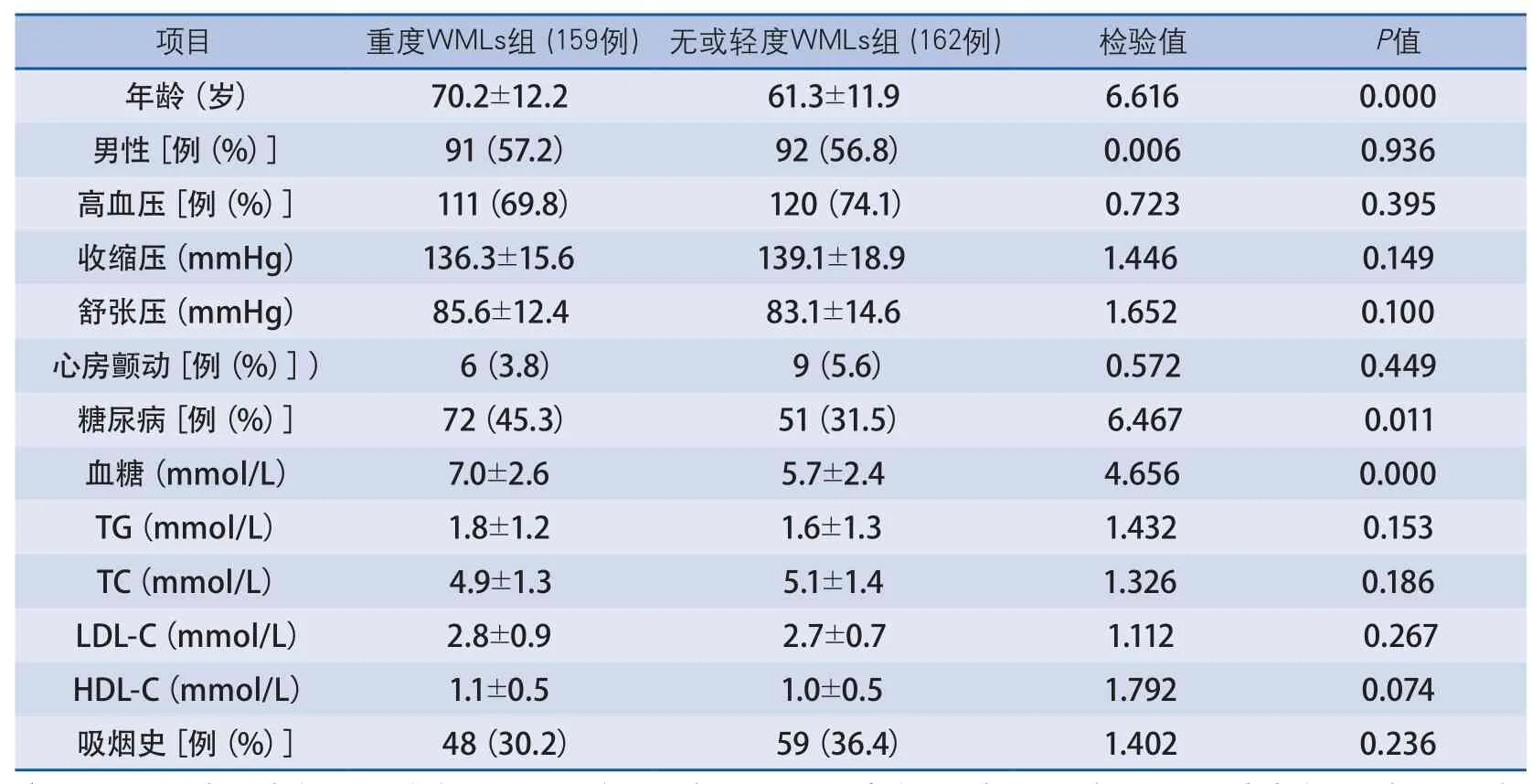
表1 两组患者基线资料比较
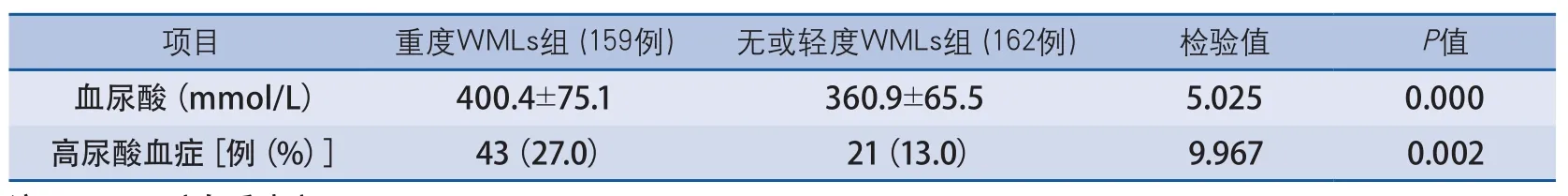
表2 两组患者血尿酸水平及高尿酸血症发生率比较
2.3 重度WMLs危险因素分析 以年龄、性别、是否伴发高血压、收缩压、舒张压、是否伴发心房颤动、是否伴发糖尿病、血糖、血TG、TC、LDL-C、HDL-C水平、有无吸烟史、血尿酸水平及是否高尿酸血症为自变量,WMLs为因变量,进行多因素Logistic回归分析。结果表明,年龄(OR 1.062,95%CI 1.0008~1.119,P=0.023)、血尿酸水平(OR 1.531,95%CI 1.186~1.975,P=0.001)和高尿酸血症(OR 1.131,95%CI 1.047~1.222,P=0.002)是急性缺血性卒中患者发生重度WMLs的独立危险因素(表3)。
3 讨论
本研究发现,急性缺血性卒中患者中重度WMLs者血尿酸水平、高尿酸血症发生率均高于无或轻度WMLs者,经校正年龄、性别、血压、伴发高血压、糖尿病、心房颤动、血糖、血脂及吸烟史等因素后,血尿酸水平和高尿酸血症是急性缺血性卒中患者发生重度WMLs的独立危险因素。
尿酸是机体内嘌呤代谢的最终产物,人体内的尿酸大部分经肾脏排泄,其余则通过消化道清除,血尿酸水平取决于尿酸的产生和排泄之间的动态平衡。嘌呤代谢紊乱、能量代谢异常及肾脏对尿酸的排泄障碍均可引起血液中尿酸水平升高[12]。Lehto等[13]发现高尿酸血症是急性脑血管病的独立危险因素,高尿酸水平是卒中预后不良及卒中后脑血管事件再发的独立预测因子[14]。最近一项大样本研究表明,高尿酸血症可增加卒中患者的死亡率[15]。高尿酸血症与肥胖、高血压、糖尿病、高脂血症、胰岛素抵抗及动脉粥样硬化相关,并通过与这些危险因素相互作用或独立参与脑血管疾病的发生发展及转归[16]。
WMLs与卒中发生、卒中复发、缺血性卒中抗凝或溶栓治疗后出血、死亡相关。一项随访7年的大样本社区人群MRI研究表明,卒中发生风险与WMLs程度呈正相关,严重的WMLs是独立于传统危险因素之外的又一卒中危险因素[17]。随着WMLs发生及进展,卒中发生风险明显增加[18-19]。WMLs数目与颈动脉易损斑块相关,而后者是脑栓塞的危险因素[20]。Henon等[21]在一项随访3年的研究中发现,WMLs与卒中再发显著相关,它可作为卒中复发的独立预测因子。伴发WMLs的缺血性卒中患者接受抗凝或溶栓治疗后更容易发生脑出血,他们死于卒中的风险大约是对照组的3倍,提示WMLs是老年患者死于脑血管意外的危险因素[22-23]。

表3 Logistic回归分析重度WMLs危险因素
已有研究表明尿酸是WMLs的独立危险因素。Shih等[3]在一项横断面调查研究中发现,高尿酸血症与老年男性的重度深部脑白质病变(deep white matter lesions,DWMLs)呈正相关。刘庆新等[24]的研究也证实了上述结果,他们发现血尿酸水平增高是脑小血管病导致的WMLs的独立危险因素。然而,目前尚未有研究就血尿酸水平与卒中患者WMLs的相关性进行探讨。我们的研究发现,在校正可能影响脑白质病变的混杂因素后,血尿酸水平和高尿酸血症是急性缺血性卒中患者伴发重度WMLs的独立危险因素,提示尿酸可能在卒中WMLs发生中起促进作用。推测其可能机制为:血尿酸水平增高可导致氧自由基增加[25]、水溶性尿酸微结晶析出损伤血管内皮[26]、激活血小板并启动凝血级联反应[27]、促进脂质过氧化[28]及促进血管平滑肌细胞凋亡[29],这些因素综合作用可损伤脑微小血管内皮,破坏血脑屏障,造成血液成分渗漏至血管周围组织及脑实质内,最终导致WMLs的发生[24]。
此外,本研究也发现年龄与急性缺血性卒中患者发生重度WMLs相关,这已被多个研究所证实[30-33]。可能与高龄所伴随的脑小动脉硬化及后续的血脑屏障破坏导致的脑脊液白蛋白和IgG渗漏有关[34]。
综上所述,我们发现血尿酸水平和高尿酸血症是急性缺血性卒中患者发生重度WMLs的独立危险因素。本研究尚存在一些不足之处。首先,本研究仅是基于急性缺血性卒中患者的一个横断面研究,并未能真正阐明高尿酸血症与WMLs的因果关系。其次,本研究采用Ylikoski量表对WMLs进行评估,难以避免人为误差,将来研究中需要精确度更高的WMLs评价手段。第三,本研究未对患者进行随访,今后需要纵向研究对高尿酸血症与卒中患者WMLs进展的相关性进行探讨。
1 Hachinski VC, Potter P, Merskey H. Leuko-araiosis[J].Arch Neurol, 1987, 44:21-23.
2 Srikanth V, Beare R, Blizzard L, et al. Cerebral white matter lesions, gait, and the risk of incident falls:a prospective population-based study[J]. Stroke, 2009,40:175-180.
3 Shih CY, Chen CY, Wen CJ, et al. Relationship between serum uric acid and cerebral white matter lesions in the elderly[J]. Nutr Metab Cardiovasc Dis, 2012, 22:154-159.
4 Ylikoski R, Ylikoski A, Erkinjuntti T, et al. White matter changes in healthy elderly persons correlate with attention and speed of mental processing[J]. Arch Neurol, 1993, 50:818-824.
5 中华神经科学会. 各类脑血管病诊断要点[J]. 中华神经科杂志, 1996, 29:379-380.
6 冯涛, 王拥军. 脑白质疏松的影像学评测量表[J]. 中国卒中杂志, 2009, 4:226-230.
7 Tseng YL, Chang YY, Liu JS, et al. Association of plasma homocysteine concentration with cerebral white matter hyperintensity on magnetic resonance images in stroke patients[J]. J Neurol Sci, 2009, 284:36-39.
8 Mancia G, De Backer G, Dominiczak A, et al.2007 Guidelines for the Management of Arterial Hypertension:The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC)[J]. J Hypertens, 2007, 25:1105-1187.
9 Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Report of the expert committee on the diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 1997, 20:1183-1197.
10 Kilpatrick ES, Bloomgarden ZT, Zimmet PZ.International Expert Committee report on the role of the A1C assay in the diagnosis of diabetes:response to the International Expert Committee[J]. Diabetes Care,2009, 32:e159.
11 孙伟平, 贾志荣, 王朝霞, 等. 同型半胱氨酸与脑卒中患者脑白质病变的相关性研究[J]. 中华老年心脑血管病杂志,2011, 13:53-55.
12 胡大一, 丁荣晶. 无症状高尿酸血症合并心血管疾病诊治建议中国专家共识[J]. 中国全科医学, 2010, 13:1145-1149.
13 Lehto S, Niskanen L, Ronnemaa T, et al. Serum uric acid is a strong predictor of stroke in patients with noninsulin-dependent diabetes mellitus[J]. Stroke, 1998,29:635-639.
14 Weir CJ, Muir SW, Walters MR, et al. Serum urate as an independent predictor of poor outcome and future vascular events after acute stroke[J]. Stroke, 2003,34:1951-1956.
15 Strasak A, Ruttmann E, Brant L, et al. Serum uric acid and risk of cardiovascular mortality:a prospective longterm study of 83,683 Austrian men[J]. Clin Chem, 2008,54:273-284.
16 夏珍珍, 马兰, 丁海峰, 等. 血尿酸与心脑血管疾病的研究进展[J]. 中西医结合心脑血管病杂志, 2012, 10:339-340.
17 Kuller LH, Longstreth WJ, Arnold AM, et al. White matter hyperintensity on cranial magnetic resonance imaging:a predictor of stroke[J]. Stroke, 2004, 35:1821-1825.
18 Streifler JY, Eliasziw M, Benavente OR, et al.Development and progression of leukoaraiosis in patients with brain ischemia and carotid artery disease[J]. Stroke, 2003, 34:1913-1916.
19 Yamano S, Horii M, Takami T, et al. Comparison between angiotensin-converting enzyme inhibitors and angiotensin receptor blockers on the risk of stroke recurrence and longitudinal progression of white matter lesions and silent brain infarcts on MRI (CEREBRAL study):rationale, design, and methodology[J]. Int J Stroke, 2013 Jul 9. doi:10.1111/ijs.12085.[Epub ahead of print]
20 Altaf N, Daniels L, Morgan PS, et al. Cerebral white matter hyperintense lesions are associated with unstable carotid plaques[J]. Eur J Vasc Endovasc Surg, 2006,31:8-13.
21 Henon H, Vroylandt P, Durieu I, et al. Leukoaraiosis more than dementia is a predictor of stroke recurrence[J]. Stroke, 2003, 34:2935-2940.
22 刘文宏, 黄一宁. 年龄相关性脑白质改变的研究进展[J].中华老年心脑血管病杂志, 2007, 9:68-70.
23 曲东锋. 脑白质疏松是急性卒中溶栓治疗后有症状脑出血的危险因素[J]. 国际脑血管病杂志, 2006, 14:869.
24 刘庆新, 王君霞, 王媛, 等. 血尿酸水平与脑小血管病的关系[J]. 山东医药, 2012, 52:37-38.
25 Hong Q, Qi K, Feng Z, et al. Hyperuricemia induces endothelial dysfunction via mitochondrial Na+/Ca2+exchanger-mediated mitochondrial calcium overload[J].Cell Calcium, 2012, 51:402-410.
26 Khosla UM, Zharikov S, Finch JL, et al. Hyperuricemia induces endothelial dysfunction[J]. Kidney Int, 2005,67:1739-1742.
27 Shimodaira M, Niwa T, Nakajima K, et al. Gender differences in the relationship between serum uric acid and mean platelet volume in a Japanese general population[J]. Platelets, 2013-05-30.[Epub ahead of print]
28 Sautin YY, Nakagawa T, Zharikov S, et al. Adverse effects of the classic antioxidant uric acid in adipocytes:NADPH oxidase-mediated oxidative/nitrosative stress[J]. Am J Physiol Cell Physiol, 2007,293:C584-C596.
29 Feig DI. The role of uric acid in the pathogenesis of hypertension in the young[J]. J Clin Hypertens(Greenwich), 2012, 14:346-352.
30 de Leeuw FE, de Groot JC, Achten E, et al. Prevalence of cerebral white matter lesions in elderly people:a population based magnetic resonance imaging study.The Rotterdam Scan Study[J]. J Neurol Neurosurg Psychiatry, 2001, 70:9-14.
31 Kim KW, Macfall JR, Payne ME. Classification of white matter lesions on magnetic resonance imaging in elderly persons[J]. Biol Psychiatry, 2008, 64:273-280.
32 Li L, Simoni M, Kuker W, et al. Population-based casecontrol study of white matter changes on brain imaging in transient ischemic attack and ischemic stroke[J].Stroke, 2013, 44:3063-3070.
33 Kreisel SH, Blahak C, Bazner H, et al. Deterioration of gait and balance over time:the effects of age-related white matter change--the LADIS study[J]. Cerebrovasc Dis, 2013, 35:544-553.
34 Xiong YY, Mok V. Age-related white matter changes[EB/OL]. [2011-08-23](2013-03-21). http://www.hindawi.com/journals/jar/2011/617927.
