量子点电化学发光及其在生物分析中的应用
2014-03-07刘仲明
席 强,王 捷,陈 钰,刘仲明
(1.广州军区广州总医院医学实验科,广东广州 510010; 2.华南理工大学生物科学与工程学院,广东广州 510006)
量子点电化学发光及其在生物分析中的应用
席 强1,2,王 捷1*,陈 钰1,刘仲明1
(1.广州军区广州总医院医学实验科,广东广州 510010; 2.华南理工大学生物科学与工程学院,广东广州 510006)
量子点作为一种新型的电化学发光体具有独特的理化性质,是电化学发光分析领域的研究热点之一.本文简要介绍了量子点电化学发光的机理,回顾了近几年来功能化量子点作为电化学发光体在免疫分析、核酸分析、适体分析、细胞表面聚糖分析等方面的应用,并对其今后的发展方向作了展望.
量子点;电化学发光;机理;免疫分析;核酸分析
电化学发光(Electrochemiluminescence,ECL),又称电致化学发光,是指在电极上施加一定的电压形成电生物质,电生物质之间或电生物质与体系中某些组分之间通过电子转移生成激发态,不稳定的激发态在跃迁回基态的过程中辐射出光子的现象[1].与光致发光相比,电化学发光作为一种新的分析技术,其主要的优点是不需要外部光源.这样就避免了杂质光和光散射的问题,提高了检测的灵敏度[2].ECL分析技术由于集成了电化学电位可控性和化学发光分析的高灵敏度的优点,已成为一种强有力的分析技术.
自2002年BARD课题组[3]首次于《Science》上报道了硅量子点(Si Quantum Dots,Si QDs)在有机溶液中的电化学发光以来,基于量子点的电化学发光体系引起了广泛的关注.许多不同尺寸和形状的量子点,如CdS[4]、CdSe[5]、CdTe[6]、ZnS[7]等不仅在有机相中,而且在水溶液中也能产生电化学发光.与传统的电化学发光体系相比,基于量子点的电化学发光更具可控性,体系也更加温和,在免疫分析、核酸探针分析、适体分析等方面获得了越来越多的关注.
1 量子点电化学发光机理
量子点作为新型的ECL发光体,发光性质与其表面状态及尺寸有着较大的关系[8].电子和空穴可通过电化学氧化还原过程注入量子点的表面或中心导带,进而产生ECL辐射.与经典的[Ru(bpy)3]2+/TPrA体系电化学发光机理类似,量子点的电化学发光机理也主要有自由基湮灭和共反应物参与两种.
1.1 自由基湮灭机理
当对电极施加双阶跃正负脉冲电势时,在电极附近将会同时产生氧化态和还原态的QDs,二者相互碰撞形成激发态QDs*和基态QDs,激发态的QDs在返回基态的弛豫过程中辐射出光子.这种反应一般被称作“自由基湮灭”反应,其机理如下:

基于这类反应机理的量子点常在有机溶剂中进行,主要有CdSe[9]、CdTe[10]、PbS[11]、Si[3]等.其中,Si量子点电化学发光体系是湮灭型量子点ECL体系的一个典型例子.BARD研究小组[3]发现,在乙氰溶液中对铂金电极同时施加氧化和还原电势时,Si QDs在阳极氧化生成QDs·+,在阴极还原生成QDs·-.电极附近扩散层中的这两种电生产物相互碰撞发生湮灭反应,形成激发态的Si QDs*,Si QDs*返回基态时在620 nm处释放光子.对于这种湮灭反应,需要同时存在氧化产物和还原产物,并且要求氧化产物和还原产物具有足够的稳定性以便彼此碰撞产生激发态分子.
1.2 共反应物机理
在共反应物存在的条件下,量子点的电化学发光通常只需对电极施加单一的电势即可.共反应物是一些在氧化或还原时可以产生具有强还原性或强氧化性的中间体物质,产生的中间体能和电化学发光体系中的氧化性或还原性量子点生成激发态分子,如、TPrA[12]、DBAE[13]、、等.由于湮灭型量子点ECL体系要求同时产生氧化态和还原态,而水溶液中能允许的电势跨度太小,因此该体系常常要求纯净的无水无氧环境,不利于进一步的应用研究.而共反应物的存在则能很好地克服这些缺点,因此该类型ECL反应体系目前应用最广泛.以“氧化-还原”型的QDs/DBAE电化学发光体系为例[13],其反应过程可表述如下:

与TPrA、DBAE等“氧化-还原”型共反应物体系不同的是,在“还原-氧化”型共反应物体系中,共反应物和QDs均被还原,还原后的共反应剂形成强氧化物并将还原性的QDs氧化形成激发态,激发态在返回基态的过程中释放出光子.参与该类型反应体系的阴极共反应物主要有、H2O2、CH2Cl2等.以/QDs共反应物体系为例,其反应过程为:[4]:

2 量子点电化学发光在生物分析领域的应用
2.1 免疫分析
免疫分析是一种常用的生物分析方法,它主要是基于抗体(或抗原)作为选择性试剂来分析和测定各种抗原(或抗体)及半抗原以及能发生免疫反应的多种生物活性物质(如蛋白质、激素、抗生素和药物等),具有非常高的选择性和灵敏性.根据在反应中是否将QDs标记于抗体(或抗原)上可将其分为非标记免疫分析和标记免疫分析两大类[18].
立体障碍策略是QDs非标记型免疫分析中最常用的方法.该方法是基于免疫反应后形成的绝缘复合物阻碍共反应物与电极之间的电子传递,从而实现对目标分析物的灵敏检测.JIE等[4]利用半胱胺自组装技术和金纳米颗粒(Au-NPs)的信号放大策略,将巯基乙酸(Thioglycolic Acid,TGA)修饰的CdS量子点固定于金电极表面,发展了一种用于检测低密度脂蛋白(LDL)的非标记型QDs-ECL免疫传感器(图1).当存在LDL时,其与QDs表面的ApoB-100反应形成免疫复合物绝缘层阻碍溶液中的S2O82-与金电极之间的电子传递,从而导致发光强度的降低.该方法的线性范围为0.025~16μg·L-1,最低检测限(LOD)为6ng·L-1.为了进一步拓宽该类免疫传感器的线性范围和提高其灵敏度,随后该课题组[19]利用碳纳米管(CNT)良好的导电性和壳聚糖(CHIT)优良的成膜性将CdSe量子点固定于工作电极表面.交联剂3-氨基丙基三乙氧基硅烷(APTES)的加入使得该方法的LOD低至1ng·L-1.除了APTES,交联剂聚二烯丙基二甲基氯化铵(PDDA)也被用于传感界面的修饰,结合纳米材料的信号放大作用使得对人免疫球蛋白G(Human Immunoglobulin G,HIgG)的LOD低至0.6ng·L-1[20].
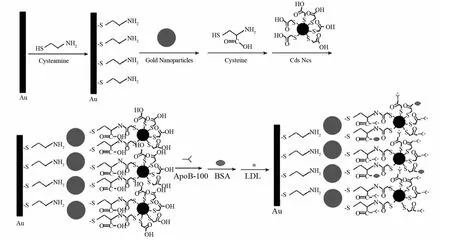
图1 生物传感器的组装及LDL的结合示意图[4]Fig.1 Schematic diagram for the biosensor fabrication and LDL binding
相对于非标记免疫分析,基于QDs的标记免疫分析更多的是采用夹心免疫模式.各种纳米材料[21-22]被广泛用来负载信号抗体,并以此用于免疫夹心分析的信号示踪.这种方法使得单个生物识别事件所结合的电化学发光标记物大大增加,从而使得其灵敏度较传统的单标记ECL免疫方法有了很大的提高,检测限大大降低.最近,QIAN等[23]利用Si纳米球良好的生物相容性和较大的比表面积,以此来负载CdTe量子点和二抗,实现了对肿瘤标志物的高灵敏度、低检测限的分析.与仅用CdTe QDs作为单标记相比,ECL强度提高了约6.6倍.该免疫传感器对IgG的检测下限可达1.3ng·L-1.ZHANG等[24]设计合成了一种多孔的PtRu合金,并将其用作CdTe量子点的信号放大载体,使得对人绒毛膜促性腺激素(Human Chorionic Gonadotropin,HCG)的检测限低至0.8ng·L-1.石墨烯与碳纳米管一样具有良好的导电性和高的比表面积,可负载更多的信号分子,从而提高检测灵敏度[25].LIU等[22]以金磁纳米颗粒(MPNs)和经PDDA和QDs修饰的石墨烯分别作为一抗和二抗载体,构建了一种用于肿瘤标志物CA125检测的“三明治”型免疫传感器(见图2).这种借助磁珠的超顺磁性的分析方法,使得免疫复合物的分离和富集变得更加便捷,同时也使检测灵敏度得到了进一步的提高.
2.2 核酸分析
在各种各样的核酸检测技术中,基于ECL生物传感器的方法由于其应用范围广、仪器简单、时空可控性好而受到广泛的关注[26-27].常以QDs作为发光剂与生物识别分子(如ssDNA或亲和素)相连,进行核酸ECL分析.例如,将DNA探针的一端通过Au-S键固定于Au电极上,然后与生物素化的目标DNA杂交,最后加入亲和素化的量子点[28](见图3).如存在目标DNA,则经HNO3溶解的Cd2+在S2O82-溶液中将会产生强烈的电化学发光现象.这种基于ECL信号增强的生物传感器与目标DNA在0.005~5μmol·L-1的浓度范围内呈现良好的线性关系,其LOD可达10pmol·L-1.
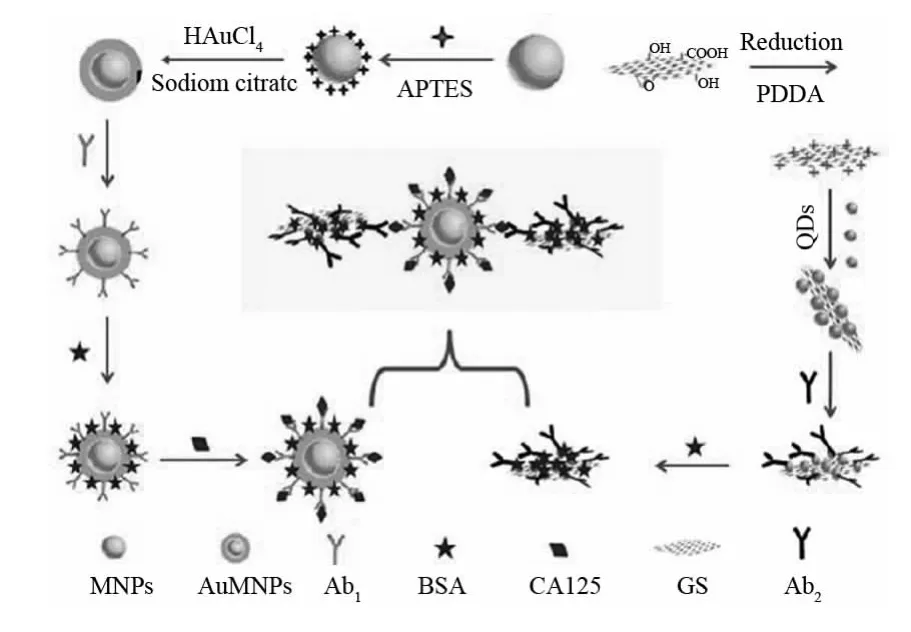
图2 基于磁珠和石墨烯的电化学发光免疫传感器组装过程示意图[22]Fig.2 Schematic representation of the fabrication of electrochemiluminescence immunosensor based on magnetic beads and graphenes
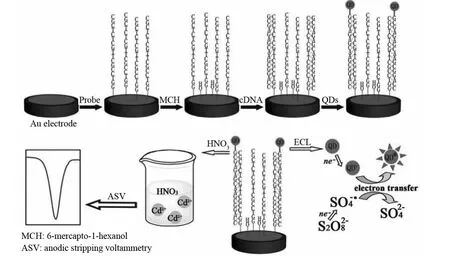
图3 基于量子点电化学发光检测目标DNA的一般方法[28]Fig.3 An ordinary method for detection of target DNA based on quantum dots electrochemiluminescence
利用分子生物学的方法对样品中检测对象进行信号放大可实现分析方法的高灵敏度,甚至达到单分子检测的要求.目前基于分子生物学方法的信号放大策略主要包括滚环扩增(RCA)[29]、剪切酶放大技术[30]、等温循环扩增[31]等.例如,ZHOU等[32]通过使用双纳米粒子标记的三重DNA探针和等温循环扩增技术,构建了一种高灵敏度、高特异性检测单核苷酸多态性的QDs-ECL传感器(见图4).在含有共反应物S2O82-溶液及存在突变DNA(mutant DNA,mDNA)的情况下,由于mDNA与三重茎环DNA具有较强的结合自由能,致使三重茎环DNA构象改变以及Probe 2的分离,最终解除金纳米粒子(Au NPs)和CdTe对CdS的猝灭作用,同时也触发了后续的聚合反应.在链置换和Nb.BbvCⅠ内切酶(一种能识别并切割特异的双链DNA序列的内切核酸酶)作用下,mDNA得到了极大地扩增并导致ECL信号的增强.利用该策略所构建的ECL-SNP传感器的LOD可低达35amol·L-1.其创新地在两种探针上连接上了两个猝灭剂,使背景信号变得更低,在Klenow聚合酶和Nb.BbvCⅠ内切酶作用下使得目标mDNA不断地被循环放大.
2.3 其他方面的应用
核酸适体(aptamer)是近年来发展起来的一类新型识别分子,由于具有相对分子质量小、可化学合成、稳定性好、无毒等优点,而引起了广泛关注[33].同目前生物分析中常用的抗体相比,aptamer与靶标结合的特异性及亲和力与抗体相当甚至更强.由于它折叠后形成的特定三维结构能与特定靶标,如激素、蛋白质、小分子结合,所以近年来在QDs-ECL分析中受到越来越多的关注[34].HUANG等[35]构建了一种基于量子点的竞争型核酸适体ECL传感器用于小分子物质ATP的检测(见图5).在金电极上,亲和素化的CdSe/ZnS核-壳式量子点与生物素化的cDNA相连并与ATP竞争性地结合anti-ATP适配体探针.在共反应物S2溶液中,ECL强度的降低与ATP浓度在0.018~90.72μmol·L-1范围内呈良好的线性关系.虽然该方法的检测灵敏度有待提高,但具有很高的特异性.此外,也拓宽了QDs-ECL分析应用范围.通过类似的方法,该课题组[34]又对溶菌酶进行了检测.此外,方禹之课题组[36]通过电沉积CTS-CdS QDs到碳纳米管(CNTs)上再结合aptamer构建了一种免标记的QDs-ECL传感器用于凝血酶检测.此种核酸适体传感器避免了繁琐的标记过程,具有构建简单的优点.
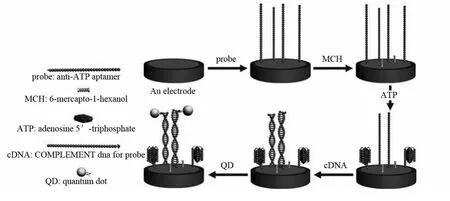
图5 量子点电化学发光核酸适体传感器的制备过程[35]Fig.5 Schematic representation of the fabrication of aptasensor based on QDs-ECL
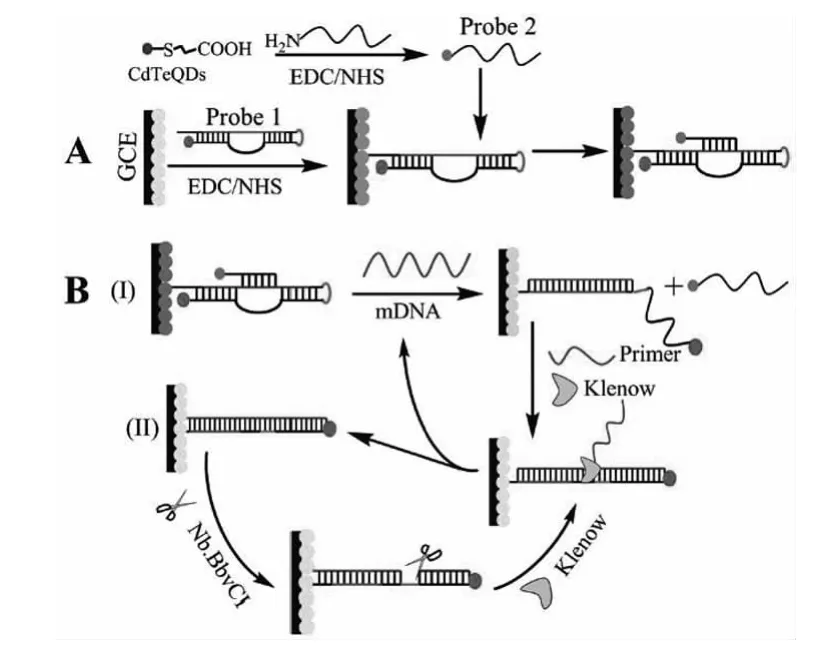
图4 (A)三重茎环DNA探针的制备(B)基于双纳米粒子标记的三重茎环DNA探针和等温循环扩增技术检测mDNA的示意图[32]Fig.4 (A)Preparation of triple-stem DNA probe(B)Schematic representation of nanomaterial and isothermal circular-assisted triple-stem DNA probe assisted ECL signal amplification for amplified assay of mDNA
多糖是细胞表面糖脂和糖蛋白的重要组成成分,在细胞粘附、信号转导、免疫应答以及肿瘤的生长转移等方面具有重要作用[37].目前,对于细胞表面多糖的检测,主要是基于其与凝集素的特异性识别行为来进行的.HAN等[38]利用凝集素对细胞表面聚糖的特异性识别及功能化CdSe QD作为ECL发光剂构建了一种新颖的用于监测活细胞表面聚糖动态表达的QDs-ECL细胞传感器.细胞表面多糖量的多少与ECL信号强度在一定范围内呈反比关系.由于量子点具有较大的斯托克斯位移,发射光谱窄,因此可被用作电化学发光共振能量转移(RET)的供体.陈洪渊课题组[39]设计了一种利用CdS QDs-[Ru(bpy)3]2+作为供体-受体对进行ECL-RET的传感策略用于检测SMMC-7721细胞(见图6).当[Ru(bpy)3]2+标记的SMMC-7721细胞通过免疫反应被捕获到CdS量子点修饰的玻碳电极(GCE)上时,通过供体-受体之间的ECL-RET将会使[Ru(bpy)3]2+在620nm处产生另一个ECL峰.该方法对SMMC-7721细胞的检测下限可达12.5cells ·mL-1.随后该研究小组[40]利用类似的策略构建了一种芯片微分析平台用于癌细胞表面多种肿瘤标志物的快速分析.
除了以上基于生物分子间特异性识别策略来构建的传感方法外,一些利用目标分析物或其产物对ECL体系具有明显抑制效应的分析方法也被用于QDs-ECL生物传感器的设计[41-43].例如LIU等[15]首次利用作为CdTe QDs的共反应物,酪氨酸酶催化反应产物作为湮灭剂,构建了一种超灵敏的ECL分析方法用于酪氨酸的检测.激发态的CdSe QDs与酪氨酸酶催化产物苯醌之间通过能量转移而发生湮灭,从而导致ECL强度的显著降低.该方法对酪氨酸的检测下限可达0.1pmol·L-1.随后该课题组[44]又发现多巴胺的氧化产物对/CdSe QDs电化学发光体系具有强烈抑制作用,从而发展了一种具有良好选择性并可用于多巴胺检测的抑制型QDs-ECL分析方法.
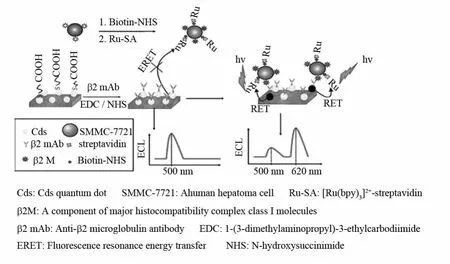
图6 基于ECL能量共振转移检测细胞表达的β2M的电化学发光生物传感器示意图[39]Fig.6 Schematic representation of ECL biosensor based on ECL-RET for determination ofβ2Mexpressed cells
3 展望
QDs因其优异的理化性质而逐渐成为生物分析领域极具竞争力的ECL发光剂,尤其是其尺寸可控的发光行为使得量子点可用于多组分生物分析,但同时也面临一些诸如生物毒性、灵敏度偏低、非特异性结合、工作电位较高等很多实际问题.利用低毒性的生物相容性分子对QDs进行包裹修饰,或合成低毒(或非毒性)的量子点(如碳量子点、石墨烯量子点、金属纳米簇等)并研究其相关的ECL机理将成为今后QDs-ECL生物传感器研究的重点.在信号放大方面,随着纳米科技与生物技术的迅猛发展,将一些新型的纳米材料(如多孔Si纳米球、树状聚合物、石墨烯等)和生物放大技术(如滚环扩增、等温循环扩增、剪接酶放大等)结合起来,将是目前QDs-ECL在生物分析中的一个重要趋势.通过与核酸适体技术相结合,QDs-ECL可以高选择性地检测小分子、蛋白质和其它生物分子.总之,QDs-ECL分析技术在临床诊断、药物分析、食品检测等领域的广泛应用将促使QDs-ECL不断向着高通量、多组分、集成化、微型化以及实时动态监测方向发展.
[1]MIAO Wujian.Electrogenerated chemiluminescence and its biorelated applications[J].Chem Rev,2008,108(7):2506-2553.
[2]HU Lianzhe,XU Guobao.Applications and trends in electrochemiluminescence[J].Chem Soc Rev,2010,39(8):3275-3304.
[3]DING Zhifeng,QUINN B M,HARAM S K,et al.Electrochemistry and electrogenerated chemiluminescence from silicon nanocrystal quantum dots[J].Science,2002,296(5571):1293-1297.
[4]JIE Guifen,LIU Bo,PAN Hongcheng,et al.CdS nanocrystal-based electrochemiluminescence biosensor for the detection of low-density lipoprotein by increasing sensitivity with gold nanoparticle amplification[J].Anal Chem,2007,79(15):5574-5581.
[5]JIE Guifen,HUANG Haiping,SUN Xiaolian,et al.Electrochemiluminescence of CdSe quantum dots for immunosensing of human prealbumin[J].Biosens Bioelectron,2008,23(12):1896-1899.
[6]LIANG Guodong,LIU Shufeng,ZOU Guizheng,et al.Ultrasensitive immunoassay based on anodic near-infrared electrochemiluminescence from dual-stabilizer-capped CdTe nanocrystals[J].Anal Chem,2012,84(24):10645-10649.
[7]WANG Xiaofei,XU Jingjuan,CHEN Hongyuan.A new electrochemiluminescence emission of Mn2+-doped ZnS nanocrystals in aqueous solution[J].J Phys Chem C,2008,112(45):17581-17585.
[8]BARD A J,DING Zhifeng,MYUNG N.Electrochemistry and electrogenerated chemiluminescence of semiconductor nano-crystals in solutions and in films[M].Semiconductor Nanocrystals and Silicate Nanoparticles.Springer,2005:1-57.
[9]MYUNG N,DING Zhifeng,BARD A J.Electrogenerated chemiluminescence of CdSe nanocrystals[J].Nano Lett,2002,2(11):1315-1319.
[10]YOONJUNG B,MYUNG N,BARD A J.Electrochemistry and electrogenerated chemiluminescence of CdTe nanoparticles[J].Nano Lett,2004,4(6):1153-1161.
[11]SUN Liangfeng,BAO Lei,HYUN B R,et al.Electrogenerated chemiluminescence from PbS quantum dots[J].Nano Lett,2009,9(2):789-793.
[12]OMER K M,BARD A J.Electrogenerated chemiluminescence of aromatic hydrocarbon nanoparticles in an aqueous solution[J].J Phys Chem C,2009,113(27):11575-11578.
[13]ZHANG Lihua,ZOU Xiangqin,YING Erbo,et al.Quantum dot electrochemiluminescence in aqueous solution at lower potential and its sensing application[J].J Phys Chem C,2008,112(12):4451-4454.
[14]LIU Xuan,ZHANG Yangyang,LEI Jianping,et al.Quantum dots based electrochemiluminescent immunosensor by coupling enzymatic amplification with self-produced coreactant from oxygen reduction[J].Anal Chem,2010,82(17):7351-7356.
[15]LIU Xuan,JU Huangxian.Coreactant enhanced anodic electrochemiluminescence of CdTe quantum dots at low potential for sensitive biosensing amplified by enzymatic cycle[J].Anal Chem,2008,80(14):5377-5382.
[16]LIN Zhenyu,CHEN Lifen,ZHU Xi,et al.Signal-on electrochemiluminescence biosensor for thrombin based on targetinduced conjunction of split aptamer fragments[J].Chem Commun,2010,46(30):5563-5565.
[17]WU Li,WANG Jiasi,REN Jinsong,et al.Highly sensitive electrochemiluminescent cytosensing using carbon nanodot@Ag hybrid material and graphene for dual signal amplification[J].Chem Commun,2013,49(50):5675-5677.
[18]李玲玲,卢倩,朱俊杰.基于量子点的电致化学发光免疫传感器研究进展[J].电化学,2013,19(002):103-109.
[19]JIE Guifen,ZHANG Jingjing,WANG Danchen,et al.Electrochemiluminescence immunosensor based on CdSe nanocomposites[J].Anal Chem,2008,80(11):4033-4039.
[20]JIE Guifen,LI Lingling,CHEN Chao,et al.Enhanced electrochemiluminescence of CdSe quantum dots composited with CNTs and PDDA for sensitive immunoassay[J].Biosens Bioelectron,2009,24(11):3352-3358.
[21]ZHOU Hankun,GAN Ning,LI Tianhua,et al.The sandwich-type electrochemiluminescence immunosensor for alpha-fetoprotein based on enrichment by Fe3O4-Au magnetic nano probes and signal amplification by CdS-Au composite nanoparticles labeled anti-AFP[J].Anal Chim Acta,2012,746(9):107-113.
[22]LIU Weiyan,ZHANG Yan,GE Shenguang,et al.Core-shell Fe3O4-Au magnetic nanoparticles based nonenzymatic ultrasensitive electrochemiluminescence immunosensor using quantum dots functionalized graphene sheet as labels[J].Anal Chim Acta,2013,770(3):132-139.
[23]QIAN Jing,ZHANG Chunyan,CAO Xiaodong,et al.Versatile immunosensor using aquantum dot coated silica nanosphere as a label for signal amplification[J].Anal Chem,2010,82(15):6422-6429.
[24]ZHANG Yan,GE Shengguang,WANG Shaowei,et al.Magnetic beads-based electrochemiluminescence immunosensor for determination of cancer markers using quantum dot functionalized PtRu alloys as labels[J].Analyst,2012,137(9):2176-2182.
[25]CHEN Yu,WANG Jie,LIU Zhongming.Graphene and its derivative-based biosensing systems[J].Chin J Anal Chem,2012,40(11):1772-1779.
[26]张帆,陈红,何品刚,等.脱氧核糖核酸电致化学发光传感技术的研究[J].分析化学,2013,41(1):1-9.
[27]HU Xiaofei,WANG Rongyue,DING Yi,et al.Electrochemiluminescence of CdTe quantum dots as labels at nanoporous gold leaf electrodes for ultrasensitive DNA analysis[J].Talanta,2010,80(5):1737-1743.
[28]HUANG Haiping,Li Jingjing,TAN Yanglan,et al.Quantum dot-based DNA hybridization by electrochemiluminescence and anodic stripping voltammetry[J].Analyst,2010,135(7):1773-1778.
[29]CHENG Wei,YAN Feng,DING Lin,et al.Cascade signal amplification strategy for subattomolar protein detection by rolling circle amplification and quantum dots tagging[J].Anal Chem,2010,82(8):3337-3342.
[30]ZHOU Hong,ZHANG Yanyan,LIU Jing,et al.Efficient quenching of electrochemiluminescence from K-doped graphene-CdS:Eu NCs by G-quadruplex-hemin and target recycling-assisted amplification for ultrasensitive DNA biosensing[J].Chem Commun,2013,49(22):2246-2248.
[31]ZHOU Hong,LIU Jing,Xu Jingjuan,et al.Ultrasensitive DNA detection based on Au nanoparticles and isothermal cir-cular double-assisted electrochemiluminescence signal amplification[J].Chem Commun,2011,47(29):8358-8360.
[32]ZHOU Hong,LIU Jing,XU Jingjuan,et al.Highly sensitive electrochemiluminescence detection of single-nucleotide polymorphisms based on isothermal cycle-assisted triple-stem probe with dual-nanoparticle label[J].Anal Chem,2011,83(21):8320-8328.
[33]ZHANG Jianni,LIU Bo,LIU Huixia,et al.Aptamer-conjugated gold nanoparticles for bioanalysis[J].Nanomedicine,2013,8(6):983-993.
[34]HUANG Haiping,JIE Guifen,CUI Rongjing,et al.DNA aptamer-based detection of lysozyme by an electrochemiluminescence assay coupled to quantum dots[J].Electrochem Commun,2009,11(4):816-818.
[35]HUANG Haiping,TAN Yanglan,SHI Jianjun,et al.DNA aptasensor for the detection of ATP based on quantum dots electrochemiluminescence[J].Nanoscale,2010,2(4):606-612.
[36]YANG Lizhu,ZHU Jing,XU Ying,et al.Electrochemiluminescence aptamer biosensor for detection of thrombin based on CdS QDs/ACNTs electrode[J].Electroanalysis,2011,23(4):1007-1012.
[37]OHTSUBO K,MARTH J D.Glycosylation in cellular mechanisms of health and disease[J].Cell,2006,126(5):855-867.
[38]HAN En,DING Ling,LIAN Hongzhen,et al.Cytosensing and dynamic monitoring of cell surface carbohydrate expression by electrochemiluminescence of quantum dots[J].Chem Commun,2010,46(30):5446-5448.
[39]WU Meisheng,SHI Haiwei,XU Jingjuan,et al.CdS quantum dots/[Ru(bpy)3]2+electrochemiluminescence resonance energy transfer system for sensitive cytosensing[J].Chem Commun,2011,47(27):7752-7754.
[40]WU Meisheng,SHI Haiwei,HE Lijing,et al.Microchip device with 64-site electrode array for multiplexed immunoassay of cell surface antigens based on electrochemiluminescence resonance energy transfer[J].Anal Chem,2012,84(9):4207-4213.
[41]LI Jiezhen,WANG Niya,TRAN T T,et al.Electrogenerated chemiluminescence detection of trace level pentachlorophenol using carbon quantum dots[J].Analyst,2013,138(7):2038-2043.
[42]JIANG Hui,WANG Xuemei.Anodic electrochemiluminescence of CdSe nanoparticles coreacted with tertiary amine and halide induced quenching effect[J].Electrochem Commun,2009,11(6):1207-1210.
[43]LIU Xuan,GUO Liang,CHENG Lingxiao,et al.Determination of nitrite based on its quenching effect on anodic electrochemiluminescence of CdSe quantum dots[J].Talanta,2009,78(3):691-694.
[44]XUAN Liu,CHENG Lingxiao,LEI Jianping,et al.Dopamine detection based on its quenching effect on the anodic electrochemiluminescence of CdSe quantum dots[J].Analyst,2008,133(9):1161-1163.
Electrochemiluminescence of quantum dots and their applications in bioassay
XI Qiang1,2,WANG Jie1*,CHEN Yu1,LIU Zhongming1
(1.DepartmentofMedicalResearch,GeneralHospitalofGuangzhouMilitaryCommand,Guangzhou510010,Guangdong,China;2.SchoolofBioscienceandBioengineering,SouthChinaUniversityofTechnology,Guangzhou510006,Guangdong,China)
As a type of new electrochemiluminescence emitters with unique chemical and physical properties,quantum dots have become a spotlight in the area of electrochemiluminescence analysis.In this paper,the basic electrochemiluminescence mechanisms of quantum dots are briefly described,and their analytical applications in immunoassay,DNA analysis,aptasensing and cytosensing are reviewed.Furthermore,the development trend of quantum dot electrochemiluminescence is prospected.
quantum dots;electrochemiluminescence;mechanism;immunoassay;DNA analysis
O 657.1
A
1008-1011(2014)02-0209-08
2013-12-06.
广东省教育厅产学研结合项目(2010B090400187);广东省科技基础条件建设项目(2012B060100005).
席强(1988-),男,硕士生,研究方向为电化学发光生物传感器.*
,E-mail:jiew@tom.com.
