饥饿对条纹锯 仔鱼的存活、摄食及生长的影响
2014-03-07贾瑞锦孔祥迪李炎璐宋振鑫吴雷明曲江波赵从明
贾瑞锦 , 陈 超 , 孔祥迪, 李炎璐 , 宋振鑫, 吴雷明,王 鲁 曲江波, 赵从明, 吴 坚
(1. 中国水产科学研究院 黄海水产研究所, 山东 青岛 266071; 2. 上海海洋大学 水产与生命学院, 上海 201306; 3. 烟台开发区天源水产有限公司, 山东 烟台 264000; 4. 天津立达海水资源开发有限公司, 天津 300050; 5. 浙江海生源生物科技有限公司, 浙江 台州 317600)
饥饿对条纹锯 仔鱼的存活、摄食及生长的影响
贾瑞锦1,2, 陈 超1,2, 孔祥迪1,2, 李炎璐1,2, 宋振鑫1,2, 吴雷明1,2,王 鲁1, 曲江波3, 赵从明4, 吴 坚5
(1. 中国水产科学研究院 黄海水产研究所, 山东 青岛 266071; 2. 上海海洋大学 水产与生命学院, 上海 201306; 3. 烟台开发区天源水产有限公司, 山东 烟台 264000; 4. 天津立达海水资源开发有限公司, 天津 300050; 5. 浙江海生源生物科技有限公司, 浙江 台州 317600)
为了确定条纹锯 (Centropristis striata)仔鱼的不可逆点(PNR), 作者在温度(22.9±0.8)℃、盐度30~32、DO≥5.0mg/L、pH7.8~8.2, 光照强度40~100 Lx条件下, 对人工孵化的条纹锯 仔鱼开展饥饿胁迫对其存活、摄食、生长的变化规律的试验研究及影响。结果显示, 仔鱼在孵化后2 d开口摄食, 仔鱼体长开始下降, 从内源营养期转入混合营养期, 持续1 d; 3 d时卵黄囊、油球消失, 仔鱼体长增加, 进入外源营养期, 初次摄食率可达到68.25%。3.5 d时初次摄食率最高达到88.24%, 之后初次摄食率逐渐下降, 5 d时初次摄食率下降为37.5%, 可知条纹锯 PNR=5 d。6.5 d时试验组仔鱼全部死亡。结果表明,内源营养期对照组与试验组无显著差异, 对卵黄囊与油球的利用率相似。混合营养期, 仔鱼体长出现负增长, 且试验组负增长速率明显高于对照组。外源营养期, 试验组仔鱼体长持续下降, 至 PNR时体长负增长速率加快死亡率增加, 直至全部死亡; 对照组仔鱼体长开始增长, 死亡率逐渐下降并趋于稳定。条纹锯 仔鱼孵出后2~5 d为摄食的关键时期。
条纹锯 (Centropristis striata)仔鱼; 饥饿; 摄食; 不可逆点
条纹锯 (Centropristis striata)属于 科(Serranidae), 石斑鱼亚科(Serraninae), 锯 属(Centropristis), 常用名美洲黑石斑鱼。条纹锯 作为名贵海水养殖鱼类, 具有肉质丰腴, 口感鲜软清爽[1],适应性强等优点[2-5], 深受广大消费者和养殖户的喜爱。中国自2002年[6]从美国引进鱼苗和受精卵进行养殖和育苗试验至今, 条纹锯 的规模化养殖已经在山东、浙江、福建、广东等地兴起, 取得了一定的经济效益。国内、外对条纹锯 都有研究报道,如条纹锯 胚胎发育[7]、幼鱼配合饲料的研究[8]、鱼种对盐度胁迫的耐受力[9]、海水网箱养殖试验[10]等, 目前未见有关饥饿对条纹锯 仔鱼发育影响的研究报道。
自然界中, 由于食物分布在时间、空间上的不均及环境剧变等, 鱼类经常会在生活周期的一定阶段面临食物资源的缺乏而受到饥饿胁迫[11-15]。在人工育苗过程中, 特别是仔鱼阶段经常由于饵料种类、数量、适口性及其转换等因素引起营养不良导致死亡,因此有关饥饿对鱼类早期生长发育的研究对育苗生产具有重要的指导意义。自 Blaxter等[16]提出“不可逆点”(the point-of-no-return, PNR)的概念即仔鱼摄食前耐受饥饿的时间临界点, 从生态学的角度研究了仔鱼对饥饿的耐受能力, 国内外对饥饿对牙鲆(Paralichthys olivaceus)[17]、半滑舌鳎(Cynoglossus semilaev is)[18]、条石鲷(Oplegnathus fasciatus)[19-21]、点带石斑鱼(Epinephelus malabaricus)[22]、斜带石斑鱼(Epinephelus coioides)[23]的影响进行了大量的研究。作者通过饥饿对条纹锯 仔鱼的存活、摄食及生长的实验研究及其影响分析, 以期解决条纹锯 苗种生产过程中的开口饵料的营养利用、内外源营养的转换及饥饿对其存活和生长的影响等问题, 为其苗种生产提供理论依据。
1 材料与方法
1.1 仔鱼来源及饲养
试验材料为2012年5月取自中国水产科学研究院黄海水产研究所暂养在烟台开发区天源水产有限公司的条纹锯 亲鱼自然产卵获得的受精卵, 收集、孵化、计数、分组。仔鱼孵化后分两组用80 L长方形塑料桶饲养, 每组设3个平行试验, 每桶2 000尾初孵仔鱼, 第一组用做饥饿试验(试验组), 不予投饵;第二组每天正常投饵(对照组), 仔鱼在开口前一天开始投喂经小球藻(Chlorella vulgaris)强化的ss轮虫(Brachionus plicatilis), 密度为10~15个/mL。培育水温(22.9±0.8)℃, 盐度30~32, DO≥5mg/L, pH7.8~ 8.2,光照强度40~100 Lx。
1.2 试验方法
试验开始后, 每隔12 h随机取仔鱼15尾, 用尼康(Nikon)E100显微镜测量其全长(L)、卵黄囊长径(R)、卵黄囊短径(r)、油球直径(D); 仔鱼开口后每隔12 h从试验组随机取20尾仔鱼放入1 000 mL烧杯中,加入10~15个/mL用小球藻强化的ss轮虫恒温饲养, 2 h后开始用尼康E100显微镜测量其L、R、r、D, 并逐尾解剖检查其消化道, 记录其肠管中含有轮虫的仔鱼的尾数。初次摄食率为肠管中含有轮虫的仔鱼尾数占所测定总尾数的百分比。PNR以仔鱼的日龄表示, 当所测得的饥饿组仔鱼的初次摄食率低于最高初次摄食率的一半时, 仔鱼的日龄即为PNR。

用Excel 2003对数据进行统计分析、运算和做图处理。
2 试验结果与分析
2.1 仔鱼的体长变化和对卵黄囊、油球的吸收
对照组条纹锯 初孵仔鱼平均体长(2.960± 0.21)mm, 通体透明可见部分淡黄色色素, 卵黄囊大而饱满, 长径占身体全长的 1/3以上, 体积为 1.27× 10–10m3; 油球较大, 位于卵黄囊的前端, 体积为2.66×10–12m3鳍褶肥厚未分化; 肠管较短, 于身体1/2处, 垂直于身体有一开口。初孵仔鱼至开口前的仔鱼无摄食能力, 依靠卵黄囊和油球营养, 仔鱼处于内源性营养期, 随着仔鱼的生长发育, 卵黄囊和油球被迅速吸收(表1)。孵化后1 d时, 仔鱼体长进一步增加, 卵黄囊体积(1.4×10–11m3)减少(表 1)仅为初孵仔鱼的1/9, 油球体积(6.47×10–13m3)为初孵仔鱼的1/4(表1)。孵化后2 d时, 仔鱼体长进一步增加, 仔鱼已开口, 但未见摄食, 此时, 卵黄囊体积(1.41×10–12m3)为初孵仔鱼卵黄囊体积的 1/90, 油球体积(7.85×10–14m3)为初孵仔鱼体积的 1/33; 仔鱼开始摄食, 卵黄囊和油球进一步消耗, 条纹锯 仔鱼进入混合营养期, 此时可见仔鱼体长明显下降(图1)。孵化3 d之后仔鱼体长开始增加, 孵化后3.5 d时仔鱼卵黄囊消失, 孵化后4 d时油球消失, 条纹锯 仔鱼进入外源营养期。
2.2 初次摄食率和不可逆点的确立

表1 条纹锯 仔鱼全长和卵黄囊、油球的变化Tab.1 Change of total length, size of yolk sac and oil globules of Centropristis striata
条纹锯 仔鱼孵出后第二天即可见口轻微上下开合, 但未见摄食, 孵化后2.5 d时, 可见仔鱼摄食,腹部明显膨大, 肠管进一步发育, 肛门开启, 仔鱼进入摄食期。对照组仔鱼摄食率为(56.25±3.97)%, 饥饿组仔鱼初次摄食率(图 2)为(68.75±4.47)%, 之后仔鱼初次摄食率逐渐增加, 至3.5 d时, 仔鱼初次摄食率达到最大为(88.24±6.38)%, 之后仔鱼初次摄食率逐渐下降, 至 5 d时, 仔鱼初次摄食率下降为(37.50± 5.45)%, 低于最高初次摄食率的一半, 表明条纹锯仔鱼进入不可逆期(PNR期)。5.5 d时, 仔鱼初次摄食率仅为(21.43±9.21)%, 6 d时, 仔鱼头部瘦削, 腹部极度萎缩, 已不再摄食, 至6.5 d时, 试验组(饥饿组)仔鱼全部死亡。

图1 饥饿仔鱼与摄食仔鱼全长变化的比较Fig.1 Comparison of total length between the unfed larvae and the fed larvae of Centropristis striata
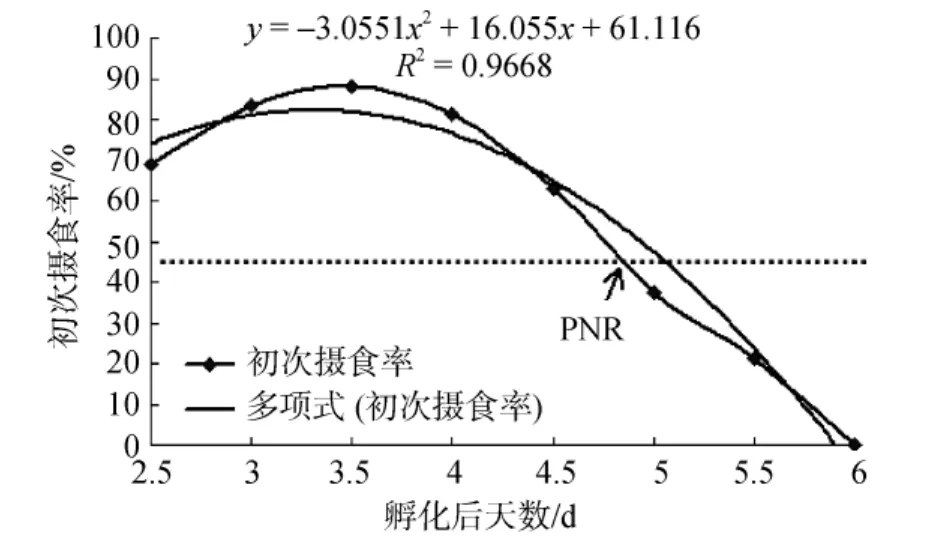
图2 条纹锯 初次摄食率的变化曲线Fig.2 Initial feeding rate of Centropristis striata
2.3 摄食强度变化

图3 条纹锯 摄食强度变化Fig.3 Change of number of rotifers feeding for Centropristis striata
条纹锯 仔鱼开口摄食后, 不同的饥饿时间初次摄食的强度有不同的变化(图3)。2 d时, 投喂轮虫2 h后, 解剖发现仔鱼肠道中未见有轮虫。2.5 d时摄食强度较低, 平均每尾仔鱼可摄食轮虫1.3个/尾, 随着仔鱼饥饿时间的延长, 摄食强度逐渐增加, 至3.5 d时摄食强度达到最大, 为 2.29个/尾, 解剖可见摄食强度最大的一尾仔鱼可摄食 6个轮虫, 之后摄食强度开始下降, 4 d时, 仔鱼平均摄食强度为1.69个/尾, 5 d时, 摄食强度继续下降为0.375个/尾, 至5.5 d时,仔鱼摄食强度降为0。
3 讨论与结论
3.1 条纹锯 仔鱼不同营养期与PNR
在对条纹锯 仔鱼的培养过程中, 营养是影响仔鱼生长、存活的最重要因素之一, 根据仔鱼对内源性营养物质卵黄囊和油球的吸收利用及仔鱼开口摄食的时间, 可以将条纹锯 对照组仔鱼生长分为:内源性营养期的快速生长、混合营养期的微弱负增长、外源性营养期的正常生长3个阶段; 试验组生长分为: 内源性营养期的快速生长、混合营养期的微弱负增长、可建立外源性摄食的负增长和不可建立外源性摄食的负增长4个阶段。
根据试验研究发现, 在(22.9±0.8)℃条件下, 0~2.5 d为内源性营养期, 2.5~4 d为混合营养期, 4 d之后为外源性营养期。由表2可知条纹锯 早期仔鱼的混合营养期仅为1.5 d, 仔鱼初次摄食到PNR的时间为2.5 d, 真鲷[24]混合营养期为3~4 d, 初次摄食至PNR时间为4~5 d, 黄鲷[25]混合营养期为3 d, 初次摄食至PNR时间为4~5 d, 牙鲆[24]混合营养期为1~2 d, 初次摄食至PNR时间为3~4 d, 点带石斑鱼[26]混合营养期为2 d, 初次摄食至PNR时间为2~3 d, 斜带石斑鱼[27]混合营养期为 2 d, 初次摄食至 PNR时间为 2.5 d, 相比其他海水鱼类, 条纹锯 必须在更短的时间内建立外源性营养关系, 否则只能面对死亡的后果。
3.2 卵黄囊仔鱼对内源性营养物质的利用
卵黄囊仔鱼对内源性营养的吸收可以分为两个部分: 对卵黄囊的吸收和对油球的吸收。仔鱼对卵黄囊的吸收主要发生在仔鱼孵化后到1 d的时间内, 可以吸收掉 89%的卵黄物质, 而在相同时间内, 卵黄囊仔鱼仅吸收了76%的油球物质, 由表1可见, 卵黄囊仔鱼对卵黄囊和油球的快速吸收促进了仔鱼的快速生长, 随着卵黄囊和油球的逐渐消耗, 仔鱼对内源性营养物质的吸收逐渐减慢, 仔鱼的生长速率也逐渐减慢。分析可知, 卵黄囊仔鱼对卵黄物质的吸收符合指数式:y=3276.7e–1.0684x(R2=0.9975), 而对油球的利用符合二项式:y=1.145x2–13.26x+37.714(R2= 0.9872), 可见卵黄囊仔鱼对卵黄物质和对油球的利用具有差异性, 进一步分析发现油球和卵黄物质体积比符合二项式:y=–0.0052x2+0.0431x–0.021(R2= 0.7698), 由图4分析可知, 卵黄物质和油球供应仔鱼生长过程中, 油球供应能量所占的比重先增大后减小, 可以推测: (1)条纹锯 对营养物质的吸收优先级为: 卵黄物质>油球, 脂肪做为一种重要的储能物质, 与蛋白质相比, 相同体积的脂肪能提供更多的能量, 因此仔鱼优先消耗卵黄物质而储存油球以减轻自身的重量和体积而实现节约能量的目的, 同时延后对油球的消耗可以延长仔鱼初次摄食至PNR的时间, 从而有更大的几率获取足够的食物。这与殷名称[28]所述的仔鱼从初次摄食到PNR的时间越长, 建立外源性营养关系的可能性就越大; 反之则越短相一致;(2)油球提供浮力, 有助于仔鱼快速游动以捕获猎物。
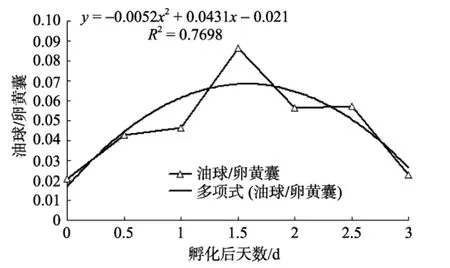
图4 条纹锯 油球、卵黄囊体积比的变化Fig.4 Change of volume ratio of yolk sac to oil globule of Centropristis striata

表2 部分海水鱼类混合营养期、初次摄食至PNR期时间比较Tab.2 Comparison of mixed nutrition stage time and initial feeding to PNR time
3.3 条纹锯 仔鱼最佳喂食时间
宋兵等[29]认为在人工养殖和投喂适口天然饵料的条件下, 饥饿并不是仔鱼死亡的主要原因, 过早或过量投喂才是生产中仔鱼大量死亡的真正原因。仔鱼在刚开口摄食至肠道贯通[30], 包括口与肠道贯通, 肠道与肛门贯通并开口于体外, 需要一定的时间, 若过早投喂会导致食物在胃中无法及时消化吸收导致仔鱼的死亡; 若过晚投喂, 仔鱼到达 PNR点之后无法及时建立外源性营养期也会导致仔鱼的死亡。本研究从摄食生态学角度探讨了条纹锯 早期仔鱼耐饥饿的特性, 认为在(22.9±0.8)℃条件下, 条纹锯 早期仔鱼最佳初次投喂时间为2.5~3.5 d。
[1] 雷霁霖, 卢继武. 前景广阔的海水养殖新品种美洲黑石斑鱼[J]. 农村百事通, 2007, 3: 40-87.
[2] 刘瑞棠. 引进美洲黑石斑鱼海水网箱养殖试验[J].河北渔业, 2011, 10: 28-29.
[3] 徐涛, 马甡, 王志军. 低温对条纹锯 生长及能量收支的影响[J]. 海洋科学, 2007, 31(4): 9-12.
[4] 曹金凤, 阳刚, 马甡, 等. 不同温度条件下条纹锯耗氧率与窒息点的初步研究[J]. 齐鲁渔业, 2009, 27(12): 1-3.
[5] 刘超, 曹金凤, 马牲, 等.条纹锯 对高温胁迫及胁迫后恢复方式适应的初步研究[J].海洋科学, 2012, 36(9): 54-58.
[6] 王波, 朱明远, 毛兴华.养殖新品种——美洲黑石斑鱼[J]. 河北渔业, 2003, 5: 26-27.
[7] 贾瑞锦, 王鲁, 赵从明, 等. 条纹锯 胚胎发育及卵黄囊仔鱼形态变化的观察[J]. 渔业科学进展, 2012, 33(4): 11-17.
[8] 林星.条纹锯 肌肉营养成分分析与品质评价[J]. 养殖与饲料, 2009, 9: 43-46.
[9] 阳钢, 刘超, 马甡, 等.条纹锯 对盐度胁迫的耐受力及淡水胁迫恢复的初步研究[J]. 海洋湖沼通报, 2011, 2: 73-78.
[10] 周明涛.引进美洲黑石斑鱼海水网箱养殖试验[J]. 现代渔业信息, 2011, 8: 28-29.
[11] 谢小军, 邓利, 张波.饥饿对鱼类生理生态学影响的研究进展[J]. 水生生物学报, 1998, 22(2): 181-187.
[12] 马建波, 茅沈丽, 梁桂洪, 等.杂交鳢仔鱼饥饿试验及不可逆点的确定[J]. 水生态学杂志, 2012, 3: 90-95.
[13] 黄权, 高峰, 孙晓雨, 等.短期饥饿胁迫对花羔红点鲑生长率和耗氧率的影响[J]. 吉林农业大学学报, 2012, 3: 324-328.
[14] 朱站英, 华雪铭, 于宁, 等.草鱼蛋白质和脂肪代谢对饥饿胁迫的响应[J]. 水产学报, 2012, 5: 756-763.
[15] 杨明生, 肖汉兵, 曾令兵, 等.温度对花斑副沙鳅仔鱼发育、摄食及不可逆点的影响[J]. 动物学杂志, 2012, 4: 114-120.
[16] Blaxter J, Hempel G. The influence of egg size on herring larvae [J]. Cons Int Explor Mer, 1963, 28(3): 211-240.
[17] Dou S, Masuda R, Tanaka M, et al. Feeding resumption, morphological changes and mortality during starvation in Japanese flounder larvae[J]. Fish Biology, 2002, 60(6): 1363-1380.
[18] 吴莹莹, 柳学周, 马爱军, 等.饥饿对半滑舌鳎仔鱼生长和发育的影响[J]. 海洋水产研究, 2006, 27(2): 87-93.
[19] 彭志兰, 柳敏海, 罗海忠, 等.条石鲷仔鱼饥饿试验及不可逆点的确定[J].水产科学, 2010, 3: 152-155.
[20] 宋国, 彭士明, 孙鹏, 等.饥饿与再投喂及投喂频率对条石鲷幼鱼生长和消化酶活力的影响[J].中国水产科学, 2011, 6: 1269-1277.
[21] 施兆鸿, 彭士明, 宋国, 等.饥饿与再投喂对条石鲷幼鱼组织和血清中主要代谢酶活性及糖元含量的影响[J].水产学报, 2012, 9: 1435-1442.
[22] 柳敏海, 施兆鸿, 陈波, 等.饥饿对点带石斑鱼饵料转换期仔鱼生长和发育的影响[J].海洋渔业, 2006, 28(4): 292-298.
[23] 张海发, 刘晓春, 刘付永忠, 等.饥饿对斜带石斑鱼卵黄囊期仔鱼摄食、存活及生长的影响[J]. 中山大学学报(自然科学版), 2009, 49(1): 51-55.
[24] 鲍宝龙, 苏锦祥, 殷名称.延迟投饵对真鲷、牙鲆仔鱼早期阶段摄食、存活及生长的影响[J].水产学报, 1998 , 22(1) : 33 -37.
[25] 夏连军, 施兆鸿, 陆建学.黄鲷仔鱼饥饿试验及不可逆点的确定[J]. 海洋渔业, 2004, 4: 286-290.
[26] 柳敏海, 施兆鸿, 陈波, 等.饥饿对点带石斑鱼饵料转换期仔鱼生长和发育的影响[J]. 海洋渔业, 2006, 4: 292-298.
[27] 张海发, 刘晓春, 刘付永忠, 等.饥饿对斜带石斑鱼卵黄囊期仔鱼摄食、存活及生长的影响[J]. 中山大学学报(自然科学版), 2009, 1: 51-55.
[28] 殷名称. 北海鲱卵黄囊期仔鱼的摄食能力和生长[J].海洋与湖沼, 1991, 6: 554-560.
[29] 宋兵, 陈立侨, 高露姣, 等.延迟投饵对杂交鲟仔鱼生长、存活和体成分的影响[J]. 中国水产科学, 2003, 10(3): 222-226.
[30] 骆小年, 李军, 刘刚, 等.鸭绿江水系唇胚胎发育、仔鱼饥饿及其不可逆点[J].中国水产科学, 2011, 6: 1278-1285.
(本文编辑: 谭雪静)
Effects of starvation on suriving, feeding and growth of the Yolk-sac larval ofCentropristis striata
JIA Rui-jin1,2, CHEN Chao1,2, KONG Xiang-di1,2, LI Yan-lu1,2, SONG Zhen-xin1,2, WU Lei-ming1,2, WANG Lu1, QU Jiang-bo3, ZHAO Cong-ming4, WU Jian5
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 2. College of Fisheries and Science, Shanghai Ocean University, Shanghai 201306, China; 3. Yantai Tianyuan Aquaculture Co., Ltd, Yantai 264000, China; 4. Tianjin Leadar Marine Resources Development Co, Ltd, Tianjin 300050, China; 5. Zhejiang Haishengyuan Biological Technology Co., Ltd., Taizhou 317600, China)
Jan., 25, 2013
Centropristis striata; larvae; starvation; feeding; the point-of-no-return(PNR)
In order to find the point-of-no-return of black seabass, the yolk-sac larval ofCentropristis striatawas used to explore the variation of suriving, feeding and growth at (22.9±0.8)℃ with salinity 30-32, DO≥5.0 mg/L, pH 7.8~8.2, and light intensity 40~100 Lx. The results showed that, the larval grouper started feeding at the 2nd day past hatching (dph) and the nutrition-mixture stage just lasting one day because the yolk sac and oil globules assimilated down at the 3rd dph. First feeding rate was 68.25% at the 3rd dph and reached the peak of 88.24% at the 3.5th dph. The initial feeding rate reduced to 37.5% which was as low as half of the peak when the larval grouper was 5 days old so the PNR is 5d. All of the fishes died when they were 6.5 days old. The analysis indicates that the endogenous vegetative stage of the grouper had no significant difference between control group and the experimental group. The mixotrophic stage total length had negative growth and a negative growth rate was significantly higher in the experimental group. In exogenous nutrition stage, the total length of experiment group continued to decline until they were died. So we can see, that the growth mode of the yolk sac larvae in control group could be divided into three stages: the rapid growth of endogenous nutrition stage, weak to negative growth of mixed nutrition stage and the normal growth exogenous nutrition stage. The growth mode of the experimental group could be divided into four stages: the rapid growth of endogenous nutrition stage, weak to negative growth of mixed nutrition stage, negative growth stage when the larva could be fed and the negative growth stage when the larva could not be fed. The key period of feeding of yolk-sac larval ofCentropristis striatais in 2nd-5th dph.
S96
A
1000-3096(2014)04-0044-06
10.11759/hykx20130125001
2013-01-25;
2013-09-09
科技部国际合作项目(2012DFA30360); 天津市滨海新区资助项目(201004070)
贾瑞锦(1988-), 男, 山东临沂人, 硕士研究生, 主要从事海水鱼类苗种繁育与养殖技术研究, 电话: 15666826817, E-mail: jiaruijin@163.com; 陈超, 通信作者, 电话, 13905328672, E-mail: ysfrichenchao@126.com
