GC法测定与右旋糖酐40联合用药时血浆中甘露醇的含量
2014-03-07王爱霞谭然然
金 青,王爱霞,李 冉,谭然然
(青岛科技大学化工学院,山东青岛266042)
GC法测定与右旋糖酐40联合用药时血浆中甘露醇的含量
金 青,王爱霞,李 冉,谭然然
(青岛科技大学化工学院,山东青岛266042)
目的采用气相色谱法研究联合用药时血浆中甘露醇的含量及右旋糖酐40对甘露醇的含量的影响。方法血浆样品经沉淀蛋白、衍生化处理后,考察血浆中加入甘露醇、右旋糖酐40及两者联合用药后溶质峰的保留时间。结果血浆中右旋糖酐40对甘露醇的测定无影响。结论该方法可用于甘露醇和右旋糖酐40联合用药时血浆中甘露醇含量的测定。
气相色谱法;右旋糖酐40;甘露醇
甘露醇是临床常用的脱水剂和利尿剂,其注射液作为高渗降压药,是临床抢救特别是脑部疾患抢救常用的一种药[1],具有降低颅内压药物所要求的降压快、疗效准确的特点,是目前控制脑水肿的首选脱水剂。小分子及低分子右旋糖酐可提高血浆胶体渗透压、扩充血容量、降低血液黏滞度、并使凝血因子相应稀释[2]。在临床上,甘露醇常与右旋糖酐40及丹参联合应用治疗心脑血管疾病,如脑梗死[3]。其在治疗组织损伤所导致的肢体肿胀方面,能有效地促进损伤愈合。由于右旋糖酐40的主要作用是作为血浆代用品进行血液扩容稀释,在体内起主要作用的药物是甘露醇,因此本实验建立了用GC法测定与右旋糖酐40联合用药时血浆中甘露醇的含量,并对右旋糖酐40是否对测定结果有影响做了探讨[4,5]。
1 实验部分
1.1 实验条件
1.1.1 仪器与试剂 GC-920气相色谱仪,上海海欣色谱仪器有限公司;FA1004N电子分析天平,上海精密科学仪器有限公司;MBE数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;小型离心机;可调微量移液器,上海宙辉生化仪器有限公司;RXZ-128智能型人工气候箱,宁波市科技园区新江南仪器有限公司。
甘露醇(药用,青岛翔宇海藻有限公司);右旋糖酐40(药用,山东金阳药业有限公司);木糖醇(天津市博迪化工有限公司);肝素(效价150 IU· mg-1,中国惠兴生化试剂有限公司);吡啶(天津市博迪化工有限公司);乙酸酐(广州齐昌化工有限公司);磺基水杨酸(分析纯,上海惠锦化工有限公司)。
1.1.2 色谱条件 SGE-AC-10毛细管色谱柱(60 m×0.32 mm,0.25μm);载气为氮气(流速约20 mL·min-1),氢气(流速约15 mL·min-1),空气(流速约250 mL·min-1);程序升温为:起始温度200℃保持1 min,以速率4℃·min-1升至240℃,保持20 min;进样量为1μL。
1.2 血浆中甘露醇含量测定的方法学建立
1.2.1 对照品及标准品溶液的制备 精密称取甘露醇对照品与木糖醇各0.500 0 g于50mL量瓶中,加蒸馏水溶解,稀释至刻度,配制成浓度为10 mg·mL-1的标准溶液。
1.2.2 样品试样制备 取家兔血浆1 mL,立即置于涂有肝素的尖底塑料离心管中,振荡使混合均匀。于3 500 rpm的转速下离心10min,用可调微量移液器吸取上层清液,即为血浆。取0.1 mL添加了适量甘露醇对照品溶液的血浆,加入内标物木糖醇对照液0.01 mL以及70 g·L-1的磺基水杨酸溶液0.1 mL漩涡混匀后,6 000 rpm离心10 min,除去蛋白,将上层清液全部取出,空气吹干后加入体积比为1∶1的吡啶、乙酸酐试剂100μL衍生化之后,振荡使之充分混合,于80℃下反应40 min,0.45μm微孔滤膜滤过后供进样用。
1.2.3 特异性实验 在上述色谱条件下,对空白溶剂、空白血浆、空白血浆加甘露醇对照品和静注甘露醇注射液后的血浆样品经试样制备方法处理后进样分析得到色谱图(见图1)。
1.2.4 标准曲线和定量范围 取1.5 mL尖底塑料离心管数个,加入0.5 mL空白血浆,再加入适量不同浓度的甘露醇标准系列溶液,使血浆药物浓度为0.05、0.1、0.2、0.5、1.0、2.0、5.0和10.0 mg·mL-1,加入内标后混匀,经样品试样制备项下方法处理后进样分析。以浓度(C)对甘露醇与内标峰面积的比值(F)进行线性回归(权重因子K/F,K=1.002 1)。
1.2.5 精密度实验 按“1.2.4”项下操作。制备甘露醇0.10、1.00和10.00 mg·mL-1三个浓度的质控样品,每浓度5样本,样本经衍生化之后进样,连续测定3 d。根据当日的工作曲线,计算QC样品的测得浓度,根据QC样品结果计算本法的精密度。
1.2.6 稳定性考察 取“1.2.5”项下0.10、1.00和10.00mg·mL-1QC样品各6份,分别在室温放置6 h及-20℃条件下放置,考察室温放置试验、冻融试验及60 d长期冻融试验的稳定性。
1.2.7 萃取回收率 取空白血浆数份,加入适量的甘露醇标准溶液混匀,使血浆中甘露醇的浓度分别为0.10、1.00和10.00 mg·mL-1。每个浓度5样本进样量1μL。计算测得的甘露醇浓度与加入甘露醇的质量浓度之比考察萃取回收率。
1.3 右旋糖酐40对该法测定甘露醇含量的影响
取空白血浆加右旋糖酐40,空白血浆加甘露醇及右旋糖酐40,静注甘露醇注射液后的血浆样品经处理后进样分析得到的色谱图(结果见图2)。通过对进样后的色谱图样品峰的保留时间进行比较,判定右旋糖酐40对甘露醇含量测定的影响。
2 结果与讨论
2.1 样品的前处理方案的选择 由于血药浓度一般较低,生物样品中的内源性物质及代谢产物较为复杂,往往会干扰样品测定。因此样品需经过分离、纯化和浓集等处理后再供测定。蛋白沉淀法具有简单和重复性好的优点,虽有带入分析的杂质较多、会稀释样品的进样浓度等缺点,但在处理方案中将样品在氮气流下吹干浓缩,可以提高分析方法的灵敏度。而后进行的衍生化反应是基于特殊的基团进行的,因而可以排除杂质干扰,提高灵敏度,更适合于本研究。因此,此方法提取稳定且合理,是一种较优的前处理方案。
2.2 衍生化方法的确定 根据参考文献[6]选用吡啶、双-三甲基硅烷乙酰胺、三甲基氯硅烷(2∶1∶1,V/V/V)作为硅烷衍生化的溶剂,经过在60℃下衍生化30 min后,气相检测效果不佳,峰面积大小不稳定。因而改用吡啶、乙酸酐(1∶1,V/V)进行酯化处理[7],出峰清晰,峰面积稳定。改变衍生化温度分别为60、70、80、90和100℃,固定衍生化的加热时间为20 min,取10mg·mL-1甘露醇标准溶液100 μL进行实验。实验结果表明,在60℃时,甘露醇与衍生化试剂不反应,随着加热温度逐渐升高,反应速度加快,衍生化产物的峰面积也随之增加,但温度过高时会影响产率,并且影响血浆样品的稳定性。故选择衍生化温度为80℃。然后固定衍生化温度为80℃,改变加热时间为10~60 min进行实验,当加热时间为30~60 min时,甘露醇的峰面积最大并保持稳定,所以选择加热时间为40 min。
2.3 甘露醇的含量测定方法学验证结果 本实验从专属性、线性范围和最低检出质量浓度、精密度、回收率、稳定性等方面对该法进行了方法学验证。甘露醇的保留时间约为13.0 min,内标的保留时间约为9.5 min,甘露醇峰与杂质峰可完全分离,血浆中杂质峰不干扰甘露醇的测定,本法具有较高的专属性(见图1);回归方程为C=0.995 0F-0.005 6(r2=0.999 9,n=5),线性范围0.05~10.0 mg·mL-1,甘露醇最低可检出质量浓度为0.02 mg·mL-1(以信噪比大于3计);回收率平均值为99.03%,且RSD均小于3%,测得结果具有较高的重现性(见表1);日内和日间RSD均小于15.0%,精密度良好;室温放置试验、冻融试验和长期稳定性试验测定值和添加值的相对误差(R.E.%)均小于15%,说明分析测试过程中样品较为稳定。
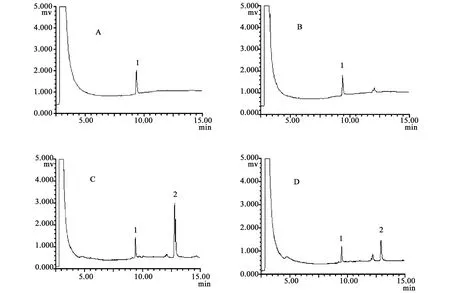
图1 色谱图
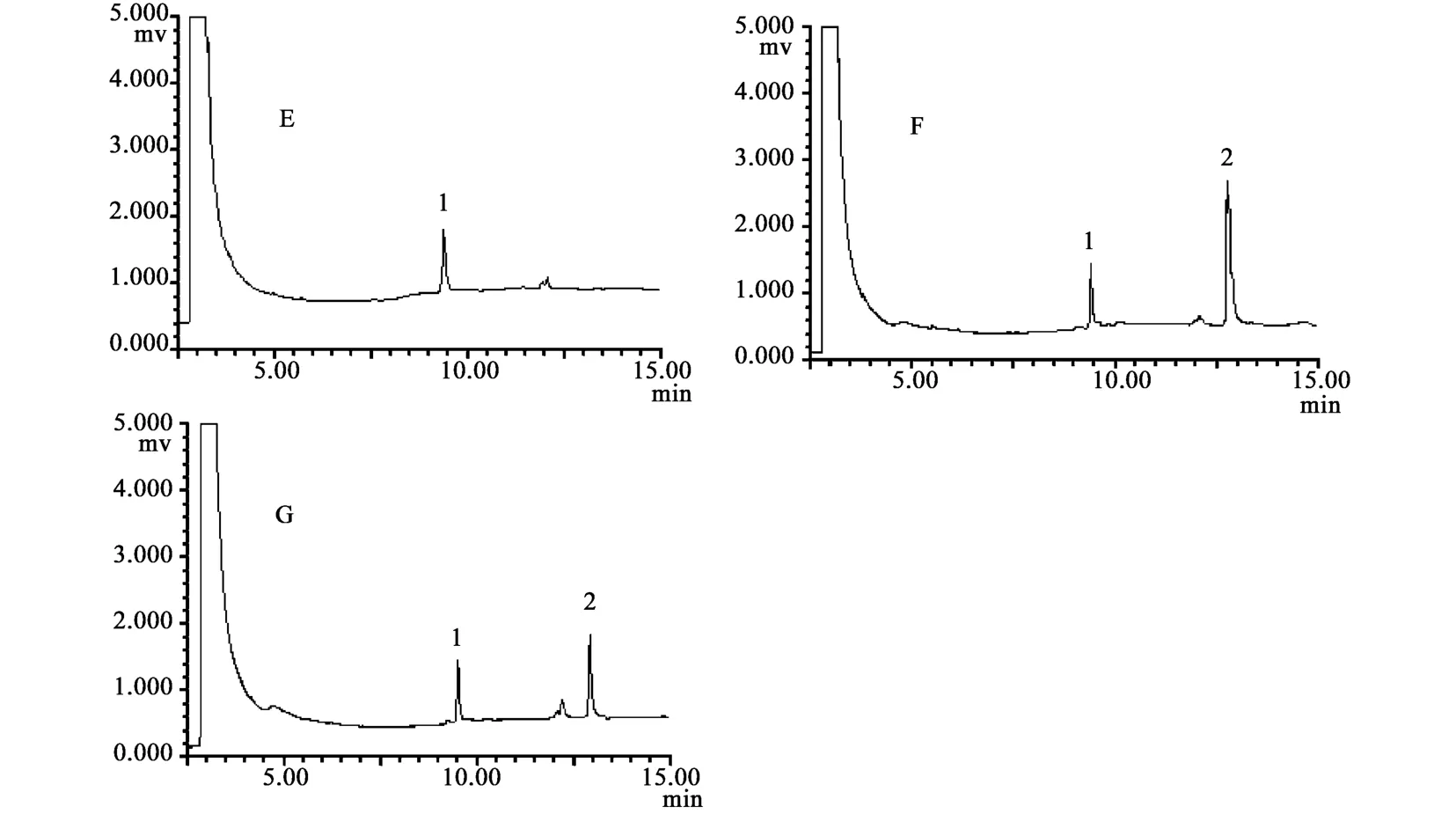
图2 色谱图
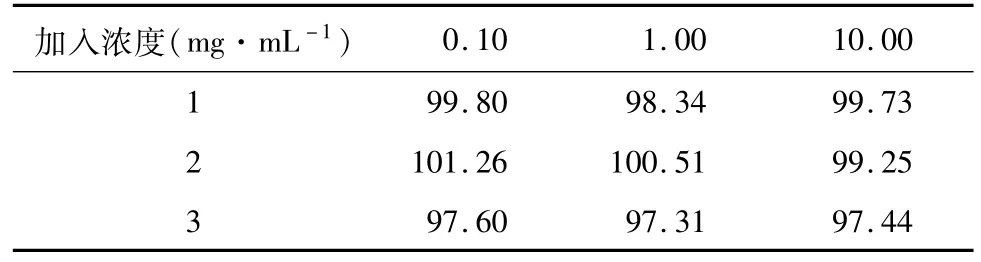
表1 萃取回收率(%)
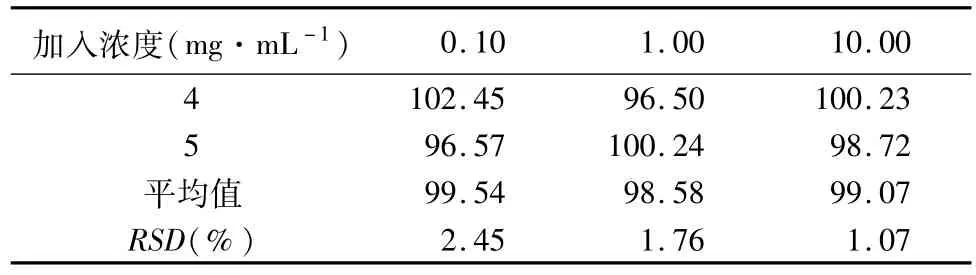
续表1:
2.4 右旋糖酐40对该法测定甘露醇含量的影响实验结果 由色谱图可知,血浆中的右旋糖酐没有出峰,加入右旋糖酐40前后甘露醇的保留时间相同。表明血浆中的右旋糖酐40并不影响甘露醇的含量测定结果。
3 结论
本实验方法经验证符合生物样品分析要求,且右旋糖酐40不影响甘露醇的测定结果。该方法可用于甘露醇和右旋糖酐40联合用药时血浆中甘露醇的含量测定。
[1]王尧,范佳,刚晓坤,等.脑出血治疗中甘露醇使用的临床体会[J].中风与神经疾病杂志,2010,10:946-947.
[2]苏华燕,戚永娟,梁开.低分子右旋糖酐治疗肾病综合征疗效的分析[J].中国校医,2007,21(4):F0003.
[3]陈淑玲.复方丹参低分子右旋糖酐甘露醇联用治疗脑梗塞60例[J].河北医学,2007,13(2):234-236.
[4]王和兴,黎源倩,李磊.保健食品中甘露醇的毛细管气相色谱分析[J].四川大学学报(医学版),2006,37(3):480-483.
[5]王佩,吴锡铭.衍生化毛细管气相色谱法测定人尿液中甘露醇和乳果糖[J].中国现代应用药学杂志.2001,18(5):391-393.
[6]Laker MF,Mount JN.Mannitol Estimation in Biological Fluids by Gas-Liquid Chromatography of Trimethylsilyl Derivatives[J].Clin Chem,1980,26(3):441-443.
[7]李冉,金青,唐延甜.低分子右旋糖酐对甘露醇注射液在家兔体内药动学的影响[J].西北药学杂志,2012,27(3):248-251.
Determ ination of themannitol in plasma by GC when combined w ith Dextran 40
JIN Qing,WANG Ai-xia,LIRan,TAN Ran-ran
(College of Chemical Engineering,Qingdao University of Science and Technology,Qingdao 266042,China)
ObjectiveTo study the effect of Dextran 40 on the molcular in plasma by GC when they were combined.MethodsAfter the plasma sample was precipitated protein and derivatized,comparative the retention time of the Mannitol,Dextran 40 and the combination.ResultsThe chromatograms show that Dextran 40 had no effect on the determination of mannitol.ConclusionThis method can be used for the determination of mannitol in plasma when combination with Dextran 40.
GC;Dextran 40;Mannitol
R927.2
A
2095-5375(2014)02-0090-004
金青,女,副教授,硕士生导师,药物新剂型的研究,E-mail:jinqing_mail@qust.edu.cn
