氧化铁纳米粒子神经干细胞标记技术的比较研究
2014-03-07祥LIXiang
李 祥LI Xiang
朱文珍2ZHU Wenzhen
魏 黎3WEI Li
氧化铁纳米粒子神经干细胞标记技术的比较研究
李 祥1LI Xiang
朱文珍2ZHU Wenzhen
魏 黎3WEI Li
目的探讨常见氧化铁纳米粒子几种神经干细胞标记技术的标记效率。材料与方法使用超顺磁性氧化铁纳米粒子(SPIO)和超微超顺磁性氧化铁纳米粒子(USPIO)以25 μg Fe/ml分别单独标记、与多聚赖氨酸(PLL)及脂质体联合标记神经干细胞,以未标记细胞做对照,采用普鲁士蓝染色评价细胞标记率,并采用4.7T MRI T2WI多回波序列测量T2弛豫率(R2)评价细胞内的铁摄取量,比较各组R2的差异。结果①普鲁士蓝染色结果:SPIO及USPIO单独标记组标记率为60%~70%,低于联合标记组的100%;②MRI结果:未标记细胞R2为(2.10±0.11)/s,SPIO、USPIO单独标记组细胞R2分别为(3.39±0.21)/s、(3.16±0.32)/s,SPIO-脂质体联合标记组及USPIO-脂质体联合标记组R2分别为(4.03±0.25)/s、(3.61±0.32)/s,SPIOPLL联合标记组及USPIO-PLL联合标记组R2分别为(5.38±0.52)/s、(4.44±0.35)/s,SPIO、USPIO与PLL联合标记组R2大于SPIO、USPIO与脂质体联合标记组(P<0.05);而与脂质体联合标记组R2大于单独标记组(P<0.05);SPIO与USPIO单独标记细胞时R2差异无统计学意义(P>0.05),SPIO与脂质体或PLL联合标记时R2高于USPIO(P<0.05)。结论SPIO、USPIO单独标记及与PLL、脂质体联合标记均可以成功标记神经干细胞,提高R2,其中SPIO与PLL联合标记效率最高。
干细胞;海马;铁化合物;氧化物;纳米粒子;磁共振成像;染色与标记;大鼠
随着细胞移植治疗各种疾病临床应用的不断深入,MRI在体动态监测成为一个重要的课题。通过信号的改变区分移植细胞簇与宿主细胞成为研究热点,超顺磁性氧化铁纳米粒子(SPIO)和超微超顺磁性氧化铁纳米粒子(USPIO)作为MRI的一种阴性对比剂具有良好的标记效果及组织相容性,标记程序简单易行,逐渐成为标记各类治疗细胞的主流分子探针[1-5]。常用的标记方法包括使用多聚赖氨酸(PLL)或脂质体转染技术,所使用的氧化铁纳米粒子主要分为SPIO和USPIO。本实验以神经干细胞作为目标细胞,对目前常用的标记方法及MRI对比剂进行标记效率的对比研究,为临床细胞治疗选择高效的标记技术及标记探针提供实验依据。
1 材料与方法
1.1 鼠神经干细胞培养 采用Reynoldsh和Weiss创立的neruosphere法,神经干细胞取自新生SD大鼠脑的海马结构,神经干细胞条件培养基(加入bFGF 20 ng/ml、EGF 20 ng/ml、B27 20 μl/ml DMEM/F12)传代培养,具体方法和步骤见参考文献[6]。
1.2 分组 分别将SPIO(直径约50 nm,法国Guerbet公司惠赠)及USPIO(直径约20 nm,北京化学所惠赠)用神经干细胞培养基稀释成25 μg Fe/ml,等体积分为单独标记组、PLL联合标记组和脂质体联合标记组,后两组分别加入PLL(按Fe∶PLL为1∶0.03,Sigma公司)和脂质体(5 μl/ml,Gibco公司)。3组细胞同时置于37℃孵育1 h制成标记培养基(共6组),6组标记培养基分别加入神经干细胞2×106个/ml悬浮培养12 h后提取细胞,用D-Hank液洗涤3遍,无铁培养基继续培养2 d备用。同批神经干细胞用无铁培养基悬浮培养作为对照。
1.3 实验方法
1.3.1 神经干细胞标记率测量 将6组标记的神经干细胞移入6孔板中培养,放入100 μg/ml PLL包被的盖玻片,1 h后待细胞充分贴壁后取出盖玻片,进行普鲁士蓝染色,于倒置相差显微镜下采用高倍视野观察。细胞染色呈红色,对比剂含铁染色呈蓝色。细胞质内见蓝色颗粒为普鲁士蓝染色阳性细胞。标记率(%)=细胞染色阳性数/细胞总数×100%。蓝色颗粒越多说明细胞内对比剂摄取量越大。阳性细胞计数及细胞内蓝色颗粒量对比由2名医师分别独立观察并做出判断,并取得一致结果。
1.3.2 神经干细胞对比剂摄取量 提取6组标记的干细胞及两组同批未标记的神经干细胞,调整细胞浓度为5×105个/ml,悬于PBS中,采用4.7T超高场强MRI仪(Brucker)行T2WI多回波扫描序列,快速自旋回波序列:TR 4400 ms,TE分别为20、100、180、300 ms(4个回波),层厚1.5 mm,层间距1 mm,矩阵64×64,激励次数4。T2弛豫时间计算公式:y=A+C*exp(-t/T2),其中t是回波时间,y是时间为t时测量的信号强度,A是背景噪声,C*是质子密度信号强度。T2弛豫率(R2)的计算公式:R2=1/T2。
1.4 统计学方法 采用SPSS 13.0软件,3种标记技术组与对照组间R2比较采用单因素方差分析,SPIO与USPIO组R2比较采用成组t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 神经干细胞标记率测量及细胞内对比剂摄取量的镜下观察 SPIO单独标记组及USPIO单独标记组细胞标记率均为60%~70%,两组间标记率无显著差异;各联合标记组细胞标记率均达100%。与单独标记组(图1A、B)相比,各联合标记组(图1C~F)胞质内蓝染颗粒明显较多,说明细胞铁摄取较多;但SPIOPLL联合标记组(图1E)、USPIO-PLL联合标记组(图1F)、SPIO-脂质体联合标记组(图1C)、USPIO-脂质体联合标记组(图1D)之间相比,细胞内蓝染颗粒无显著差异。
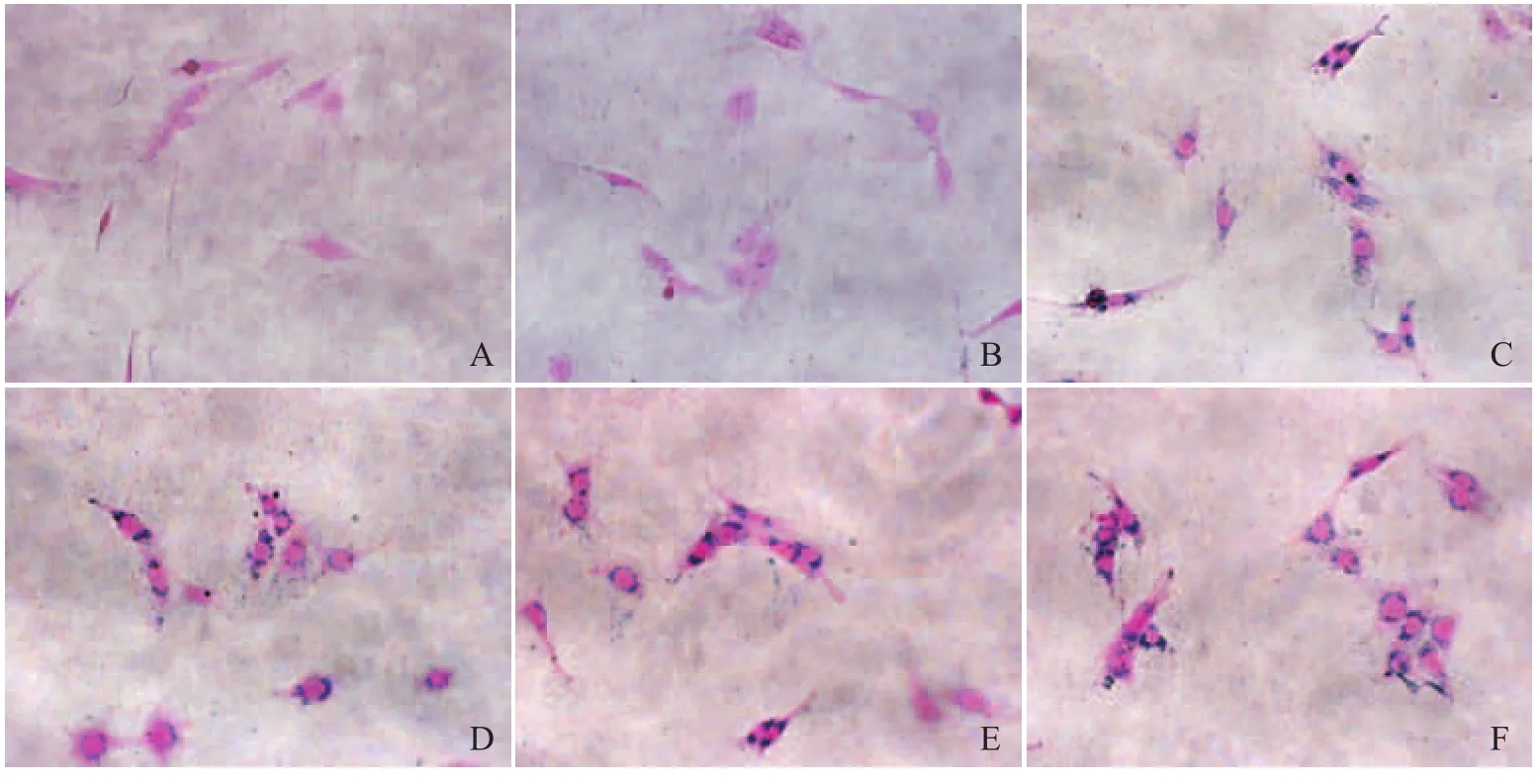
图1 贴壁标记的神经干细胞普鲁士蓝染色结果。A. SPIO单独标记组;B. USPIO单独标记组;C. SPIO-脂质体联合标记组;D. USPIO-脂质体联合标记组;E. SPIO-PLL联合标记组;F. USPIO-PLL联合标记组。神经干细胞染色呈红色,铁成分染色呈蓝色。标记细胞的胞质内见多少不等的蓝染铁颗粒(×400)
2.2 标记神经干细胞的体外4.7T MRI及弛豫率测量根据多回波T2WI成像显示的T2信号衰减程度提示各组含铁量大小关系为:PLL联合标记组>脂质体联合标记组>各单独标记组。对照组不含铁,信号衰减不明显,见图2。
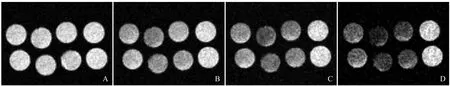
图2 标记细胞及未标记细胞4.7T MRI多回波T2WI,TE分别为20 ms(A)、100 ms(B)、180 ms(C)、300 ms(D)。A~D中由左至右分别为单独标记、PLL联合标记、脂质体联合标记、未标记的神经干细胞,上排为SPIO组,下排为USPIO组。随着TE增加,各标记组信号均有不同程度的衰减,PLL联合标记组信号衰减最明显,脂质体联合标记组次之,单独标记组信号衰减程度最低。SPIO组及USPIO组信号衰减变化规律相似
各标记组及对照组T2及R2见表1。SPIO和USPIO各标记组与对照组T2及R2比较,差异均有统计学意义(P<0.05),提示2种对比剂3种标记技术均可以成功标记细胞。3种标记技术组间R2比较:PLL联合标记组>脂质体联合标记组(P<0.05);脂质体联合标记组>单独标记组(P<0.05),提示3种标记技术细胞内铁摄取量差异均有统计学意义,以PLL联合标记组细胞内铁摄取量最高。SPIO和USPIO单独标记细胞时标记细胞的R2差异无统计学意义(P>0.05),而与脂质体或PLL联合标记时,SPIO组R2均大于USPIO组(P<0.05),提示以脂质体或PLL作为载体标记细胞时,SPIO的标记效率要高于USPIO。

表1 SPIO和USPIO各标记组及对照组T2及R2比较
3 讨论
细胞的氧化铁粒子标记研究有很多,多数研究使用一种粒子(SPIO或USPIO)结合一种载体(脂质体或PLL)标记一种目标细胞,研究重点在于通过权衡细胞标记后活性与细胞标记后MRI图像对比度来明确所研究细胞的最佳铁标记浓度[2,3,5,7-10]。目前尚未见关于选择氧化铁粒子及标记方法的研究报道。由于各研究所选择的研究细胞、细胞标记时间、磁共振场强及成像细胞浓度不同等因素,无法通过研究间的数据对比来判断氧化铁粒子及标记方法的优越性。因此,本实验设计在同一实验条件下对2种氧化铁粒子及3种标记方法进行对比研究,结果表明对比剂SPIO、USPIO与3种标记方法组合的6种细胞标记方案中,SPIO-PLL联合标记方案的体外细胞标记效率最高。
SPIO、USPIO细胞标记效率的重要指标是细胞内铁含量的测量,目前最准确的测量方法是原子发射光谱法。本实验中采用弛豫率反映细胞内的铁含量。弛豫是反映顺磁性物质(如SPIO、USPIO)对质子弛豫时间影响大小的一个MRI指标。一种顺磁性物质缩短质子弛豫时间的能力越强,弛豫率就越大,MRI图像上的信号差别越大。MRI多回波T2WI成像获得的R2与原子发射光谱法测量的细胞内铁含量呈显著正相关(r>0.78[8];r=0.92~0.99[11])。因此,弛豫率可以作为评价细胞内铁含量的一个客观、无创的量化指标。
Oude Engberink等[1]比较研究了SPIO(150 nm)和USPIO(30 nm)在不同铁浓度下单独标记单核细胞的R2,发现SPIO标记的单核细胞R2高于USPIO标记的单核细胞。Matuszewski等[12]使用不同直径(17、65、150 nm)的SPIO单独标记肺癌细胞、乳腺癌细胞、纤维肉瘤细胞及白细胞,并采用原子发射光谱法直接测量细胞内的铁摄取量,发现150 nm SPIO粒子标记细胞内铁量最多。以上研究结果提示氧化铁纳米粒子直径越大,越易于细胞摄取。本实验中,SPIO(50 nm)及USPIO(20 nm)单独标记神经干细胞时标记细胞的R2差异无统计学意义(P>0.05),这可能与神经干细胞的胞吞能力弱于单核细胞及肿瘤细胞有关。然而,与PLL及脂质体联合标记时SPIO组R2均大于USPIO组(P<0.05),基于Oude Engberink等[1]和Matuszewski等[12]发现的粒子直径现象,考虑其可能原因为SPIO-PLL及SPIO-脂质体复合物直径大于USPIO-PLL及USPIO-脂质体复合物。 本实验结果显示,PLL和脂质体均显著提高了SPIO及USPIO的细胞摄取,与既往研究报道结果类似:Jiang等[13]标记前列腺癌细胞时发现PLL可以提高SPIO的摄取量;Jiao等[14]标记胰岛细胞时发现脂质体可以提高SPIO的细胞摄取。SPIO及USPIO单独标记细胞的效率较低(低标记率及低R2值)可能是由于氧化铁纳米粒子带有负电荷,细胞膜上没有相应的受体,既不能通过细胞膜通道或载体蛋白以简单扩散的方式进入细胞,也很难通过胞吞作用进入细胞。而PLL和脂质体均为基因转染技术中常用的工具,用来将USPIO或SPIO导入细胞的原理与转染相似。PLL是一种多聚阳离子,可以与带负电荷的USPIO或SPIO形成牢固、稳定的非共价电性结合[7,15],细胞膜上有其特异性受体,可以通过受体介导的内吞作用进入细胞[7,9]。脂质体是由磷脂胆固醇等为膜材包合而成的。磷脂分散在水中时能形成多层微囊,且每层均为脂质双分子层,各层之间被水相隔开,与细胞膜的结构相似,通过与细胞膜融合将其内容物传递到靶细胞中[16],作为一种可供选择的载体具有无毒、无免疫原性、可生物降解的特点[10,16]。因此,PLL和脂质体均可以作为高效的物质运输载体将SPIO及USPIO导入细胞。
尽管PLL和脂质体均已广泛用于USPIO、SPIO的细胞标记研究,但两者的标记效率的对比研究尚未见报道。本实验结果显示,PLL联合标记组和脂质体联合标记组的细胞标记率均为100%,但PLL联合标记组的R2高于脂质体联合标记组,提示PLL联合标记进入细胞内的氧化铁颗粒更多,标记效率更高。受体介导的内吞作用是细胞摄入大分子蛋白质、糖类等重要物质的主要方式,效率较高;而脂质体途径并不是细胞转运物质的常规方式,因此PLL联合标记组细胞R2大于脂质体标记组可能与此有关。另外,除PLL受体外,细胞膜上还有多种特异性的蛋白受体,可以作为受体介导途径,如将SPIO或USPIO与转铁蛋白结合标记白细胞及肝细胞[17,18],与HIV-Tat蛋白结合标记胶质瘤细胞及胚胎干细胞[19,20],与鱼精蛋白结合标记肿瘤细胞、T细胞及造血干细胞[21-23]等均取得了很好的细胞标记效果,提示通过细胞膜受体介导的途径将SPIO及USPIO转运至细胞内是一种高效的标记技术。本实验对比了SPIO及USPIO的3种标记方法的标记效率,结果仅说明SPIO-PLL联合标记方法的标记效率最高,而标记方案对研究细胞的增殖活性、分化能力及细胞功能的影响、各标记方案之间的差异尚有待进一步深入研究,从而为临床选择治疗细胞的体外标记方案提供更实用可靠的实验依据。
[1] Oude Engberink RD, van der Pol SM, Döpp EA, et al. Comparison of SPIO and USPIO for in vitro labeling of human monocytes: MR detection and cell function. Radiology, 2007, 243(2): 467-474.
[2] Nelson GN, Roh JD, Mirensky TL, et al. Initial evaluation of the use of USPIO cell labeling and noninvasive MR monitoring of human tissue-engineered vascular grafts in vivo. FASEB J, 2008, 22(11): 3888-3895.
[3] Addicott B, Willman M, Rodriguez J, et al. Mesenchymal stem cell labeling and in vitro MR characterization at 1.5 T of new SPIO contrast agent: Molday ION Rhodamine-BTM. Contrast Media Mol Imaging, 2011, 6(1): 7-18.
[4] Ramaswamy S, Schornack PA, Smelko AG, et al. Superparamagnetic iron oxide (SPIO) labeling effciency and subsequent MRI tracking of native cell populations pertinent to pulmonary heart valve tissue engineering studies. NMR Biomed, 2012, 25(3): 410-417.
[5] Cromer Berman SM, Kshitiz, Wang CJ, et al. Cell motility of neural stem cells is reduced after SPIO-labeling, which is mitigated after exocytosis. Magn Reson Med, 2013, 69(1): 255-262.
[6] 朱文珍, 李祥, 漆剑频, 等. 神经干细胞超顺磁性氧化铁标记及体内外MRI示踪. 中华放射学杂志, 2006, 40(2): 160-164.
[7] Arbab AS, Bashaw LA, Miller BR, et al. Intracytoplasmic tagging of cells with ferumoxides and transfection agent for cellular magnetic resonance imaging after cell transplantation: methods and techniques. Transplantation, 2003, 76(7): 1123-1130.
[8] Ittrich H, Lange C, Dahnke H, et al. Labeling of mesenchymal stem cells with different superparamagnetic particles of iron oxide and detectability with MRI at 3T. Rofo, 2005, 177(8): 1151-1163.
[9] 张瑞平, 刘强, 李晶, 等. 超顺磁性氧化铁标记鼠骨髓间充质干细胞的体外MR成像研究. 中国医学影像学杂志, 2009, 17(4): 257-261.
[10] 赵春生, 李俊峡, 张卓立, 等. 成簇成肌细胞的磁共振成像观察. 中国医学影像学杂志, 2011, 19(1): 19-23.
[11] Kuhlpeter R, Dahnke H, Matuszewski L, et al. R2 and R2* mapping for sensing cell-bound superparamagnetic nanoparticles: in vitro and murine in vivo testing. Radiology, 2007, 245(2): 449-457.
[12] Matuszewski L, Persigehl T, Wall A, et al. Cell tagging with clinically approved iron oxides: feasibility and effect of lipofection, particle size, and surface coating on labeling effciency. Radiology, 2005, 235(1):155-161.
[13] Jiang J, Chen Y, Zhu Y, et al. Efficient in vitro labeling of human prostate cancer cells with superparamagnetic iron oxide nanoparticles. Cancer Biother Radiopharm, 2011, 26(4): 461-467.
[14] Jiao Y, Peng ZH, Zhang JY, et al. Liposome-mediated transfer can improve the efficacy of islet labeling with superparamagnetic iron oxide. Transplant Proc, 2008, 40(10): 3615-3618.
[15] Bulte JW, Arbab AS, Douglas T, et al. Preparation of magnetically labeled cells for cell tracking by magnetic resonance imaging. Methods Enzymol, 2004, 386: 275-299.
[16] Martina MS, Fortin JP, Menager C, et al. Generation of superparamagnetic liposomes revealed as highly efficient MRI contrast agents for in vivo imaging. J Am Chem Soc, 2005, 127(30): 10676-10685.
[17] Zhang CY, Lu J, Tsourkas A. Iron chelator-based amplifcation strategy for improved targeting of transferrin receptor with SPIO. Cancer Biol Ther, 2008, 7(6): 889-895.
[18] Raschzok N, Muecke DA, Adonopoulou MK, et al. In vitro evaluation of magnetic resonance imaging contrast agents for labeling human liver cells: implications for clinical translation. Mole Imaging Biol, 2011, 13(4): 613-622.
[19] Martin AL, Bernas LM, Rutt BK, et al. Enhanced cell uptake of superparamagnetic iron oxide nanoparticles functionalized with dendritic guanidines. Bioconjug Chem, 2008, 19(12): 2375-2384.
[20] Gao B, Fu WG, Dong ZH, et al. Functional endothelial cells derived from embryonic stem cells labeled with HIV transactivator peptide-conjugated superparamagnetic nanoparticles. Chin Med J (Engl), 2011, 124(2): 298-303.
[21] Wang Z, Cuschieri A. Tumour cell labelling by magnetic nanoparticles with determination of intracellular iron content and spatial distribution of the intracellular iron. Int J Mol Sci, 2013, 14(5): 9111-9125.
[22] Siegers GM, Ribot EJ, Keating A, et al. Extensive expansion of primary human gamma delta T cells generates cytotoxic effector memory cells that can be labeled with Feraheme for cellular MRI. Cancer Immunol Immunother, 2013, 62(3): 571-583.
[23] England TJ, Bath PM, Abaei M, et al. Hematopoietic stem cell (CD34+) uptake of superparamagnetic iron oxide is enhanced by but not dependent on a transfection agent. Cytotherapy, 2013, 15(3): 384-390.
(责任编辑 张春辉)
Comparison of Labeling Technique of Neural Stem Cells with Iron Oxide Particles
PurposeTo evaluate the labeling efficiency of different methods for labeling neural stem cells with two iron oxide particles.Materials and MethodsApart from unlabelled cells (control group), the other rat neural stem cells were incubated with superparamagnetic iron oxide (SPIO) or ultra small superparamagnetic iron oxide (USPIO), iron oxide-polylysine (PLL) complex or iron oxide-liposome complex (25 μg Fe/ml). The labeling rate was evaluated by Prussian blue staining and the amount of iron oxide particles uptake was measured by T2 relaxation rate (R2) derived from T2-weighted multi-echo sequences on 4.7T MRI. R2 in different groups by using different labeling methods was also compared.Results①Prussian blue staining: the labeling rates in groups labeled with SPIO or USPIO alone were both lower than that in the group labeled with complex of iron oxide-PLL or iron oxide-liposome (60%-70% vs 100%).② MRI results: R2 in control group was (2.10±0.11)/s; R2 in SPIO group and USPIO group were (3.39±0.21)/s and (3.16±0.32)/s, respectively; those labeled with SPIO-liposome and USPIO-liposome were (4.03±0.25)/s and (3.61±0.32)/s, respectively; and those with SPIO-PLL and USPIO-PLL were (5.38±0.52)/s and (4.44±0.35)/s, respectively. The R2 in SPIO-PLL and USPIO-PLL labeling groups was higher than that of SPIO-liposome and USPIO-liposome labeling groups (P<0.05), and the latter were higher than that of SPIO and USPIO groups (P<0.05); the R2 in groups of SPIO labeled with liposome or PLL was both higher than that of USPIO groups (P<0.05) whereas R2 in SPIO and USPIO groups showed no statistical difference (P>0.05).ConclusionNeural stem cells can be labeled effectively with SPIO or USPIO in three labeling methods: iron oxide alone, iron oxide-PLL and iron oxide-liposome to improve R2, among which SPIO-PLL labeling method is with the highest labeling effciency.
Stem cells; Hippocampus; Iron compounds; Oxides; Nanoparticles; Magnetic resonance imaging; Staining and labeling; Rats
1. 郑州大学附属肿瘤医院(河南省肿瘤医院)放射科 河南郑州 450008
2. 华中科技大学同济医学院附属同济医院放射科 湖北武汉 430030
3. 中国科学院武汉物理与数学研究所波谱与原子分子物理国家重点实验室 湖北武汉430071
李 祥
Department of Radiology, the Affliated
Cancer Hospital of Zhengzhou University,
Zhengzhou 450008, China
Address Correspondence to: LI Xiang
E-mail: lixiang_x@163.com
R-33;R445.2
2013-09-07
修回日期:2013-12-21
中国医学影像学杂志
2014年 第22卷 第1期:7-11
Chinese Journal of Medical Imaging
2014 Volume 22(1): 7-11
10.3969/j.issn.1005-5185.2014.01.003
