低功率超声辐照微泡造影剂对大鼠前列腺内伊文思蓝浓度的影响
2014-03-07陈江川CHENJiangchuan
陈江川CHEN Jiangchuan
刘永亮1LIU Yongliang
刘 政2LIU Zheng
叶 钢1YE Gang
易善红1YI Shanhong
低功率超声辐照微泡造影剂对大鼠前列腺内伊文思蓝浓度的影响
陈江川1CHEN Jiangchuan
刘永亮1LIU Yongliang
刘 政2LIU Zheng
叶 钢1YE Gang
易善红1YI Shanhong
目的探讨低功率超声辐照微泡造影剂提高前列腺内的药物浓度的价值。材料与方法选取成年远交群(SD)雄性大鼠60只,按抽签法分为对照组、伊文思蓝(EB)组、微泡组、同时辐照组及先行辐照组,每组各12只。对照组给予生理盐水10 ml/kg;EB组给予EB 50 mg/kg;微泡组给予微泡造影剂0.1 ml/kg;同时辐照组先给予EB 50 mg/kg,超声辐照5 min后,再给予微泡造影剂0.1 ml/kg;先行辐照组给予微泡造影剂0.1 ml/kg后,超声局部间歇辐照前列腺5 min,30 min再给予EB 50 mg/kg。实验结束后取前列腺组织进行病理观察,并制备前列腺组织匀浆测量EB浓度。结果EB组大鼠前列腺内EB浓度高于对照组及微泡组,差异有统计学意义(t=4.157、4.357, P<0.01);同时辐照组大鼠前列腺内EB浓度高于EB组,差异有统计学意义(t=2.438, P<0.05);先行辐照组大鼠前列腺内EB浓度明显低于同时辐照组,差异有统计学意义(t=2.761, P<0.05);先行辐照组与EB组EB浓度差异无统计学意义(t=0.684, P>0.05)。结论低功率超声联合微泡造影剂可以明显提高前列腺组织EB药物浓度。
前列腺;超声检查;造影剂;微泡;伊文思蓝;模型,动物;大鼠
前列腺炎是我国发病率较高的男性生殖系统感染性疾病之一,占泌尿外科男性门诊疾病的25%~30%,且发病率有上升趋势[1]。临床对前列腺炎的治疗以药物治疗为主,但是血-前列腺屏障使常规的药物较难在前列腺内达到有效治疗浓度,影响其临床效果[2]。超声空化效应可以使细胞膜通透性增高[3]。超声微泡造影剂作为携带药物或治疗性基因的载体,可以强化超声空化效应[4]。本研究利用低剂量超声联合微泡造影剂提高前列腺细胞内的药物浓度,为超声微泡应用于慢性前列腺炎的治疗提供依据。
1 材料与方法
1.1 实验动物及材料 成年远交群(sprague dawley, SD)大鼠60只,雄性,清洁级,体重350~450 g,由第三军医大学动物实验中心提供。采用抽签法分为对照组、伊文思蓝(EB)组、微泡组、同时辐照组、先行辐照组5组,每组各12只。EB购自南京美瑞制药有限公司。低功率超声治疗仪由第三军医大学附属新桥医院超声科自行研制。脂氟显脂质微泡由实验室自行研制,外观为乳白色凝乳状微泡悬浮液,核心气体为全氟丙烷,微泡浓度约为1×107/ml,平均粒径2 μm。采用1%戊巴比妥钠腹腔注射麻醉大鼠,剂量1 ml/kg,戊巴比妥钠购自国药集团化学试剂有限公司。
1.2 动物模型的建立 将EB用蒸馏水溶解为2%的过滤灭菌溶液后注射给药。对照组经鼠尾静脉注射生理盐水10 ml/kg;EB组经鼠尾静脉注射EB 50 mg/kg;微泡组经鼠尾静脉注射微泡造影剂0.1 ml/kg;同时辐照组先经鼠尾静脉注射EB 50 mg/kg,5 min后注射微泡造影剂0.1 ml/kg,而后行超声辐照干预实验;先行辐照组先经鼠尾静脉注射微泡造影剂0.1 ml/kg,间歇辐照前列腺局部5 min,30 min后注射EB 50 mg/kg。
1.3 超声检查 采用第三军医大学附属新桥医院超声科自行研制的超声诊断仪,探头频率1.2 MHz。以大鼠下腹部区域为声窗,待屏幕中显示大鼠前列腺影像后固定超声切面。辐照时间均为5 min,峰值负压为4.5 MPa,发射占空比为0.37%,平均声强0.4 W/cm。1.4 病理检查 在治疗结束6 h后开胸,自主动脉灌注生理盐水冲洗,压力为100~120 cmH2O(100 cm H2O=9.8 kPa),直至从剪开的大鼠右心房内流出的液体为无色。随即开腹取出前列腺组织,以10%福尔马林溶液固定24 h,常规石蜡包埋切片,并用HE染色,每个标本切6张切片,切片厚度为5 μm,光镜下观察大鼠的前列腺组织。
1.5 前列腺组织中EB含量的测定 在实验结束6 h后处死大鼠,取出大鼠前列腺,将其重后切成小块置于10 ml的甲酰胺溶液中,置于37℃恒温水浴箱中24 h,以萃取样本中的EB,并用DU800紫外分光光度计测定625 nm波长处光密度值。
1.6 药品对照溶液、前列腺组织匀浆的制备及对照溶液反应值(As)的测定 用电子天平称定EB原药50 mg,置于50 ml量瓶中,加氯仿溶解并稀释摇匀,精密吸取0.5、1.0、2.0、3.0、4.0 ml,分别置10 ml量瓶中,加入氯仿定容成约0.05、0.1、0.2、0.3、0.4 mg/ ml的溶液作为药品对照溶液。在无菌条件下,用无菌组织剪剪碎大鼠前列腺,每样本称取0.300 g,分别置于50 ml离心管,分次加入共20 ml的6%高氯酸溶液,使用组织匀浆机进行标本匀浆。匀浆完成后将样本以9000 r/min离心10 min,加15%三氯乙酸4 ml沉淀样本中的蛋白,过滤在容量为100 ml的三角烧瓶中。将离心后的沉淀物用15 ml 6%高氯酸再次进行匀浆、离心处理,离心后加入4 ml的15%三氯乙酸沉淀样本中的蛋白并过滤,将2次所得上清液合并,用5.0、0.5 mol/L NaOH调配成pH=6.5的溶液,并转移至50 ml量瓶中,定容摇匀。吸取醋酐2 ml置于具塞试管中,再加10 μl硫酸后,立即加入约0.2 mg/ml药品对照溶液1 ml,置振荡器中混匀,再倒入比色池中反应,并同时于625 nm波长处观察其反应的吸收度变化情况,记录最大吸收度As,其中以1 ml氯仿代替上述反应中的对照品溶液,作为空白对照。
1.7 前列腺组织匀浆溶液反应值(At)的测定及标准曲线的绘制 加入前列腺组织匀浆1 ml代替上述As测定中的药品对照溶液,同法操作,记录最大吸收度At。以2 ml氯仿代替其中的醋酐同法操作,作为空白对照。测定后,按比色法原理计算出前列腺中EB的含量及浓度。以5 mg/ml EB溶液作为初始浓度进行倍比稀释,形成梯度浓度为5、2.5、1.25、0.625、0.3275、0.15675 mg/ml的EB溶液,精密吸取各溶液1 ml,按At测定方法进行操作。
1.8 观察指标 根据回归方程,计算前列腺组织中EB的含量及浓度,比较不同处理组前列腺组织中渗出的EB量,以考察经腹部前列腺超声造影处理后血-前列腺屏障通透性的动态变化情况。
1.9 统计学方法 采用SPSS 12.0软件,各组计量资料比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 动物模型建立情况 60只实验大鼠全部完成实验,实验过程中未发生死亡。大体可见大鼠前列腺表面及其周围肌层均色泽正常,未见明显的血肿形成,同时辐照组1例表面及肌层见少许散在出血点,其余未见异常。
2.2 病理表现 对照组大鼠前列腺组织HE染色示组织形态正常,腺管排列规整,毛细血管无充血表现。EB组、同时辐照组及先行辐照组前列腺组织HE染色示组织形态正常,腺管排列规整,管腔见少许异形颗粒沉积,毛细血管稍充血,上皮细胞排列正常。见图1。
2.3 EB浓度 对照组及微泡组大鼠前列腺内EB浓度极低,EB组大鼠前列腺内EB浓度高于对照组及微泡组,差异有统计学意义(t=4.157、4.357, P<0.01);同时辐照组大鼠前列腺内EB浓度高于EB组,差异有统计学意义(t=2.438, P<0.05)。先行辐照组大鼠前列腺内EB浓度明显低于同时辐照组,差异有统计学意义(t=2.761, P<0.05),先行辐照组与EB组EB浓度差异无统计学意义(t=0.684, P>0.05)。见表1。

图1 A.对照组腺体排列规整,间质无水肿,未见EB染色;B、C. EB组和同时辐照组可见腺腔及间质少许EB蓝染,部分腺体肿胀变形,间质无疏松;D.先行辐照组EB蓝染程度较EB组与同时辐照组更为明显,部分腺体肿胀变形,间质无疏松(SABC, ×200)
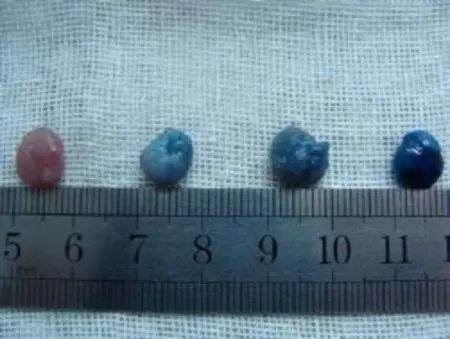
图2 各组大体标本图,从左到右依次为对照组、EB组、先行辐照组、同时辐照组。对照组无EB染色腺体呈自然淡红色,质软、无水肿;EB组、先行辐照组腺体总体呈淡蓝色,无明显颜色深浅差别;同时辐照组腺体EB染色较重

表1 各组前列腺组织EB浓度比较
3 讨论
男性生殖系统中的血-睾屏障及血-附睾屏障均具有保护精子抵御外界生理或病理因素袭扰的功能,有利于精子在相对独立的环境中发育[5,6]。在精子通过的腔道中,均有屏障结构存在确保血液中成分有选择性地进入精道,从而确保精子的安全。前列腺作为男性生殖系统的主要附属腺体之一,同样有着促进精子发育、维持精子活力的重要生理功能。据此推测,在前列腺内也可能存在血-前列腺屏障,以屏蔽血液中对精子有害的成分。部分前列腺炎患者的精子质量不同程度地下降,甚至导致不育,提示有血-前列腺屏障的存在。
前列腺炎药物治疗疗效欠佳的原因可能是由于存在血-前列腺屏障,导致前列腺内部药物通透性差,许多抗菌药物不易渗透至前列腺腺管内,腔内低浓度的药物难以根除腺体内的感染。随着抗菌药物的广泛使用,耐药菌株不断出现,抗菌药物在前列腺内的浓度大大小于致病菌的最小抑菌浓度,且维持时间短,加大了治疗的难度。
为了克服血-前列腺屏障对药物的抑制,目前通常选用具有高脂溶特性、小分子抗生素等高通过性药物,或者选择经前列腺内注射、经直肠微波、药物栓剂直肠给药等方法[7]。然而由于前列腺解剖结构特殊,部分治疗方法为侵入性操作,不易为患者接受,且治疗效果较差[8,9]。因此,如何提高血-前列腺屏障的药物穿透力,是治疗前列腺炎的关键因素之一[10]。超声微泡造影剂最初用于疾病的诊断,近来研究发现将微泡造影剂作为携带药物或治疗性基因的载体,利用超声波的照射作用,可以实现药物的靶向导入和释放[11,12]。
本研究显示,对照组及微泡组大鼠前列腺内EB浓度极低,EB组大鼠前列腺内EB浓度明显高于对照组及微泡组,同时辐照组前列腺内药物浓度高于EB组,且与大体标本观察结果一致,表明通过给予超声联合微泡造影剂对大鼠前列腺进行靶向辐照,可以增加前列腺组织内上皮细胞的通透性,增加局部药物的浓度,提高治疗效果。
本研究发现,先行辐照组大鼠前列腺组织EB浓度明显低于同时辐照组,与EB组比较无明显差异。说明微泡造影剂联合超声辐照开放前列腺屏障具有一定的时效性,辐照后30 min内前列腺上皮的通透性持续存在,而后消失,再次给予药物时无法增加腺体内的药物浓度。即利用超声微泡可以消除或者减弱血-前列腺屏障对药物转运的限制,并将药物选择性地靶向输送到病变部位。
总之,微泡造影剂能够有时效地开放血-前列腺屏障,增加前列腺局部药物浓度,为微泡造影剂在前列腺疾病中的治疗提供了理论基础。
[1] Wallner LP, Clemens JQ, Sarma AV. Prevalence of and risk factors for prostatitis in African American men: the Flint Men's Health Study. Prostate, 2009, 69(1): 24-32.
[2] Murphy AB, Macejko A, Taylor A, et al. Chronic prostatitis: management strategies. Drugs, 2009, 69(1): 71-84.
[3] Tsutsui JM, Xie F, Porter RT. The use of microbubbles to target drug delivery. Cardiovasc Ultrasound, 2004, 2: 23-28.
[4] Unger EC, Matsunaga TO, McCreery T, et al. Therapeutic applications of microbubbles. Eur J Radiol, 2002, 42(2): 160-168.
[5] Wong EW, Mruk DD, Lee WM, et al. Par3/par6 polarity complex coordinates apical ectoplasmic specialization and blood-testis barrier restructuring during spermatogenesis. Proc Natl Acad Sci U S A, 2008, 105(28): 9657-9662.
[6] Levy S, Robaire B. Segment-specifc changes with age in the expression of junctional proteins and the permeability of the blood-epididymis barrier in rats. Biol Reprod, 1999, 60(6): 1392-1401.
[7] Yang J, Liu L, Xie HW, et al. Chinese urologists' practice patterns of diagnosing and treating chronic prostatitis: a questionnaire survey. Urology, 2008, 72(3): 548-551.
[8] Parsons CL. The role of the urinary epithelium in the pathogenesis of interstitial cystitis/prostatitis/urethritis. Urology, 2007, 69(4 Suppl): 9-16.
[9] Kastner C. Update on minimally invasive therapy for chronic prostatitis/chronic pelvic pain syndrome. Curr Urol Rep, 2008, 9(4): 333-338.
[10] Chuang YC, Yoshimura N, Huang CC, et al. Intraprostatic botulinum toxin a injection inhibits cyclooxygenase-2 expression and suppresses prostatic pain on capsaicin induced prostatitis model in rat. J Urol, 2008, 180(2): 742-748.
[11] 吴风林, 纪丽景, 罗利红, 等. 携带抗白细胞介素-2受体α单抗靶向超声微泡和对比超声结合评价肾缺血-再灌注损伤. 中国医学影像学杂志, 2011, 19(8): 626-629.
[12] 刘平, 高云华, 谭开彬, 等. 经颅脑超声造影对血脑屏障通透性的影响. 中华超声影像学杂志, 2006, 15(7): 525-527.
(责任编辑 唐 洁)
Infuence of Low-dose Ultrasound-mediated Micro-bubble on the Evans Blue Concentration in the Rat Prostate
PurposeTo investigate the influence of low-dose ultrasound (LDUS) mediated microbubble on the increasing Evans blue (EB) concentration in rat prostate.Materials and MethodsSixty male Sprague-Dawley (SD) rats were divided into control group, EB-only group, microbubble-only group, LDUS after EB group and LDUS before EB group. Each group had 12 rats. The control group was injected with 10 ml/kg sodium chloride, EB-only group was given 50 mg/kg EB without LDUS mediation, microbubbleonly group was given with microbubble contrast agent without LDUS mediation, LDUS after EB group was given LDUS mediation right after EB and microbubble injection, the LDUS before EB group was LDUS medicated before EB and microbubble injection. Concentration of EB in prostate tissue was measured homogenated.ResultsEB concentration of rat prostate in EB group was statistically higher than the control group and microbubble-only group (t=4.157 and 4.357, P<0.01); that in LDUS after EB group was higher than the EB group (t=2.438, P<0.05); but that in LDUS before EB group was signifcantly lower than LDUS before EB group (t=2.761, P<0.05); no statistical difference in EB concentration was observed between LDUS after EB group and EB group (t=0.684, P>0.05).ConclusionLow-dose ultrasound-mediated microbubble can increase in the EB concentration in rat prostate.
Prostate; Ultrasonography; Contrast media; Micro-bubble; Evans blue; Models, animal; Rats
1. 第三军医大学附属新桥医院泌尿外科重庆 400037
2. 第三军医大学附属新桥医院超声诊断科重庆 400037
易善红
Department of Urology, Xinqiao Hospital,
Third Military Medical University, Chongqing 400037, china
Address Correspondence to: YI Shanhong
E-mail: yshh881@aliyun.com
第三军医大学临床科研基金项目
(2009XLC22)。
R-33;R445.1
2013-07-19
修回日期:2013-12-24
中国医学影像学杂志
2014年 第22卷 第1期:4-6,11
Chinese Journal of Medical Imaging
2014 Volume 22(1): 4-6, 11
10.3969/j.issn.1005-5185.2014.01.002
