秦岭松栎混交林土壤微生物及酶活性1)
2014-03-06陈军军张硕新
陈军军 侯 琳 李 银 白 娟 张硕新
(西北农林科技大学,杨凌,712100)
林地土壤微生物是森林生态系统的重要组成部分,是生态系统的分解者,参与了有机物质的分解、土壤化学循环、土壤结构的形成等过程[1]。土壤酶在腐殖质的形成和碳氮磷等有机元素的循环中起重要作用,并参与一系列的生物化学反应[2-3]。林地土壤微生物—酶系统共同作用,推动着林地土壤的物质转化和能量流动[4-6]。近年来,关于林地土壤微生物和酶虽有较多研究,但由于土壤有很强的异质性,不同区域、不同林型、不同林龄的研究呈现出相似或不同的变化规律[2,7-9]。秦岭林区是我国主要林区之一,秦岭山地森林在固碳、为珍稀动物提供栖息地等方面发挥着重要作用。松栎混交林是秦岭中山地带广布的森林类型,有关其土壤微生物、酶活性的研究报道不多[10]。研究该森林类型土壤微生物、酶活性的变化规律及其与土壤理化性质的相关性,可为该区森林资源科学管理提供依据。
1 研究区概况
试验地位于陕西秦岭森林生态系统国家野外科学研究站的松栎混交林长期定位观测样地内。研究区地处北亚热带北缘,地理位置为33°18' ~33°28'N,109°20' ~109°29'E,海拔1 450 ~2 500 m。年平均气温9 ℃,年降水量900 ~1 200 mm,年蒸发量800 ~950 mm。土壤为山地棕壤,土层厚30 ~50 cm。试验地内的松栎混交林是20 世纪70年代末采伐后,天然更新形成的异龄次生林,以油松(Pinus tabulaeformis)、华山松(Pinus armandi)和锐齿栎(Quercus aliena var.acuteserrata)占优势。林分平均高9.8 m,平均胸径14.3 cm,郁闭度0.8,平均林龄42 a,林下灌木、草本种类较多。
2 材料与方法
2.1 土壤样品的采集
2012年9月初、2013年4月和6月初,在松栎混交林10 个样地内,根据每个样地中林分生长状况和地形差异,布设土壤采集样点,采用分层多点混合取土法[11],用土钻按0 ~5、>5 ~15、>15 ~25 cm 3层采集土样,共采集90 份。将采集的土样分为两部分装入无菌袋中:一部分鲜样放入4 ℃保温箱带回室内进行微生物培养;另一部分土样风干、过筛(1.00、0.15 mm),进行土壤酶活性及土壤理化性质测定。
2.2 土壤样品分析
土壤微生物培养记数:采用选择性培养基按稀释平板法进行微生物培养记数[12]。细菌采用牛肉膏蛋白胨培养基,放线菌采用高氏一号培养基,真菌采用PDA 培养基,每个处理3 个重复。接种后的培养皿放在培养箱中28 ℃培养:细菌培养3 ~4 d,放线菌5 ~7 d,真菌3 ~5 d。土壤微生物数量以每克干土中的含菌数表示(个·g-1)。
土壤酶活性测定:过氧化氢酶活性采用高锰酸钾滴定法测定,以0.5 h 后每克土消耗0.002 mol·L-1KMnO4的体积量表示酶活性;蔗糖酶活性采用3,5-二硝基水杨酸比色法测定,以葡萄糖(mg·g-1,37 ℃,24 h)表示酶活性;脲酶活性采用苯酚钠—次氯酸钠比色法测定,以NH3—N(mg·g-1,37℃,24 h)表示酶活性;酸性磷酸酶活性采用改进后的Hoffen 法测定,以酚(mg·g-1,37 ℃,12 h)表示酶活性[13]275-323,[14]。
土壤理化性质测定:将土壤鲜样装入铝盒中,在105 ℃下烘至恒质量,测定其含水率;采用SevenEasy pH 计(METTLER-TOLEDO)按1 g 土对应2.5 mL 水的比例测定土壤pH 值;土壤有机质质量分数采用重铬酸钾外加热法测定;全氮质量分数采用凯氏法测定;全磷质量分数采用酸溶—钼锑抗比色法测定[15]。
2.3 数据处理
数据采用SPSS 20.0(SPSS Inc.,USA)软件分析。采用单因素方差分析比较不同土层间观测指标的差异性。采用Pearson 双侧检验法分析土壤微生物、土壤酶活性之间及其与土壤理化性质的相关性。通过逐步回归分析建立回归方程。
3 结果与分析
3.1 微生物类群在不同土层间的变化
土壤微生物在土壤中的生物过程包括降解有机残留物、有机质的转化、营养物质的矿化和固定以及土壤团聚体的形成和稳定[16]。本研究中,林地内土壤细菌、放线菌在0 ~5 cm 土层数量最多,>5 ~15 cm 与>15 ~25 cm 土层间差异不显著;而真菌数量的变化在各层间呈现出显著的差异(表1)。由表1可知,样地内细菌、放线菌和真菌数量随土层深度增加而递减,其中细菌数量最多,占总微生物数量的99%以上,其次是放线菌,真菌数量最少,可见细菌在微生物菌群生物降解中起重要作用。

表1 秦岭松栎混交林不同土层间土壤微生物类群的差异
3.2 土壤酶活性在不同土层间的变化
过氧化氢酶表征着土壤腐殖化强度及有机质积累程度,蔗糖酶能够促进糖类的水解,加速土壤碳素循环,磷酸酶的存在可以促进有机磷化合物的分解[17],脲酶的活性强度常用来表征土壤的氮素供应强度[18]。本研究中,土壤过氧化氢酶、脲酶、蔗糖酶、酸性磷酸酶呈现出随土层深度增加而降低的趋势。过氧化氢酶和蔗糖酶活性在>5 ~15 cm 与>15~25 cm 土层间差异不显著,脲酶和酸性磷酸酶在不同土层间差异显著(表2)。0 ~5 cm 土层的过氧化氢酶、脲酶、蔗糖酶、酸性磷酸酶整体呈现相对较高的活性,可知表层土壤中有机质积累、腐殖化程度、土壤碳素循环及氮素供应具有较高的水平。

表2 秦岭松栎混交林不同土层间土壤酶活性的差异
3.3 土壤微生物类群变化的相关性
土壤中的有机和无机营养物是微生物生长的天然培养基[19]。研究显示:土壤中细菌、放线菌、真菌的数量与土壤含水率、pH 值、有机质、全氮、全磷质量分数之间呈现出一定的相关性(表3)。土壤细菌数量与土壤含水率、有机质、全氮质量分数呈极显著正相关,而同土壤pH 值和全磷质量分数的相关性不显著。放线菌数量与土壤有机质、全氮质量分数呈极显著正相关关系,其相关系数高达0.90 以上,但与土壤含水率、pH 值、全磷质量分数相关性不显著。放线菌对于有机质的分解应起关键的作用。真菌数量同土壤有机质质量分数呈显著正相关,但与其他理化性质,无显著相关关系。细菌数量与土壤pH 值呈正相关,真菌和放线菌数量则与土壤pH 值呈负相关关系,这是因为多数的细菌在中性或者微酸性的环境中显示出最大的活性,真菌喜欢生活在酸性土壤中,而放线菌则喜欢中性的环境[13]17。
由土壤细菌、放线菌、真菌数量之间的相关性分析(表3)可知:放线菌数量与细菌数量、真菌数量均呈极显著正相关关系,说明微生物类群之间相互联系较紧密。
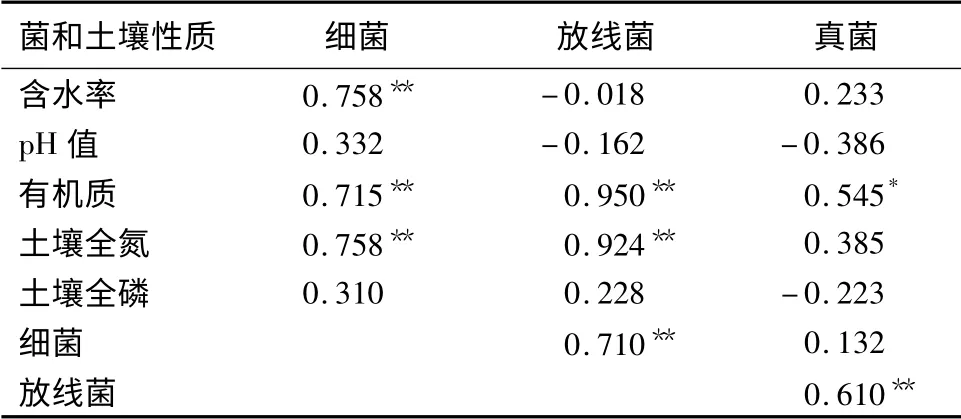
表3 秦岭松栎混交林土壤微生物数量间及其与土壤性质的相关性
为进一步探讨影响土壤微生物数量的主导因子,通过逐步回归法建立了土壤微生物数量与影响因子间的回归模型:
M1=91.325E3-65258.932M3,R2=0.766,P=0.001;
M2=-1.919 +0.079x3-0.003E3,R2=0.933,P =0.001;
M3=0.031M2-2.609 ×10-6M1,R2=0.458,P=0.003。
式中:M1为细菌数量(105个·g-1);M2为放线菌数量(105个·g-1);M3为真菌数量(105个·g-1);E3为蔗糖酶活性(mg·g-1);x3为有机质质量分数(g·kg-1)。
由回归分析可知:蔗糖酶活性对土壤中细菌和放线菌的数量有重要影响,土壤有机质质量分数影响着土壤放线菌的数量;细菌与真菌,真菌与细菌和放线菌数量之间有较紧密的线性关系。
3.4 土壤酶活性变化的相关性
土壤酶活性与土壤理化性质之间有着密切的关系[20],大部分酶是土壤中微生物新陈代谢过程中释放的活性物质,酶活性在一定程度上取决于微生物数量[21]。本研究中,过氧化氢酶、脲酶、蔗糖酶、酸性磷酸酶的活性与土壤含水率、pH 值、有机质、全氮、全磷质量分数、微生物类群的数量之间的相关性呈现出一定的规律性(表4)。土壤过氧化氢酶、脲酶、蔗糖酶、酸性磷酸酶的活性与土壤含水率、有机质、全氮质量分数间均呈现出极显著正相关关系,与土壤pH 值、全磷质量分数之间相关性不显著,但与土壤pH 值间均呈现出负相关关系。可知:土壤含水率、有机质、全氮质量分数显著影响着土壤中酶的活性,而土壤的酸性可能抑制土壤酶的活性。
土壤脲酶、蔗糖酶活性与细菌数量的相关性达到极显著正相关水平,酸性磷酸酶活性同细菌数量呈显著正相关关系,而过氧化氢酶活性与细菌数量之间相关性不显著;土壤过氧化氢酶、脲酶、蔗糖酶、酸性磷酸酶活性与放线菌数量之间均呈现出极显著正相关关系;土壤过氧化氢酶、脲酶、蔗糖酶活性与真菌数量之间显著相关,而酸性磷酸酶活性同真菌数量间则呈极显著正相关关系,这可能是因为在酸性土壤中,真菌能大量释放酸性磷酸酶。
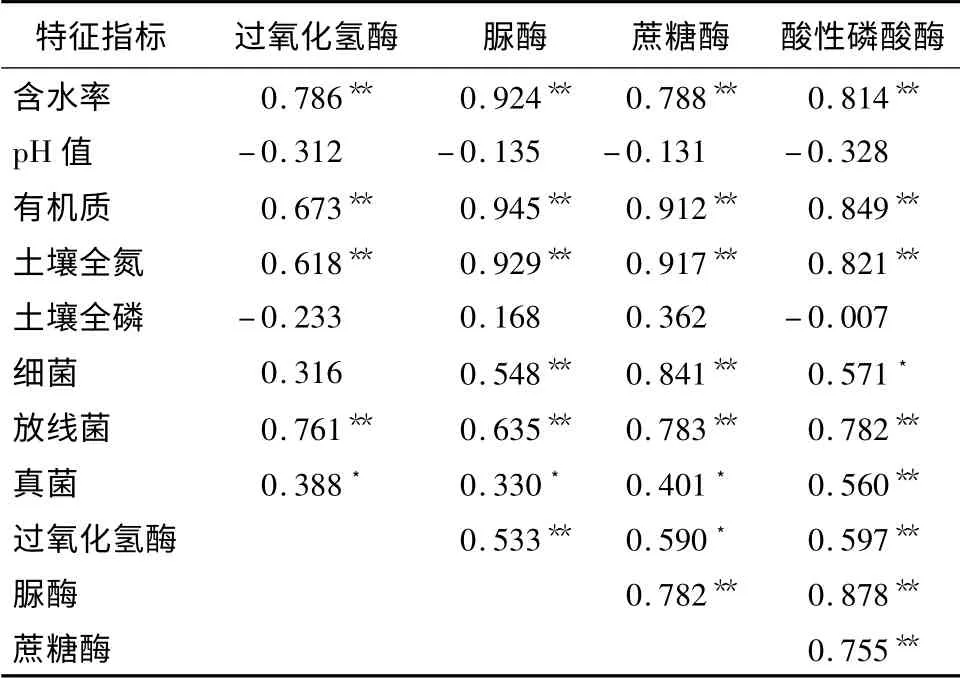
表4 秦岭松栎混交林土壤酶活性变化的相关性
林地土壤中4 种酶的活性的相关性分析显示:过氧化氢酶、脲酶、蔗糖酶、酸性磷酸酶相互之间均存在显著或极显著正相关关系(表4),说明土壤酶在土壤中的降解作用并不是单一酶的作用,是它们组成的酶系统推动着大分子物质的降解。
为探讨影响土壤酶活性的因子,通过逐步回归建立了土壤酶活性与土壤理化性质和微生物因子间的回归模型:
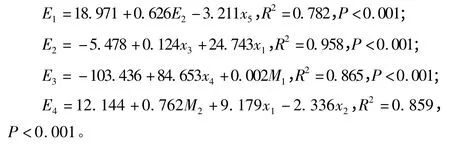
式中:E1为过氧化氢酶活性(mg·g-1);E2为脲酶活性(mg·g-1);E3为蔗糖酶活性(mg·g-1);E4为酸性磷酸酶活性(mg·g-1);M1为细菌数量(105个·g-1);M2为放线菌数量(105个·g-1);x1为含水率;x2为pH 值;x3为有机质质量分数(g·kg-1);x4为全氮质量分数(g·kg-1);x5为全磷质量分数(g·kg-1)。
通过回归分析可知:脲酶活性和土壤全磷质量分数对土壤过氧化氢酶活性有极显著影响;土壤有机质和含水率对脲酶的活性有极显著影响;土壤全氮质量分数、细菌数量对蔗糖酶活性有极显著影响;土壤放线菌数量、含水率以及pH 值则可用于土壤酸性磷酸酶活性的预测。
3 结论与讨论
邹莉等[8]的研究指出细菌对环境的适应能力很强,占微生物总数的91.76%。本研究发现,从三大类微生物类群在林地土壤的分布看,细菌占绝对优势,高达99%以上,放线菌次之,真菌最少,与有关报道相似[9,22-23],这可能是由于细菌是土壤中活动力的主力军,比放线菌、真菌更适应环境条件,有较强的繁殖能力[8,24]。
郑诗樟等[4]、漆良华等[25]的研究指出土壤微生物类群、土壤酶活性呈现出随土层加深而减少的趋势。本研究中,土壤微生物和酶的分布呈现出相似的趋势,集中分布在0 ~5 cm 及>5 ~15 cm 土层,在>15 ~25 cm 土层分布相对较少。这是由于表层土壤较深层土壤质地相对疏松、光热条件良好、透气性好,有充足的水分,且上层土壤凋落物较多、有营养丰富的腐殖质、养分含量高,利于土壤微生物的活动。
徐文煦等[24]对大兴安岭3 种不同林型的土壤微生物区系的研究发现土壤含水率与土壤微生物数量的关系不明确。而本研究发现土壤含水率对土壤微生物类群数量和酶活性有着比较显著的影响,这种差异性可能与不同的研究区域和林型有关,有待进一步的研究。吴际友等[7]的研究指出土壤中的脲酶、过氧化氢酶、酸性磷酸酶和纤维素分解酶活性与土壤pH 值有不同程度的负相关关系,而本研究也有类似的结论。这可能是由于pH 值在一定程度上制约着土壤酶活性的发挥、对各种酶活性有着不同程度的抑制作用。于洋等[22]的研究指出细菌和放线菌的数量与土壤有机质和全氮质量分数的相关程度最高,本研究发现土壤中细菌、放线菌数量、4种酶的活性均与土壤有机质和全氮质量分数呈极显著相关关系。这是由于土壤养分是土壤微生物和酶活动的物质基础,养分质量分数的高低在很大程度上制约着土壤微生物的繁殖和酶的分解活动,同时本研究也说明土壤有机质和全氮质量分数较易影响细菌、放线菌数量以及4 种酶的活性。
丁菡等[20]的研究指出土壤微生物数量与所测酶活性之间都有较高的相关性。本研究中除蔗糖酶、脲酶、过氧化氢酶活性与真菌数量以及过氧化氢酶活性与细菌数量之间相关性不显著外,其它酶类活性均呈现出与微生物数量较好的相关性,这是由于土壤中微生物的分泌作用是土壤酶的主要来源[13]14-17,说明酶活性在一定程度上取决于微生物的数量。陆梅等[9]对滇池西岸4 种针叶林的土壤微生物和酶活性的研究指出,细菌与放线菌呈正相关关系、与真菌呈负相关关系,蔗糖酶与过氧化氢酶、脲酶存在显著相关关系。本研究中细菌和放线菌数量之间呈极显著正相关关系,4 种酶活性间呈现出极显著或显著相关关系。这是由于不同微生物类群的繁殖有互利关系,土壤中酶功能的发挥往往不是单一酶的作用[13]61-67,土壤微生物和酶共同推动着土壤的物质循环和能量流动。
研究区域的松栎混交林属于天然次生林,林地郁闭度大,林内光照不充分、温度较低,凋落物累积厚、不易分解,影响土壤肥力的提高,可采用间伐等抚育措施来改善这一状况。土壤微生物和土壤酶作为土壤中的生物活性因子,在凋落物的分解、养分供应方面的作用重大,与土壤的理化性质有较高的相关性,能够反映土壤养分的变化趋势[4,26-27],可作为抚育措施好坏的参考评价指标。
[1] Rogers B F,Tate III R L.Temporal analysis of the soil microbial community along a toposequence in pineland soils[J].Soil Biology & Biochemistry,2001,33(10):1389-1401.
[2] 李陆平,廖超英,李晓明,等.毛乌素沙地樟子松人工林对土壤微生物及酶活性的影响[J].西北林学院学报,2012,27(3):12-16.
[3] Gu Y,Wang P,Kong C H.Urease,invertase,dehydrogenase and polyphenoloxidase activities in paddy soil influenced by allelopathic rice variety[J].European Journal of Soil Biology,2009,45(5/6):436-441.
[4] 郑诗樟,肖青亮,吴蔚东,等.丘陵红壤不同人工林型土壤微生物类群、酶活性与土壤理化性状关系的研究[J].中国生态农业学报,2008,16(1):57-61.
[5] Elfstrand S,Hedlund K,Martensson A.Soil enzyme activities,microbial community composition and function after 47 years of continuous green manuring[J].Applied Soil Ecology,2007,35(3):610-621.
[6] Aon M A,Colaneri A C.Temporal and spatial evolution of enzymatic activities and physico-chemical properties in an agricultural soil[J].Applied Soil Ecology,2001,18(3):255-270.
[7] 吴际友,叶道碧,王旭军.长沙市城郊森林土壤酶活性及其与土壤理化性质的相关性[J].东北林业大学学报,2010,38(3):97-99.
[8] 邹莉,唐庆明,王轶.落叶松、樟子松纯林及混交林土壤微生物的群落分布特征[J].东北林业大学学报,2010,38(11):63-64.
[9] 陆梅,卫捷,韩智亮.滇池西岸4 种针叶林的土壤微生物与酶活性[J].东北林业大学学报,2011,39(6):56-59.
[10] 田呈明,刘建军,梁英梅,等.秦岭火地塘林区森林根际微生物及其土壤生化特性研究[J].水土保持通报,1999,19(2):19-22.
[11] 江元明,庞学勇,包维楷.岷江上游油松与云杉人工林土壤微生物生物量及其影响因素[J].生态学报,2011,31(3):801-811.
[12] 程丽娟,薛泉宏.微生物学实验技术[M].西安:世界图书出版公司,2000:63-83.
[13] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
[14] 赵兰坡,姜岩.土壤磷酸酶活性测定方法的探讨[J].土壤通报,1986,17(3):138-141.
[15] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2005.
[16] Pignataro A,Moscatelli M C,Mocali S,et al.Assessment of soil microbial functional diversity in a coppiced forest system[J].Applied Soil Ecology,2012,62:115-123.
[17] 王启兰,曹广民,王长庭.放牧对小嵩草草甸土壤酶活性及土壤环境因素的影响[J].植物营养与肥料学报,2007,13(5):856-864.
[18] Su Y Z,Li Y L,Cui J Y,et al.Influences of continuous grazing and livestock exclusion on soil properties in a degraded sandy grassland,Inner Mongolia,northern China[J].Catena,2005,59(3):267-278.
[19] 池振明.现代微生物生态学[M].2 版.北京:科学出版社,2010:31.
[20] 丁菡,胡海波,王人潮.半干旱区土壤酶活性与其理化及微生物的关系[J].南京林业大学学报:自然科学版,2007,31(2):13-18.
[21] 郑伟,霍光华,骆昱春,等.马尾松低效林不同改造模式土壤微生物及土壤酶活性的研究[J].江西农业大学学报,2010,32(4):743-751.
[22] 于洋,王海燕,丁国栋,等.华北落叶松人工林土壤微生物数量特征及其与土壤性质的关系[J].东北林业大学学报,2011,39(3):76-80.
[23] 漆良华,张旭东,周金星,等.湘西北小流域不同植被恢复区土壤微生物数量、生物量碳氮及其分形特征[J].林业科学,2009,45(8):14-20.
[24] 徐文煦,王继华,张雪萍,等.大兴安岭森林土壤微生物生态分布研究[J].哈尔滨师范大学自然科学学报,2009,25(1):67-70.
[25] 漆良华,张旭东,彭镇华.湘西北小流域植被恢复区土壤酶活性及养分相关性[J].东北林业大学学报,2011,39(3):83-88.
[26] Carpenter-Boggs L,Stahl P D,Lindstrom M J,et al.Soil microbial properties under permanent grass,conventional tillage,and no-till management in South Dakota[J].Soil & Tillage Research,2003,71(1):15-23.
[27] Sicardi M,Garcla-Préchac F,Frioni L.Soil microbial indicators sensitive to land use conversion from pastures to commercial Eucalyptus grandis (Hill ex Maiden)plantations in Uruguay[J].Applied Soil Ecology,2004,27(2):125-133.
