索拉非尼免疫毫微球的制备及其抗肝癌效果的实验研究
2014-03-06舒苗江阚和平袁琳谭永法周杰
舒苗江 阚和平 袁琳 谭永法 周杰
索拉非尼免疫毫微球的制备及其抗肝癌效果的实验研究
舒苗江 阚和平 袁琳 谭永法 周杰
目的制备抗人肝癌抗体与索拉非尼偶联免疫毫微球,观察其特性及抗肝癌效果。方法通过异型双功能交联剂SPDP,将抗人肝癌单克隆抗体HAb18与索拉非尼(sorafenib,SAF)人血清白蛋白毫微球[HSA(SAF)-NS]偶联,制成抗人肝癌抗体与索拉非尼偶联免疫毫微球HAb18-HSA(SAF)-NS,使用凝集试验检测其活性,光镜和电镜下观察其与人肝癌细胞株SMMC-7721特异性结合。MTT法检测该免疫毫微球的体外杀伤性。于人肝癌裸鼠模型上分别使用HAb18-HSA(SAF)-NS、HSA(SAF)-NS及SAF,检测三者的肿瘤抑制率。结果HAb18-HSA(SAF)-NS具有单抗活性,能与肝癌细胞特异结合;其体外杀伤SMMC-7721细胞IC 50值为42.4 μg/mL,与HSA(SAF)-NS(368.9 μg/mL)及SAF(377.5 μg/mL)相比,明显降低;体内肿瘤抑制率比HSA(SAF)-NS及SAF显著增强(P<0.001)。结论HAb18-HSA(SAF)-NS具有免疫活性,对肝癌细胞有主动靶向性,体内外均具有比HSA(SAF)-NS及SAF更强的抗癌效果。
免疫毫微球;索拉非尼;单克隆抗体;肝癌
索拉非尼(sorafenib,SAF)作为一种新型的靶向治疗药物,被列为晚期肝癌治疗的标准用药[1-2]。但有些肝癌患者疗效不佳,并且有较大毒副作用。主要原因之一是药物在肝癌细胞中不能维持足够的浓度和时间,如达到足够的浓度和作用时间,对正常细胞有很大毒副作用。靶向给药能增加药物对肿瘤的杀灭,并减少其毒副作用。单克隆抗体和毫微球是目前靶向治疗研究的热点[3-4]。我们使用抗人肝癌单克隆抗体HAb18与含索拉非尼(SAF)的人血清白蛋白毫微球[HAS(SAF)-NS]偶联,制备抗人肝癌免疫毫微球[HAb18-HSA(SAF)-NS],并检测其在体内外的抗癌效果,以探讨该免疫毫微球对肝癌的疗效。
材料与方法
一、实验动物
BALB/c裸鼠56只,5~7周龄,雌性,由南方医科大学动物实验中心提供。
二、主要试剂与仪器
XW-80旋涡混合器为上海医科大学仪器厂产品;3K30冷冻高速离心机为美国Sigma公司产品;ALPHAI-4/RZ-2冷冻干燥机为德国MARtIn CHRIst公司产品;THeRmo FoRmA 700系列超低温冰箱为美国THeRmo公司产品。索拉非尼(SAF)为德国拜耳医药保健有限公司产品。抗人肝癌单克隆抗体HAb18由第四军医大学单克隆抗体研究室提供。异型双功能交联剂:N-琥珀酰亚胺基-3-(2-吡啶二硫)丙酸酯(SPDP),二硫苏糖醇(DTT)均为Sigma公司产品。人血清白蛋白,成都蜀阳制药厂生厂。SMMC-7721细胞株来源于人肝癌细胞,由第四军医大学单克隆抗体研究室提供。
三、方法
1.HSA(SAF)-NS的制备
采用乳化高温固化法制备HSA(SAF)-NS[3-4]。SAF含量(载药量)为35%,平均粒径为326 nm,4℃保存备用。
2.HAb18-HSA(SAF)-NS的制备
HSA(SAF)-NS悬液与SPDP按1:100比例在室温下搅拌40 min,生成索拉非尼人血清白蛋白-吡啶二硫丙酸酯偶联物[HSA(SAF)-NS-PDP],用醋酸盐缓冲液洗涤,离心后取沉淀备用。HAb18与SPDP按1:10比例在室温下搅拌40 min,醋酸盐缓冲液洗脱,加入DTT(与HAb18按1:1比例),室温下反应30 min,以磷酸盐缓冲液洗脱,得到抗人肝癌单抗-巯基偶联物(HAb18-SH),用0.22 μm膜过滤除菌后,与HSA(SAF)-NS-PDP混合,室温下振荡12 h,磷酸盐缓冲液洗涤3次,离心(2 000 r/min,10 min),即得HAb18-HSA(SAF)-NS。冷冻干燥成粉末状。
3.HAb18-HSA(SAF)-NS载药量及粒径测定和形态观察
载药量的测定按文献[4]方法进行。粒径测定:取少量HAb18-HSA(SAF)-NS混悬液,用2%磷钨酸染色2~3 min,并用滤纸吸取多余的溶液,自然晾干后置于透射电子显微镜下观察,进行粒径测定和形态观察。
4.HAb18-HSA(SAF)-NS体外与特异细胞结合的免疫特性鉴定
肝癌细胞株SMMC-7721细胞5×105个/mL两份,分别加入HAb18-HSA(SAF)-NS及HSA(SAF)-NS各100 μL(浓度为500 μg/mL),4℃反应30 min,光镜下观察。取上述HAb18-HSA(SAF)-NS与SMMC-7721细胞的结合物,在电镜室进行扫描电镜观察。
5.HAb18-HSA(SAF)-NS对靶细胞的杀伤活性
将人肝癌SMMC-7721细胞用胰酶消化后加入40孔板,每孔细胞数为2×104个,培养24 h后分为3组:一组按文献[5]方法加入SAF,从12 500 mg/L起倍比稀释至6.25 mg/L,另两组同法加入相当于同等剂量SAF的HAb18-HAS(SAF)-NS或HSA(SAF)-NS,测定3组各浓度药物对SMMC-7721的杀伤率。
6.HAb18-HAS(SAF)-NS在荷瘤裸鼠体内的抑瘤作用
实验裸鼠腋下种植SMMC-7721细胞,2×107个/只,待肿瘤长至直径为3 mm时随机分为4组,每组14只,均经尾静脉给药。A组:HAb18-HSA(SAF)-NS 0.40 mg/只(含SAF 0.10 mg);B组:HSA(SAF)-NS 0.29 mg/只(含SAF 0.10 mg);C组:SAF 0.10 mg/只;D组:0.5 mL生理盐水作为对照组。每隔2 d用药1次,共5次。观察瘤体积抑制率及瘤重抑制率[6]。
三、统计学处理
结果
一、HAb18-HSA(SAF)-NS的载药量及粒径测定和形态观察
HAb18-HSA(SAF)-NS的载药量为25%。扫描电镜观察可见HAb18-HSA(SAF)-NS表面光滑圆整,呈球体,大小均匀,无粘连。HAb18-HSA(SAF)-NS的平均粒径为330 nm。
二、HAb18-HSA(SAF)-NS的免疫特性鉴定
HAb18-HSA(SAF)-NS与肝癌SMMC-7721细胞结合后,光镜下观察可见细胞周围结合有大量HAb18-HSA(SAF)-NS,用加样器吹打不分散。扫描电镜可见HAb18-HSA(SAF)-NS与细胞紧密结合。
三、HAb18-HSA(SAF)-NS的体外杀伤活性
根据SMMC-7721细胞对各组药物的剂量反应曲线,得到各组对肝癌MMC-7721细胞杀伤50%所需SAF浓度(IC50)值:HAb18-HSA(SAF)-NS为42.4 μg/mL,HSA(SAF)-NS为368.9 μg/ mL,SAF为377.5 μg/mL。HAb18-HSA(SAF)-NS的体外杀作性明显强于单纯的SAF及HSA(SAF)-NS。
四、HAb18-HSA(SAF)-NS在裸鼠体内的抑瘤作用
HAb18-HSA(SAF)-NS具有比SAF及HSA(SAF)-NS更强大的体内抑瘤作用,其差异有显著性意义(P<0.001)。各组的肿瘤抑制率见表1。
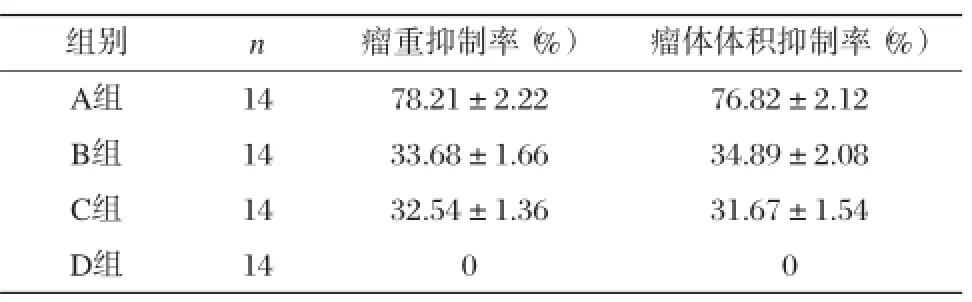
表1 各组荷瘤裸鼠肿瘤被抑制率(x±s)
讨论
肝癌是常见的恶性肿瘤。我国是肝癌的高发国家。目前大多数肝癌患者被发现时已是中晚期,治疗效果差,死亡率高。索拉非尼商品名为多吉美,是一种新型多靶点抗肿瘤药物.索拉非尼具有双重抗肿瘤作用,一方面通过抑制RAF/MEK/ERK信号传导通路直接抑制肿瘤增殖,另一方面通过抑制VEGF和血小板衍生生长因子(PDGF)受体而阻断肿瘤新生血管的形成,间接地抑制肿瘤细胞的生长[1-2,7]。索拉非尼是多年来第一个也是目前唯一被证明可以显著延长肝癌患者生存时间的有效治疗药物。有关研究表明,对于不同人种、不同地域和不同病况的晚期肝癌患者,索拉非尼治疗均显示出明显的临床获益率,为广大中晚期肝癌患者提供了新的治疗选择。索拉非尼作为一种新型的分子靶向治疗药物,己被列为中晚期肝癌治疗的标准用药。关于其治疗原发性肝癌的疗效,目前共有两组大样本的研究报道,分别是针对欧洲人群的SHARP研究以及针对亚洲人群的Oriental研究[1,7-8]。两组研究结果均肯定了索拉非尼可显著延长晚期肝癌患者的生存期。上述两组研究取得的结果令人鼓舞,最终奠定了索拉非尼作为晚期肝癌治疗首选药物的地位。美国2008年版NCCN正式推荐索拉非尼作为不能手术肝细胞癌一线治疗用药。最近我国食品药品监督管理局也正式批准用于治疗无法手术切除或远处转移的肝细胞癌。
但目前发现对有些肝癌患者疗效不佳,并且有较大毒副作用。原因之一是药物在肝癌细胞中不能维持足够的浓度和时间,如达到更高的浓度和更长的作用时间,可提高对肝癌的杀伤作用,但对正常细胞有很大毒副作用,病人不能耐受。
抗肿瘤药物靶向治疗可以使药物浓聚于肿瘤组织,而使非肿瘤组织药物浓度降低,从而达到提高药物疗效,减少毒副作用的效果。药物靶向治疗在提高化疗药物疗效,降低毒副作用方面具有广阔前景[9]。单克隆抗体可特异识别并结合特定的组织细胞,作为化疗药物的导向载体应用于肿瘤靶向治疗已有很多报道。但是一个抗体分子能携带的药物分子较少,故主动靶向作用有限。毫微球(nanospheres, NS)是由天然或合成大分子物质制成的固态胶体颗粒,粒径在10~1 000 nm之间,NS是毫微粒和毫微囊的统称。NS作为载体,药物或其它物质可吸附在其表面及包封、夹嵌在其内部或溶解于其中[10]。目前用于制备带药毫微球的材料很多。人血清白蛋白毫微球含有大量游离的羟基及氨基便于交联,且结构清楚,生物性能稳定,为人体自身白蛋白,不会增加过敏反应,为人体理想的药物载体。恶性肿瘤组织内毛细血管生长较快,管壁空隙大,NS容易通过而进入肿瘤细胞间[6]。
我们用异型双功能交联剂SPDP,将抗人肝癌单克隆抗体HAb18与载SAF人血清白蛋白毫微球偶联,制成免疫毫微球HAb18-HSA(SAF)-NS。体外杀伤实验证明,HAb18-HSA(SAF)-NS具有对靶细胞的特异杀伤性,并比SAF具有更强大的杀伤肿瘤细胞的活性。体内应用时,HAb18-HSA(SAF)-NS由于主动靶向作用,选择性地集中于肝癌组织,且毫微球具有缓释作用,SAF释药慢,使肝癌组织较长时间处于有效的药物浓度中,与单用药物SAF相比具有更强的杀伤活性,是一种有效的肝癌靶向治疗制剂。
1Zavaglia C,Airoldi A,Mancuso A,et al.Adverse events affect sorafenib efficacy in patients with recurrent hepatocellular carcinoma after liver transplantation:experience at a single center and review of the literature.Eur J GastroenterolHepatol,2013,25(2):180-186.
2Lencioni R,Kudo M,Ye SL,et al.First interim analysis of the GIDEON(Global Investigation of therapeutic decisions in hepatocellular carcinoma and of its treatment with sorafeNib)non-interventional study.Int J Clin Pract,2012,66(7):675-683.
3阚和平,王宇,谭永法,等.阿霉素免疫毫微粒对多药耐药肝癌的体内杀伤作用.南方医科大学学报,2009,29(8):1617-1619.
4Kulhari H,Pooja D,Shrivastava S,et al.Peptide conjugated polymeric nanoparticles as a carrier for targeted delivery of docetaxel. Colloids Surf B Biointerfaces,2014,23(2):166-173.
5戚宁,杜明华,张东生,等.制备单抗偶联载阿霉素白蛋白免疫毫微球的初步研究.东南大学学报,2012,31(4):393-397.
6刘晓波,蔡美英,阚和平,等.载131I和阿霉素“双弹头”F(ab′)2片段免疫毫微粒的抗人肝癌作用.实用癌症杂志,2007,22(1):1-4.
7Cheng AL,Kang YK,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phase III randomized,double-blind,placebo-controlled trial.Lancet Oncol,2009,10(1):25-34.
8Chung YH,Han G,Yoon JH,et al.Interim analysis of START: study in Asia of the combination of TACE(transcatheter arterial chemoembolization)with sorafenib in patients with hepatocellular carcinoma trial.Int J Cancer,2013,132(10):2448-2458.
9Li QY,Liu C,Zhao XH,et al.Preparation,characterization and targeting of micronized 10-hydroxycamptothecin-loaded folate-conjugated human serum albumin nanoparticles to cancer cells.Int J Nanomedicine,2011,6:397-405.
10 Zhang DY,Shen XZ,Wang JY,et al.Preparation of chitosanpolyaspartic acid-5-fluorouracil nanoparticles and its anti-carcinoma effect on tumor growth in nude mice.World J Gastroenterol,2008,14: 3554-3562.
Preparation and antitumor effects of immunonanospheres containing sorafenib against human liver can-cer in vitro and in vivo
SHU Miao-jiang,KAN He-ping,YUAN Lin,TAN Yong-fa,ZHOU Jie.Department of Hepatobilliary Surgery,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China
ObjectiveTo prepare immunonanospheres containing sorafenib[HAb18-HSA(SAF)-NS]against human liver cancer and evaluate its immunoreactivity and effects on cancer.Methods HAb18-HAS (SAF)-NS was prepared by intermolecular cross-linking the monoclonal antibody HAb18 with human serum albumin nanospheres containing SAF[HAS(SAF)-NS]via a new heterobifunctional cross-linker SPDP.Condensation test and immunofluorescence assay were used to evaluate the immunoreactivity,and the specific binding of HAb18-HSA(SAF)-NS with liver cancer cell line SMMC-7721 was observed by microscope and electron-microscope.The specific cytotoxic effects on target cells were evaluated in vitro by MTT assay. HAb18-HSA(SAF)-NS,HSA(SAF)-NS and SAF were separately injected into nude mice bearing human liver carcinoma to observe the inhibitory activity of HAb18-HSA(SAF)-NS in vivo.Results The immunoreactivity of HAb18-HSA(SAF)-NS was well preserved.Under electron-microscope,HAb18-HSA(SAF)-NS could bind SMMC-7721 cells specifically.IC50 value for HAb18-HSA(SAF)-NS on SMMC-7721 cells was 42.4 μg/mL,which was lower than that of HSA(SAF)-NS(368.9 μg/mL)and SAF(377.5 μg/mL).The inhibitory rate of HAb18-HSA(SAF)-NS on the growth of liver cancer xenografts was significantly higher than that of HSA(SAF)-NS or SAF(P<0.001).Conclusion HAb18-HSA(SAF)-NS has immunoreactivity and specific targeting to the liver cancer cells.The anticancer ability of HAb18-HSA(SAF)-NS is significantly higher than that of HSA(SAF)-NS and SAF.
Immunonanospheres;Sorafenib;Monoclonal antibody;Liver cancer
2014-02-26)
(本文编辑:肖冰)
10.3961/j.issn.1672-2159.2014.02.002
510515南方医科大学南方医院肝胆外科
阚和平,E-mail:kanhep@163.com
广东省自然科学基金(S2012020010942)
