人主动脉瓣膜钙化过程中Th17/Treg细胞比率的变化
2014-03-06王彬史嘉伟董念国
王彬 史嘉伟 董念国
.基础研究.
人主动脉瓣膜钙化过程中Th17/Treg细胞比率的变化
王彬 史嘉伟 董念国
目的 研究Th17/Treg细胞是否参与主动脉瓣膜钙化及其与瓣膜钙化发生相关的可能机制。方法 人主动脉瓣膜组织分为3组(n=10):(1)对照组:瓣膜来自扩张型心肌病需心脏移植的受体,排除瓣膜组织病理改变者;(2)纤维化组:瓣膜来自严重主动脉瓣膜钙化需瓣膜置换术者,取远离瓣膜钙化部位,纤维化增生组织,排除风湿热及心内膜炎病史者;(3)钙化组:瓣膜来源同纤维化组,取瓣膜明显钙化组织。分别进行von kossa染色、免疫组织化学分析,用于进一步指导瓣膜组织分组;RT-PCR分析,检测瓣膜组织内Th17/Treg细胞浸润情况。结果 对照组无Th17/Treg细胞浸润;纤维化组Th17细胞浸润明显高于钙化组(0.904±0.079比0.445±0.057,P<0.01);钙化组Treg细胞浸润明显高于纤维化组(0.900±0.058比0.396±0.032,P<0.01)。结论 主动脉瓣膜钙化与纤维化组织中Th17/Treg细胞比率不同,调控Th17/Treg细胞分化趋势或许可以干预主动脉瓣膜钙化进程。
主动脉瓣膜钙化; Th17细胞; Treg细胞
主动脉瓣膜钙化是老年人群中最常见的心脏瓣膜疾病,也是心血管疾病导致死亡的三大原因之一[1]。关于主动脉瓣膜钙化病理机制目前了解很少,还没有药物可以阻止或延缓瓣膜钙化的发生发展,主动脉瓣膜置换术仍是严重瓣膜钙化唯一有效的治疗手段[2]。钙化主动脉瓣膜组织病理检测,可见组织内大量脂质沉积,炎症细胞浸润,新生血管及软骨和骨组织形成,类似于动脉粥样硬化慢性炎症改变。Th17/Treg细胞参与了多种组织慢性炎症的形成,本研究拟检测Th17/Treg细胞是否参与主动脉瓣膜钙化过程。
1 材料与方法
1.1 材料
经医院伦理委员会批准,遵循知情同意原则,搜集手术时切除的主动脉瓣膜组织。骨桥蛋白(OPN),α-平滑肌肌纤蛋白(α-SMA),CD4,维甲酸孤儿受体-rt(retinoid orphan receptor-rt,RoRrt)和翅膀状螺旋转录因子(forkhead box protein-3,FOXP3)抗体购自Bioworld公司;免疫组织化学试剂购自武汉三鹰生物技术有限公司;Trizol和聚合酶链反应(PCR)引物购自Invitrogen公司,逆转录(RT)试剂盒和PCR反应体系购自Fermentas公司。
1.2 实验分组
主动脉瓣膜分为3组(n=10):(1)对照组:瓣膜来自扩张型心肌病需心脏移植的受体,排除瓣膜组织病理改变者;(2)纤维化组:瓣膜来自严重主动脉瓣膜钙化需瓣膜置换术者,排除风湿热及心内膜炎病史者,取瓣膜明显纤维性增生组织;(3)钙化组:主动脉瓣膜来源同纤维化组,取瓣膜明显钙化组织。
1.3 von Kossa染色
磷酸盐缓冲液(PBS)将瓣叶漂洗2次,紫外线曝光下2%硝酸银溶液浸泡20 min,双蒸水洗涤5 min,5%亚硫酸钠溶液浸泡2 min,水洗晾干,苏木精复染2 min,乙醇脱水,二甲苯透明,中性树胶封片,镜检拍照。
1.4 免疫组织化学染色
切片脱蜡至水,修复抗原,3%过氧化氢阻断内源性过氧化物酶,滴加1∶150一抗液,于4℃湿盒中孵育过夜;PBS冲洗3次,滴加1∶100生物素标记二抗,室温孵育30 min;PBS冲洗3次,辣根酶标记,室温孵育30 min;PBS冲洗4次,DAB显色;冲洗,苏木精复染,封片,镜检拍照。
1.5 免疫组织荧光双标染色
实验方法基本同于免疫组织化学染色,相应二抗需用荧光素标记,若检测第一种抗体选用的是红色荧光,则第二种必须选择其他颜色的荧光素标记。NIKON Eclipse 80i荧光显微镜下观察。
1.6 RT-PCR法检测RoRrt和FOXP3基因表达
根据Trizol试剂盒说明提取组织内总RNA,紫外分光光度计测定RNA浓度和纯度。取5 μg总RNA逆转录为cDNA,PCR法进行目的基因扩增(表1)。各反应体系均以β-actin作为内参引物,最终产物5 μl行琼脂糖凝胶电泳,软件分析凝胶图像目的基因灰度值。
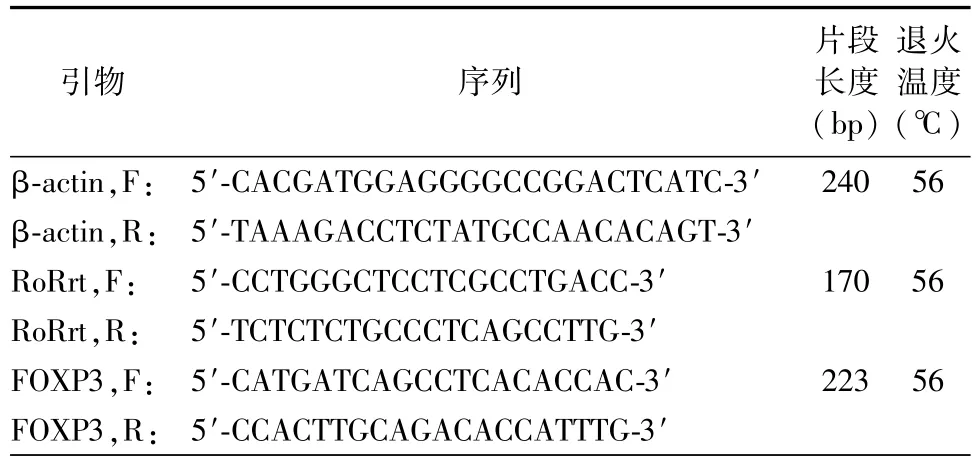
表1 引物扩增片段和退火温度
反应条件:50℃2 min;95℃10 min一个循环,95℃30 s;60℃30 s 30个循环。
1.7 统计学方法
2 结果
2.1 von Kossa染色
对照组内无钙盐沉积;纤维化组内无钙盐沉积;钙化组内可见明显钙盐沉积(图1)。
2.2 免疫组织化学染色
OPN在对照组内无阳性表达,纤维化组内有少量表达,钙化组内表达明显;α-SMA在对照组及钙化组内可见少量表达,纤维化组内表达明显(图2)。
2.3 免疫组织荧光双标染色
对照组内无CD4++RoRrt+和CD4++FOXP3+细胞浸润;纤维化组内CD4++RoRrt+细胞浸润明显,CD4++FOXP3+细胞浸润较少;钙化组内CD4++RoRrt+细胞浸润较少,CD4++FOXP3+细胞浸润明显(图3)。
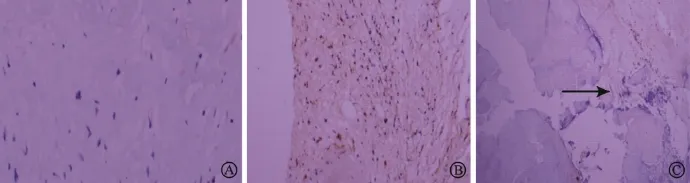
图1 组织von Kossa染色结果(×200):A,B:对照组、纤维化组内未见钙结节形成;C:钙化组内可见明显钙结节形成(箭头所示)
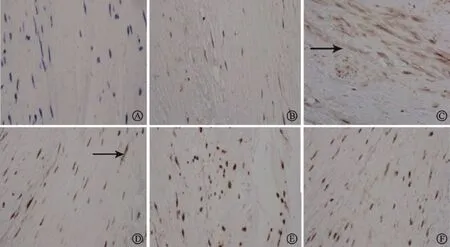
图2 组织免疫组织化学染色结果(×200):A:对照组内未见OPN表达,B:纤维化组可见OPN少量表达,C:钙化组内可见OPN明显表达(箭头所示),D:对照组内α-SMA少量表达(箭头所示),E:纤维化组内α-SMA明显表达,F:钙化组内α-SMA可见表达
2.4 RT-PCR法检测结果
纤维化组和钙化组均见RoRrt和FOXP3基因条带,对照组未见阳性条带。Bandscan图像处理软件计算纤维化组和钙化组目的基因与内参条带灰度比值,提示纤维化组内RoRrt表达量明显高于钙化组(P<0.01),钙化组内FOXP3表达量明显高于纤维化组(P<0.01)(表2)。
表2 纤维化组与钙化组内目的基因与内参灰度值比较(±s)

表2 纤维化组与钙化组内目的基因与内参灰度值比较(±s)
注:与钙化组比较,aP<0.01
组别样本数RoRrt/β-actin FOXP3/β-actin纤维化组10 0.904±0.079a0.396±0.032a钙化组 10 0.445±0.057 0.900±0.058
3 讨论
退行性主动脉瓣膜钙化的发生发展是多因素引起的,最初被认为是随着年龄的增高,瓣膜老化、磨损导致钙磷无机物被动组织沉积引起的[3]。目前研究已经证实,主动脉瓣膜钙化的形成类似于动脉粥样硬化病理改变过程,是细胞及细胞分子相互作用,瓣膜间质细胞、增生,并向成骨样细胞表型转化,主动发生的瓣膜组织异位钙化过程[4]。
主动脉瓣膜钙化过程中,局部组织内持续存在的慢性炎症对促进瓣膜钙化形成具有重要作用。Th17细胞在组织炎症反应和自身免疫性疾病形成中具有关键性作用。研究表明,Th17细胞最先浸润到组织受损部位,通过分泌白细胞介素(IL)-17、IL-21等炎性细胞因子,进一步趋化其他促炎细胞(中性白细胞,Th1细胞等)进入病变组织,加剧局部组织炎症反应程度,已经证实Th17细胞在动脉粥样硬化慢性炎症形成中发挥了重要作用[5-6]。Treg细胞具有免疫抑制和抗炎功能,主要分泌抗炎因子IL-10、TGF-β1,它可全面抑制Th17细胞的活化、增生及生物活性,下调机体免疫反应程度,避免过度的炎症反应对机体造成损伤[7]。Th17细胞具有促炎、促免疫反应发生作用,Treg细胞具有抗炎、抗免疫反应功能,两者自幼稚T细胞分化形成时来自共同的未分化前体细胞,分化成熟过程中还具有相互抑制现象[8]。关于Th17/Treg细胞在多种组织慢性炎症疾病及免疫性疾病发生发展过程中的作用已被大量报道[9],是否在主动脉瓣膜钙化形成中也发挥作用,目前未见报道。

图3 组织免疫组织荧光双标染色结果(×400):A:对照组未见CD4++RoRrt+细胞浸润,B:纤维化组明显CD4++RoRrt+细胞浸润,C:钙化组CD4++RoRrt+细胞少量浸润(箭头所示),D:对照组未见CD4++FOXP3+细胞浸润,E:纤维化组CD4++FOXP3+细胞少量浸润,F:钙化组CD4++FOXP3+细胞明显浸润(箭头所示)
正常主动脉瓣膜主要由内皮细胞、瓣膜间质细胞和细胞外基质组成。当瓣膜组织受到损害性刺激时,间质细胞可活化、增生,转化为肌成纤维细胞,合成与破坏细胞外基质的活性增强。长期反复的慢性炎症刺激,可诱发瓣膜间质细胞向成骨样细胞表型转化,最终导致瓣膜组织钙化形成。本研究对照组来自扩张型心肌病需心脏移植的患者,瓣膜组织内无钙磷沉积和OPN阳性表达,少量表达α-SMA,可以认为是正常主动脉瓣膜组织。我们的结果表明,正常主动脉瓣膜内无Th17/Treg细胞浸润。
主动脉瓣膜在各种刺激因素作用下,由早期出现的纤维性增生到终末期组织内异位钙化形成是一个长期的慢性炎症改变过程。瓣膜组织内钙化形成,可以认为是组织慢性炎症反应的最终结局,是机体一种自我保护机制,同时也意味着局部炎症反应基本消失。我们的研究表明,纤维化组内α-SMA表达最明显,此时瓣膜间质细胞活化、增生程度最为剧烈,同时组织内Th17细胞明显浸润,RoRrt基因表达量明显高于钙化组;钙化组内OPN明显表达,表明瓣膜组织内异位钙化已经形成,炎症反应趋于终结,同时组织内Treg细胞浸润明显,FOXP3基因表达量明显高于纤维化组。上述结果表明,在瓣膜组织发生纤维性增生时,组织内促炎症反应细胞Th17大量浸润,使局部炎症反应加剧并持续存在;瓣膜组织内钙化形成时,抑制炎症反应的Treg细胞浸润明显增多,促使局部炎症反应趋于消失。
瓣膜内皮细胞受损被认为是瓣膜钙化发生的始发因素,瓣膜内皮损伤及基底膜断裂,脂质及其他化合物的沉积,可诱发机体产生针对局部组织的慢性免疫炎症反应[10]。在炎症反应早期,Th17细胞大量浸润瓣膜组织内。Th17细胞主要分泌IL-17,IL-17与其受体结合后可诱导细胞分泌IL-1、IL-6、TNF、IL-8、基质金属蛋白酶和趋化细胞因子等,这些炎症介质协同作用,可以进一步趋化其他炎性细胞进入组织受损部位,加剧组织炎症损伤。有报道称,IL-17可以诱导各种促血管生成因子合成,促进病变组织新生血管增多,有助于淋巴细胞局部组织浸润,更好地发挥机体免疫调节功能[11]。当瓣膜组织内钙化形成,慢性炎症反应趋于终结时,具有抑制免疫反应和抗炎功能的Treg细胞浸润明显增加,Treg细胞通过细胞接触抑制或分泌抗炎细胞因子IL-10和TGF-β1发挥其生理功能。Treg细胞浸润增多,从而全面抑制Th17细胞的生物活性,下调机体免疫反应程度,避免过度的炎症反应对机体造成损伤。基于Th17/Treg细胞由共同未分化前体T细胞形成及他们生物活性相互拮抗的特点,大量基础及临床研究开始探索通过调控两者之间比率变化来治疗各种炎症性疾病和恶性肿瘤。
本研究首次证实了Th17/Treg细胞参与了主动脉瓣膜钙化过程,Th17细胞可促进主动脉瓣膜钙化过程中慢性炎症形成,Treg细胞可全面拮抗Th17细胞的生物活性,使瓣膜组织内炎症反应消失。因此,通过调控Th17/Treg细胞分化趋势,可以干预主动脉瓣膜钙化进程。在瓣膜组织疾病演变过程中,组织内浸润的Th17/Treg细胞比率也是不断变化的。根据局部组织内微环境信号的不同,Th17/Treg细胞可互相调控,两者比率发生微妙变化,从而控制局部炎症反应的发生或消失。
总之,主动脉瓣膜钙化的发生发展是多因素引起的,虽然大量的临床与基础研究从各个方面试图去解释其形成的病理生理机制,但目前对其发病机制还了解很少。Th17/Treg细胞参与了主动脉瓣膜钙化形成,可能在瓣膜组织慢性炎症的形成与消亡中发挥了一定作用,明白它们之间在主动脉瓣膜钙化发展过程中的微妙变化,可以为我们探索主动脉瓣膜钙化形成的病理生理机制打开新的思路。
[1]Mathieu P,Despres JP,Pibarot P.The‘valvulo-metabolic’risk in calcific aortic valve disease[J].Can J Cardiol,2007,23 Suppl B:32B-39B.
[2]Hu HJ,Cheng HQ,Liu J,et al.The preliminary study of rat aortic valve interstitial cells calcification induced by high glucose[J].Chin J Cardiovascular Med,2014,19:205-208.(in Chinese)呼海娟,陈会强,刘静,等.高糖诱导大鼠心脏瓣膜间质细胞钙化的初步研究[J].中国心血管杂志,2014,19:205-208.
[3]Sverdlov AL,Ngo DT,Chapman MJ,et al.Pathogenesis of aortic stenosis:not just a matter of wear and tear[J].Am J Cardiovasc Dis,2011,1:185-199.
[4]Zhao SM,Li HW.Progress in the field of valvuar heart disease[J].Chin J Cardiovascular Med,2014,19:76-77.(in Chinese)赵树梅,李虹伟.瓣膜性心脏病诊治进展[J].中国心血管杂志,2014,19:76-77.
[5]Dong C.Differentiation and function of pro-inflammatory Th17 cells[J].Microbes Infect,2009,11:584-588.
[6]Zhang H,Chen J,Liu X,et al.IL-17 induces expression of vascular cell adhesion molecule through signalling pathway of NF-kappaB,but not Akt1 and TAK1 in vascular smooth muscle cells[J].Scand J Immunol,2013,77:230-237.
[7]Barbi J,Pardoll D,Pan F.Metabolic control of the Treg/Th17 axis[J].Immunol Rev,2013,252:52-77.
[8]Weaver CT,Hatton RD.Interplay between the TH17 and TReg cell lineages:a(co-)evolutionary perspective[J].Nat Rev Immunol,2009,9:883-889.
[9]Jamshidian A,Shaygannejad V,Pourazar A,et al.Biased Treg/ Th17 balance away from regulatory toward inflammatory phenotype in relapsed multiple sclerosis and its correlation with severity of symptoms[J].J Neuroimmunol,2013,262:106-112.
[10]Steiner I,Krbal L,Rozkos T,et al.Calcific aortic valve stenosis:Immunohistochemical analysis of inflammatory infiltrate[J].Pathol Res Pract,2012,208:231-234.
[11]Takahashi H,Numasaki M,Lotze MT,et al.Interleukin-17 enhances bFGF-,HGF-and VEGF-induced growth of vascular endothelial cells[J].Immunol Lett,2005,98:189-193.
Change of Th17/Treg cells ratio in the process of aortic valve calcification
Wang Bin,Shi Jiawei,Dong Nianguo.
Department of Cardiovascular Surgery,Union Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430022,China
Objective To study whether Th17/Treg cell taking part in the development of aortic valve(AV)calcification.M ethods The tissue of AV was divided into three groups(n=10):control group,fibrous degeneration group and calcification group.Valve tissue in control group was taken from patients being subject to heart transplantation because of dilated cardiomyopathy,excluding valves with pathological change.Valve tissue in fibrous degeneration group was taken from location being away from calcification change,only fibrous thickening in patients being subject to valve replacement because of severe AV calcification,and excluding patients with rheumatism and endocarditis.Valve source in calcification group was the same of fibrous degeneration group,but taken from location being obvious calcification.Every sample was tested by von kossa stain or immunohistochemistry analysis and reverse transcription polymerase chain reaction(RT-PCR).Results Th17/Treg cells were not present in control group.In fibrous degeneration group,the level of Th17 cell infiltration was significantly higher than that of calcification group (0.904±0.079 vs.0.445±0.057,P<0.01).The level of Treg cell infiltration in calcification group was significantly higher than in fibrous degeneration group(0.900±0.058 vs.0.396±0.032,P<0.01).Conclusions The ratio of Th17/Treg cells is different in aortic valve calcification and fibrosis tissue.By controlling the tendency of Th17/Treg cells differentiation may interfere the progression of AV calcification.
Aortic valve calcification; Th17 cell; Treg cell
Dong Nianguo,Email:Dongnianguo@hotmail.com
2014-02-15)
(本文编辑:周白瑜)
This work was supported by a grant from the National Natural Science Foundation of China(No.87210297)
10.3969/j.issn.1007-5410.2014.04.010
国家自然科学基金项目(87210297)
430022武汉,华中科技大学同济医学院附属协和医院心血管外科
董念国,电子信箱:Dongnianguo@hotmail.com
