3种无创检查在前列腺癌初筛诊断中的应用价值
2014-03-04胡卫列韩立新曹惠霞
曹 曙,胡卫列△,韩立新,曹惠霞
(广州军区广州总医院:1.泌尿外科;2.磁共振室,广州510000)
在西方国家,前列腺癌作为最常见的男性恶性肿瘤,在恶性肿瘤中具有最高的发病率及第3高的死亡率[1]。中国前列腺癌发病率虽远低于西方国家,但伴随人口总数增长、人口老龄化显现及人们生活习惯改变,其发病率及死亡率均逐年上升[2]。前列腺穿刺活检作为临床诊断金标准,却受并发症、操作水平等制约,存在阳性率不高的问题。直肠指检(direct rectal examination,DRE)、经直肠超声检查(transrectal ultra-sonography,TRUS)及多参数磁共振检查(multiparametric magnetic resonance imaging,MP-MRI)仍是诊断前列腺癌的重要方法。本研究回顾分析113例临床疑似前列腺癌患者的检查数据,探讨3种无创检查方法诊断前列腺癌的应用价值。
1 资料与方法
1.1 一般资料 选择2011年6月至2013年6月本院收治的疑似前列腺癌患者113例。临床症状有进行性排尿困难、急性尿潴留、尿频、无痛性肉眼血尿、夜尿增多等表现,前列腺特异性抗原(prostate-specificantigen,PSA)均大于4 ng/mL。每例患者均依次接受DRE、TRUS及MP-MRI检查,后在系统10针穿刺法的基础上结合MP-MRI所示可疑区域有重点地行经直肠前列腺穿刺活检。其中,由穿刺活检及前列腺电切术等病理检查确诊前列腺癌51例,年龄52~85岁,平均(65.5±7.4)岁。其中PSA处于PSA 4.0~10.0 ng/mL的灰区前列腺癌18例。经穿刺活检或前列腺电切术后病理检查确诊为前列腺增生62例,年龄45~81岁,平均(60.2±9.4)岁。国际前列腺症状评分(IPSS)为14~33分,平均20.9分。
1.2 诊断方法
1.2.1 DRE 由2名泌尿外科医师共同完成,明确前列腺大小、质地、是否有结节等。符合下列情况拟诊前列腺癌:(1)前列腺质地变硬;(2)前列腺表面不光滑,触及结节、包块。
1.2.2 TRUS 由超声科采用宽频直肠探头彩超仪(频率为6.95 MHz)进行,观察前列腺体积、形态及其内部回声表现、包膜连续性、血流分布等情况。符合以下情况拟诊前列腺癌:(1)前列腺内异常低回声结节;(2)彩色血流图见前列腺内血流增多,局部血流特征改变;(3)前列腺包膜连续性中断。
1.2.3 MRI 由院磁共振室使用GE 3.0T HDx T MRI扫描仪依次完成T2加权成像、弥散加权成像及动态对比增强扫描,数据由美国GE公司A W4.5工作站完成分析,2名副主任医师共同阅片。符合下列情况拟诊前列腺癌:(1)T2加权图像上外周带内低信号结节,一侧或部分外周带呈低信号;(2)弥散增强序列图像上出现异常高信号区伴ADC明显下降;(3)动态对比增强图像上表现“快进快出”区域。
1.3 统计学处理 采用SPSS13.0软件包处理数据,计数资料的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 3种无创检查对113例患者的诊断结果 在113例前列腺癌疑似患者中,DRE的灵敏度为33.3%,特异度为88.7%;TRUS的灵敏度为62.7%,特异度为67.7%;MP-MRI的灵敏度为86.3%,特异度为83.9%。进一步χ2检验后发现在诊断前列腺癌方面,3组间两两比较差异均具有统计学意义(P<0.05),可认为MP-MRI灵敏度最高,TRUS特异度最低。见表1。

表1 3种无创检查对所有疑似前列腺癌患者的 诊断结果比较[n(%)]
2.2 3种无创检查对PSA灰区疑似前列腺癌患者的诊断结果 在PSA4.0~10.0 ng/mL的PSA灰区疑似前列腺癌患者中诊断前列腺癌,DRE的灵敏度为27.8%,特异度为86.5%;TRUS的灵敏度为44.4%,特异度为59.5%;MP-MRI的灵敏度为77.8%,特异度为81.1%。经χ2检验,3组间两两比较,差异均具有统计学意义(P<0.05),可认为在PSA灰区前列腺癌诊断中,同样MP-MRI灵敏度最高,TRUS特异度最低。见表2。
2.3 3种无创检查对穿刺活检在PSA灰区前列腺癌诊断中的补充作用 18例PSA灰区前列腺癌中穿刺活检假阴性6例,其诊断阳性率为66.7%。而穿刺基础上,联合DRE诊断阳性率为66.7%[(12+0)/18];联合TRUS诊断阳性率为72.2%[(12+1)/18];联 合MP-MRI诊 断 阳 性 率 则 高 达88.9%[(12+4)/18]。见表3。
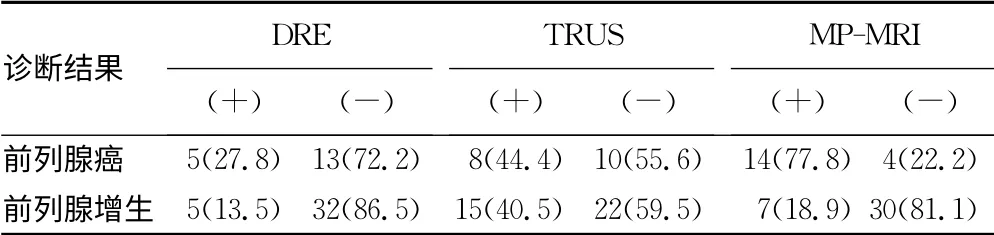
表2 3种无创检查对PSA灰区疑似前列腺癌患者的 诊断结果比较[n(%)]
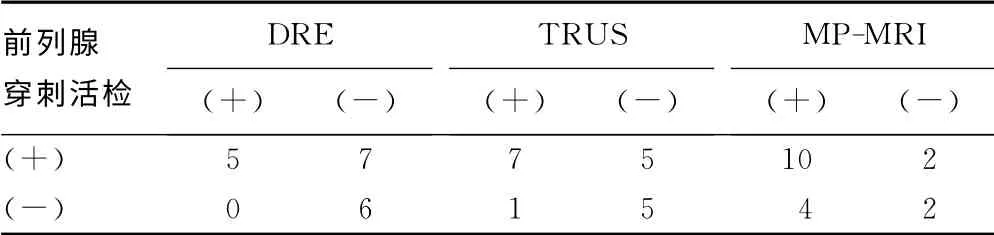
表3 3种无创检查对穿刺活检在PSA灰区前列腺癌 诊断中的补充作用(n)
3 讨 论
PSA、PSA密度和f PSA/t PSA等指标广泛应用于临床,以提高前列腺癌早期诊断率。但受炎症、增生等因素干扰,PSA检查诊断前列腺癌,特别是诊断PSA 4.0~10.0 ng/mL的PSA灰区前列腺癌的敏感度和特异度并不令人满意[3]。而前列腺穿刺活检阳性率也有待进一步提高。因此,DRE、TRUS及MP-MRI等无创检查对前列腺癌的临床诊断仍具重要价值。
DRE操作简便,可发现较大肿瘤,有助于前列腺癌的诊断和分期。文献指出单用DRE诊断前列腺癌漏诊率为48%~85%[4]。本研究113例患者中,DRE的漏诊率为66.7%,灵敏度仅33.3%。而18例灰区前列腺癌患者中,漏诊率更高达72.7%,灵敏度27.8%。高漏诊率可能与肿瘤起源于前列腺中央带或移行带、肿瘤体积小等因素相关。
TRUS可显示前列腺内结构、血流变化,精确测量前列腺和肿瘤体积。文献报道单用TRUS确诊率约60%,漏诊率40%[5]。本研究中,针对所有疑似前列腺癌患者,TRUS灵敏度为62.7%,特异度为67.7%,漏诊率37.3%;而诊断PSA灰区前列腺癌,TRUS的漏诊率上升至55.6%,灵敏度、特异度均较前明显下降。分析其原因可能与前列腺癌结节超声表现不典型及超声医师操作水平等相关。
目前,MRI凭借无创性及多参数多序列成像能力被认为是前列腺癌最佳影像学诊断技术。它软组织分辨率高,可清晰显示前列腺各分区解剖结构及包膜,能明确肿瘤位置、大小和向外侵袭等情况。常规T2加权成像对外周带肿瘤敏感性高,却难以检出发生于中央腺体的肿瘤[6]。近年来,随着弥散加权成像、体素内无规则运动核磁成像及动态对比增强成像等MRI功能成像技术的加入,其诊断能力也不断提高[7-9]。本研究中,MP-MRI表现出令人满意的检测效能。单独使用MPMRI诊断前列腺癌,灵敏度为86.3%,特异度为83.9%,漏诊率仅为13.7%。PSA灰区前列腺癌的诊断中,其灵敏度仍可达77.8%,特异度81.1%。而在穿刺活检基础上,联合运用MP-MRI可使灰区前列腺癌的诊断符合率由单用穿刺活检的66.7%升至88.9%。MP-MRI的各项检测数据都明显优于DRE及TRUS。联合穿刺活检及MP-MRI,将有效提高前列腺癌特别是灰区前列腺癌诊断率,减少漏诊、误诊的发生。分析其原因可能与以下几点相关:(1)高信噪比的3.0T MRI扫描,配合多种MRI功能成像技术,增强了鉴别前列腺良、恶性疾病的能力;(2)前列腺癌多发于MRI敏感性最高的外周带;(3)作为一个小样本研究,且大部分采用穿刺活检病理结果作为标准,可能遗漏一些微小的肿瘤病灶。当然,MP-MRI不仅能清楚显示肿瘤的位置、体积和侵袭情况,还能获取表观扩散系数ADC和弥散系数D等可评估肿瘤恶性程度的参数[10-11]。因此,MP-MRI不仅有助于前列腺癌的诊断和分期,还有助于对其恶性程度和预后的评估。另外,国外报道称运用MRI引导经直肠前列腺穿刺活检,可提高穿刺活检的阳性率[12]。
DRE、TRUS及MP-MRI等无创检查具有简便易行、可重复等优点。其中,MP-MRI在诊断前列腺癌诊断中表现出了高检测效能。虽然尚不能代替穿刺活检,但是其联合穿刺活检使用则可明显提高前列腺癌特别是PSA灰区前列腺癌的确诊率,减少漏诊、误诊的发生。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]李鸣,张思维,马建辉,等.中国部分市县前列腺癌发病趋势比较 研 究[J].中 华 泌 尿 外 科 杂 志,2009,30(6):368-370.
[3]那彦群,郭震华.实用泌尿外科学[M].北京:人民卫生出版社,2009:359-370.
[4]Fowler JE,Brooks J,Pandey P,et a1.Variable histologyof anastomotic biopsies with detectable prostate specificantigen after radical prostatectomy[J].J Urol,1995,153(3Pt21):1011-1014.
[5]林延双,梁建波,何大光,等.联合血清TPSA、TRUS、DRE诊断前列腺癌的临床研究[J].中国男科学杂志,2007,21(3):37-40.
[6]陈敏,李春媚.前列腺癌磁共振成像诊断要点与临床治疗方案选择[J].磁共振成像,2011,2(3):225-232.
[7]Vargas HA,Akin O,Franiel T,et al.Diffusion-weightedendorectal MR imaging at 3 T for prostate cancer:tumordetection and assessment of aggressiveness[J].Radiol,2011,259(3):775-784.
[8]Sigmund EE,Cho GY,Kim S,et al.Intravoxel incoherentmotion imaging of tumor microenvironment in locally advanced breast cancer[J].Magn Reson Med,2011,65(5):1437-1447.
[9]Franiel T,Hamm B,Hricak H.Dynamic contrast-enhanced magnetic resonance imaging and pharmacokinetic modelsin prostate cancer[J].Eur Radiol,2011,21(3):616-626.
[10]Pang Y,Turkbey B,Bernardo M,et al.Intravoxel incoherent motion MR imaging for prostate cancer:an evaluation of perfusion fraction and diffusion coefficient derivedfrom different b-value combinations[J].Magn ResonMed,2013,69(2):553-562.
[11]Hambrock T,Somford DM,Huisman HJ,et al.Relation-ship between apparent diffusion coefficients at 3.0-T MRimaging and Gleason grade in peripheral zone prostatecancer[J].Radiol,2011,259(2):453-461.
[12]Pinto PA,Chung PH,Rastinehad AR,et al.Magnetic resonance imaging/ultrasound fusion guided prostate biopsyimproves cancer detection following trans rectal ultra-sound biopsy and correlates with multiparametric magnetic resonance imaging[J].J Urol,2011,186(4):1281-1285.
