小鼠脂肪干细胞分离培养方法*
2014-03-04杨泽龙张兰芳周广东
蒋 婷,杨泽龙,白 倩,张兰芳,雷 英,周广东,刘 伟
(1.川北医学院第二临床学院/南充市中心医院烧伤整形美容外科,四川南充637000;2.川北医学院第二临床学院/南充市中心医院骨科,四川南充637000;3.上海交通大学医学院附属第九人民医院整形外科/上海市组织工程重点实验室 200011)
成体干细胞因其分布广、增殖力强且具有多分化潜能而成为当前组织工程种子细胞研究的重点。成体干细胞可来源于骨髓、脂肪、皮肤、肌肉、角膜等各类组织。其中以骨髓间充质干细胞(bone marrow stem cells,BMSCs)研究最多,应用最广。随着研究的不断深入,脂肪干细胞(adipose-derived stem cells,ASCs)逐渐被人 们发 现并广泛研 究。1994年,Kaplan 等[1]报道了患者皮下脂肪组织存在异位成骨的现象,提出脂肪前体细胞具有成骨细胞分化的潜能。Zuk 等[2]于2001年从脂肪抽吸物的上层脂肪组织中成功分离培养出具有骨、软骨、脂肪、肌肉等多向分化潜能的细胞。同年,Gronthos 等[3]对脂肪抽吸物培养细胞的表面标记进行了系统的研究,结果表明这些脂肪细胞具有与骨髓间充质干细胞相似的表面抗原表达,CD29、CD105、CD106、CD166 等干细胞相关表面抗原均有一定的阳性率,并明确指出脂肪干细胞的确存在,脂肪干细胞的概念由此正式提出。此后人们对脂肪干细胞作了大量的研究[4-6],但主要集中于人来源的ASCs,对小鼠脂肪组织来源的ASCs 研究相对较少。小鼠是医学研究领域中常用的实验动物之一,本实验室以小鼠为动物模型进行了大量的研究,应用脂肪干细胞进行多种组织工程化组织构建,需要大量优质的种子细胞。本研究以小鼠作为试验动物模型,拟建立一种简单高效的体外分离培养小鼠脂肪干细胞(mouse adipose-derived stem cells,m ASCs)的方法,对其表面标志和多向分化潜能进行鉴定,为进一步分析小鼠脂肪干细胞的生物学特性提供实验依据,现报道如下。
1 材料与方法
1.1 动物与试剂 6~8周龄C57BL/6雌雄小鼠(上海斯莱克实验动物有限责任公司)。胶原酶NB4(Serva公司),DMEM(HyClone 公司),胎牛血清(SAFC Bioscience 公司),TGF-β3、BMP6 及IGF1(R&D公司),Ⅱ型胶原抗体(Neo Markers 公司),流式抗体(eBioscience 公司)。
1.2 m ASCs 体外分离与培养 实验小鼠断颈处死后浸泡于75%乙醇中15 min,无菌条件下切取收集双侧腹股沟脂肪组织。将收集的脂肪组织剪碎后置于50 m L的离心管内,加入适量的氯霉素浸泡15 min(以没过脂肪组织为宜)后2~3 倍体积的PBS 冲洗3次。选择离心半径11.5 cm,速度为1500 r/min 离心5min 后弃上清液,再加入5 倍体积的0.1%胶原酶NB4,将离心管置于37 ℃恒温汽浴摇床内消化1.5~2.0 h,150 目无菌网筛滤去未被消化的残余组织。选择离心半径11.5 cm、速度为1500 r/min 离心5 min,弃上清液,细胞沉淀用PBS 洗涤2 次,以同前参数再次离心弃上清液,收集所获得的细胞计数并按1 ×105个/cm2的密度,将其种植于培养皿内,加入低糖DMEM培养液(含10% FBS、100U/mL青霉素和100 mg/m L 链霉素)。置于培养箱中培养,每3 天换液,待细胞生长达到90%融合时消化传代。用0.25%胰蛋白酶消化后接种于新的培养皿,传代接种的细胞密度为(0.5~1.0)×104个/cm2。当再次达到90%融合时,继续传代培养。
1.3 生长曲线 分别取第2、8 代m ASCs,消化,制备成浓度为1 ×104个/mL单细胞悬液。将细胞悬液按每孔1mL的量接种于24 孔培养板内,并将其分为8 组,每组3 孔。接种培养后第1 天用0.25%胰蛋白酶消化第1 组,制成细胞悬液1 mL,加入PBS 液19mL 稀释成20mL 的细胞悬液,对其进行计数并取平均值。此后每天消化一组并按同样的方法计数取平均值,至第8 天结束。将所获得的数据绘制生长曲线,并计算群体倍增时间。
1.4 表面标记流式分析 用流式细胞仪对第二代细胞的表面特异性抗原进行检查。0.1%胰蛋白酶消化待检细胞,收集细胞,离心5 min(1500 r/min),弃培养液,PBS 重悬,过单细胞滤网,将其制成单细胞悬液,血细胞计数仪计数,调整细胞浓度为(0.5~1.0)×106个/mL,吸取1 mL细胞悬液加入1.5 m L eppendorf 管中,离心,将沉淀细胞用100μL 1%BSA重悬,加入0.5μL待检抗体,4 ℃孵育30 min,离心,PBS 冲洗。最后细胞用4%多聚甲醛固定,样品用流式细胞仪分析鉴定。分别设实验组、同型对照组、空白对照组。每组标本3例,取平均值。
1.5 体外分化潜能检测 第2 代mASCs,按1 ×104个/孔的密度接种于24 孔板,进行成脂、成骨及成软骨诱导。成脂诱导液配制参考文献[7],m ASCs 经诱导2 周后进行油红染色;成骨诱导液及成软骨诱导液配制参考文献[7],m ASCs 分别诱导4 周后进行茜素红染色以观察钙盐沉积情况;行Ⅱ型胶原免疫组化染色观察Ⅱ型胶原的分泌情况。
1.6 特殊染色及免疫组化染色 油红染色:细胞经4%甲醛4 ℃固定1 h,蒸馏水冲洗,加入60%异丙醇,室温放置1 min,吸尽后加入2%油红试剂(wt/vol),室温放置5~10 min,60%异丙醇洗去多于染液,蒸馏水冲洗后观察。
Alizarn Red染色:细胞经70%冷乙醇4℃固定1 h,蒸馏水冲洗3 遍,茜素红染液室温作用10 min,蒸馏水冲洗多余染液,倒置相差显微镜观察拍照。
Ⅱ型胶原免疫组化染色:细胞经4%多聚甲醛4 ℃固定10~15 min,PBS 冲洗3 min,(0.25% Triton-100,5%DMSOPBS)穿膜处理10 min,PBS 洗3 次,每次5 min,非特异性抗原封闭,加入Ⅱ型胶原抗体4 ℃过夜,抗小鼠二抗37 ℃孵育30 min,PBS 冲洗3min,DAB 显色,封片,镜检拍照。
2 结 果
2.1 倒置相差显微镜下观察细胞的生长及形态学特点 原代分离的小鼠脂肪干细胞呈体积较小的圆球形,1~2 h 开始贴壁生长,6 h 左右细胞伸展开来,呈短梭形,胞体可形成具有较强折光性的细胞外基质,高倍镜下细胞轮廓清晰(图1)。5 d左右达到90%以上汇合状态时传代,传代接种的细胞密度为(0.5~1.0)×104个/cm2,传代后细胞增殖迅速,常于传代后3 d 再次接近汇合状态。传代到第10 代仍有很强的增殖能力。
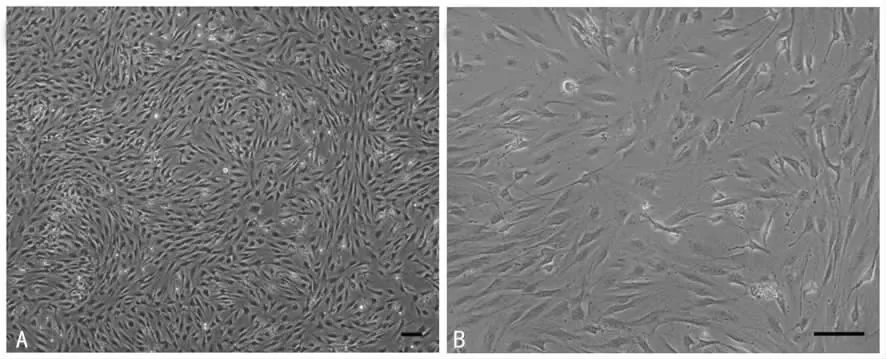
图1 倒置相差显微镜下观察m ASCs 的原代细胞形态
2.2 生长曲线 生长曲线显示培养的第2、8 代细胞均具有很强的分裂增殖能力,均存在24 h 停滞生长期,第3~4 天体外扩增速度相似,为对数增殖期。而在第6 天时第2、8 代细胞生长均处于停止状态。该研究结果表明,m ASCs 第2、8 代细胞传代接种后的潜伏期、对数生长期、平台期无显著差异(图2),群体倍增时间大约为48 h,传10 代后细胞无明显的衰老征象。

图2 生长曲线
2.3 流式细胞仪检测结果 第2代小鼠脂肪干细胞表达CD34(10.97±2.03)%、CD105(11.78±1.56)%、CD133(1.63±0.38)%,高表达Sca-1(80.57±5.71)%,几乎不表达CD45(0.07±0.03)%、SSEA-1(0.02±0.01)%。
2.4 体外分化潜能检测 成脂诱导7 d 左右,镜下观察有脂滴出现,随着诱导时间的延长,脂滴逐渐增多,变大,2 周时停止诱导,油红染色显示脂滴呈桔红色(图3A);对照组无脂滴出现,油红染色呈阴性(图3B)。成骨诱导4 周行茜素红染色,诱导组有钙结节形成,染色呈红色(图3C);对照组染色呈阴性(图3D)。成软骨诱导6 d 左右,诱导组有部分细胞聚集成小球状,非诱导组则无,诱导4 周时Ⅱ型胶原免疫组化染色诱导组表达软骨特异基质Ⅱ型胶原,染色呈棕色(图3E),对照组无阳性染色出现(图3F)。

图3 m ASCs 体外分化潜能检测(×100)
3 讨 论
组织工程技术是目前最有前景的生理性修复技术。然而,种子细胞来源不足、功能老化等问题严重限制了其发展与应用。脂肪干细胞因其体内分布广,取材创伤小,细胞获得量大且扩增能力强等优点,已成为一种有希望的种子细胞。研究表明,脂肪间充质干细胞在体外特定条件下可分化为多种细胞类型及表达间充质干细胞相关抗原[8-11]。小鼠动物模型取材方便,可重复性强,便于有关基础研究的实施等优点目前应用广泛。小鼠脂肪干细胞分离培养方法主要参照人脂肪干细胞,目前通常采用Ⅰ型胶原酶进行消化[12-14]。脂肪组织主要是由大量脂肪细胞集聚而成,疏松结缔组织将成群的脂肪细胞分隔成许多脂肪小叶。疏松结缔组织中含有除Ⅰ型胶原外的多种胶原纤维及蛋白多糖和糖蛋白等,本研究应用胶原酶NB4(包含Ⅰ型胶原酶,Ⅱ型胶原酶和中性蛋白酶)消化小鼠腹股沟皮下脂肪组织,组织消化更完全,细胞获得量更大。小鼠脂肪干细胞培养基通常为DMEM/F12 加胎牛血清(5%或10%)[15-16],本法采用低糖DMEM加10%胎牛血清,贴壁培养,细胞增殖迅速,体外多次传代仍保持较强的增殖能力。原代分离的小鼠脂肪干细胞呈集落状生长,传代后的细胞生长速度较原代细胞明显增快,体外多次传代后仍保持较强的增殖能力。通过测定小鼠脂肪干细胞的生长曲线,证实其体外培养时分裂增殖能力强,潜伏期较短。本研究进一步鉴定该分离培养方法所获得的细胞表面标记及多向分化潜能,以证实其干细胞特性。对小鼠脂肪干细胞进行成脂诱导后,油红染色胞质中脂滴呈桔红色,成骨诱导后有钙结节形成,成软骨诱导后表达软骨特异基质Ⅱ型胶原,表明其具有向脂肪、骨及软骨分化潜能。经流式细胞仪鉴 定,CD34、CD105阳 性,Sca-1高 表 达,不 表 达CD45及SSEA-1,其具有与文献报道相似的表面标记[15]。在人脂肪干细胞中,CD105 与软骨分化潜能具有高度相关性[17],本法获得的小鼠脂肪干细胞第2 代CD105 表达量为(11.78±1.56)%,其与软骨潜能相关性有待进一步证实。结果表明,本研究从小鼠脂肪组织中分离到的间充质干细胞具有多向分化潜能,及与文献报道相一致的表面标记。本分离培养方法操作简单、易于推广、细胞获得量大、质量优良,能很好地满足组织构建对种子细胞量大质优的需求。
[1] Kaplan FS,Hahn GV,Zasloff MA.Heterotopic ossification:two rare forms and what they can teach us[J].J Am Acad Orthop Surg,1994,2(5):288-296.
[2] Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[3] Gronthos S,Franklin DM,Leddy HA,et al.Surface protein characterization of human adipose tissue-derived stromal cells[J].J Cell Physiol,2001,189(1):54-63.
[4] Yoshimura K,Shigeura T,Matsumoto D,et al.Characterization of freshly isolated and cultured cells derived from the fatty and fluid portions of liposuction aspirates[J].J Cell Physiol,2006,208(1):64-76.
[5] Mcintosh K,Zvonic S,Garrett S,et al.The immunogenicity of human adipose-derived cells:temporal changes in vitro[J].Stem Cells,2006,24(5):1246-1253.
[6] Halvorsen YD,Franklin D,Bond AL,et al.Extracellular matrix mineralization and osteoblast gene expression by human adipose tissue-derived stromal cells[J].Tissue Eng,2001,7(6):729-741.
[7] 蒋婷,张莹莹,刘伟,等.MesenPRO RS Medium对人脂肪干细胞增殖与分化的影响[J].组织工程与重建外科杂志,2009,5(5):241-244.
[8] Erickson GR,Gimble JM,Franklin DM,et al.Chondrogenic potential of adipose tissue-derived stromal cells in vitro and in vivo[J].Biochem Biophys Res Commun,2002,290(2):763-769.
[9] Bacou F,el Andalousi RB,Daussin PA,et al.Transplantation of adipose tissue-derived stromal cells increases mass and functional capacity of damaged skeletal muscle[J].Cell Transplant,2004,13(2):103-111.
[10] 李战梅,刘康,冯刚,等.生长分化因子5 促进脂肪干细胞成软骨分化的实验研究[J].西部医学,2010,22(8):1380-1384.
[11] Mitchell JB,Mcintosh K,Zvonic S,et al.Immunophenotype of human adipose-derived cells:temporal changes in stromal-associated and stem cell-associated markers[J].Stem Cells,2006,24(2):376-385.
[12] 张自强,金岩,李裕强,等.犬脂肪间充质干细胞体外分离培养及其多向分化潜能[J].中国组织工程研究与临床康复,2007,11(42):8524-8527.
[13] 郝丹,段显琳,毕晓娟,等.小鼠脂肪源干细胞分离培养和成骨诱导前后造血调控因子的表达[J].中国组织工程研究与临床康复,2012,16(1):51-55.
[14] Yu G,Wu X,Kilroy G,et al.Isolation of murine adiposederived stem cells[J].Methods Mol Biol,2011(702):29-36.
[15] Yamamoto N,Akamatsu H,Hasegawa S,et al.Isolation of multipotent stem cells from mouse adipose tissue[J].J Dermatol Sci,2007,48(1):43-52.
[16] 刘寿生,雷俊霞,黎阳,等.小鼠脂肪间充质干细胞的分离培养及生物学特性分析[J].中山大学学报:医学科学版,2012,33(3):299-304.
[17] Jiang T,Liu W,Lv X,et al.Potent in vitro chondrogenesis of CD105 enriched human adipose-derived stem cells[J].Biomaterials,2010,31(13):3564-3571.
