心房除颤电场分布仿真的电极位置与尺寸优化
2014-03-04杨圣均邬小玫王群山魏大名
王 璁,杨圣均,郑 懿,邬小玫,王群山,魏大名
1 专用集成电路与系统国家重点实验室(复旦大学),上海市,200433
2 上海交通大学医学院附属新华医院,上海市,200092
3 杭州电子科技大学计算机科学与技术学院,杭州市,310018
心房除颤电场分布仿真的电极位置与尺寸优化
【作 者】王 璁1,杨圣均1,郑 懿1,邬小玫1,王群山2,魏大名3
1 专用集成电路与系统国家重点实验室(复旦大学),上海市,200433
2 上海交通大学医学院附属新华医院,上海市,200092
3 杭州电子科技大学计算机科学与技术学院,杭州市,310018
该文提出了一种基于心脏建模及有限元求解的心房除颤电场分布仿真方法,用于分析动物实验和临床验证均无法精确测量的心脏除颤电场分布,为电除颤方法研究提供工具。该研究使用包含完整的心房解剖结构的心脏模型,采用有限元方法进行求解;并设计了由除颤电压阈值、高场强率、除颤能量阈值三个参数组成的评价指标体系评价除颤效果。对经静脉房颤除颤时不同电极位置与尺寸的心脏电场分布进行了仿真研究,结果与文献报道有相当好的吻合度,初步验证了该方法的可行性。
心房颤动;心内膜低能量除颤;有限元;电场分布仿真
0 引言
心房颤动(Atrial Fibrillation)简称房颤(AF),是最常见的心律失常。房颤时心房激动的频率可达(300~600) ppm,心房失去有效的收缩功能。房颤虽不像室颤会立即致人死亡,但是慢性房颤除了会引起心脏自身功能障碍外,还易形成血栓,是引起脑栓塞的重要原因之一。在心律失常住院治疗的病人中,30%~40%是房颤患者[1]。因此,房颤的电生理机制和治疗方法成为国内外心脏电生理领域的研究热点及前沿课题。
电击除颤是将高电压大电流的电脉冲作用于心肌细胞,使细胞膜的透壁电流达到一定阈值,迫使所有(或绝大部分)心肌细胞同时进入不应期,终止混乱的心脏电活动;之后,自律性最高的窦房结将重新起搏心脏,恢复窦性心律。近年来,因为微创心脏电生理诊断治疗方法的日益普及,医生更多地关注经静脉低能量体内除颤。国内外学者对体内心房除颤(Internal Atrial Def i brillation, IAD) 进行了较为系统的研究,因为体内心房除颤所需能量可比体外心房除颤所需能量大幅降低[2],因此病人甚至不需要全身麻醉就可以完成手术。并且临床研究证实,即使对经体外电除颤失败的患者,低能量经静脉电转复的成功率仍可达88%,可使电击除颤更安全有效地运用于临床治疗[3]。鉴于此,如何在保证除颤成功率的前提下,进一步降低除颤能量,成为经静脉心房除颤方法研究中的关键问题。
随着计算机建模和仿真技术的不断进步,通过建立数学模型来描述电学诊断治疗过程中心脏的电场分布情况,再采用数值计算(如有限元,Finite Element Method,FEM)方法进行求解,得到节点分布信息和单元信息[4-5]的研究手段,使得原来无法或者很难用实验记录手段进行的研究成为可能。
Fahy JB等[6]在1987年使用了一个二维(2D)的人体胸腔模型来研究体表接触式电极放电时人体的电流分布; Ramirez IF等[7]在1989年也构造了一个2D的人体胸腔模型研究在不同患者或者不同治疗手段等独立因素的影响下,心肌细胞的电流密度分布;上述研究均得到了如下结论:在经胸体外除颤时,电极的放置位置是心肌细胞上电流密度分布的主要决定因素。1988年Claydon FJ等[8]构建了一个犬类的三维(3D)胸腔模型来研究经胸体外除颤时心肌细胞上的电势分布,这个3D模型包括的导电组织有心脏、肺、骨骼肌以及胸腔;1993年Karlon WJ等[9]也构建了一个犬类的3D胸腔模型来研究经胸体外除颤时心肌细胞上的电流密度分布,这个模型包括8种不同的导体组织,此研究的结果显示除颤时电极的放置位置与心肌细胞的损伤有相关性,提出了能量阈值的概念;此外,研究还发现用12 cm电极的除颤效果优于8 cm电极的除颤效果。
相比动物实验,计算机建模和仿真研究成本低、速度快,不存在数据采集和个体差异的问题,且可以与动物实验相互验证,减少了实验的盲目性。目前计算机建模研究中关于体外的经胸除颤构建的整体的胸腔模型很多,这类研究的大多仿真体外经胸除颤时整个胸腔的电场分布,而仅建立完整心脏模型建模用于房颤除颤仿真的研究相对较少。针对目前经静脉心房除颤方法研究存在的问题,本文提出了一种通过心脏建模仿真经静脉腔内心房除颤的电场分布以及评估电场分布情况的方法。仿真结果与文献报道的临床数据的对比初步验证了本方法的可行性。
1 方法
1.1 生物体电场分布的数学模型
由生理学知识可知,由于人体中的体液和生物组织具有导电性,可以将人体躯干视为一个容积电导体。因此,作用于身体的电刺激将通过作用区域的导电组织传导在身体中形成电场,电场分布在宏观水平满足Maxwell 方程组。将方程组简化为拉普拉斯方程与Neumann 和 Dirichlet 边界条件联立,求解可以得到容积导体内任意点的电势大小,对其求梯度之后得到任意点除颤电场强度分布。
具体的求解方法是利用网格离散化将心脏这个三维场域转化为一族离散的子区域(互不重叠的四面体),这些子区域称为元。对每一单元构造分域基函数,再利用里兹(Ritz)法等构造代数形式的有限元方程。将带边界条件的拉普拉斯偏微分方程描述的电场问题转化成解有限元方程组的问题,从而得到求解结果[10]。
1.2 心房解剖结构的有限元模型
计算机构建的Wei-Harumi心脏模型是通过对断面图像离散化并进行空间差补重建的三维心脏模型。该模型设定空间等距的众多闭合的立方体作为模型的离散单元,模型单元可以理解为实际的心肌细胞的集总。模型单元的构建方向是从心内膜向心外膜层叠,模型中构成房间隔、室间隔的单元是心房纤维单元或心室纤维单元的自然延伸并且设定同层的心脏纤维单元方向是相互平行的[11]。
本研究的心脏模型使用了Wei-Harumi模型[12]的心脏形态,并将整个心房划分为三个部分:心房肌、左上心腔和右上心腔,如图1所示。
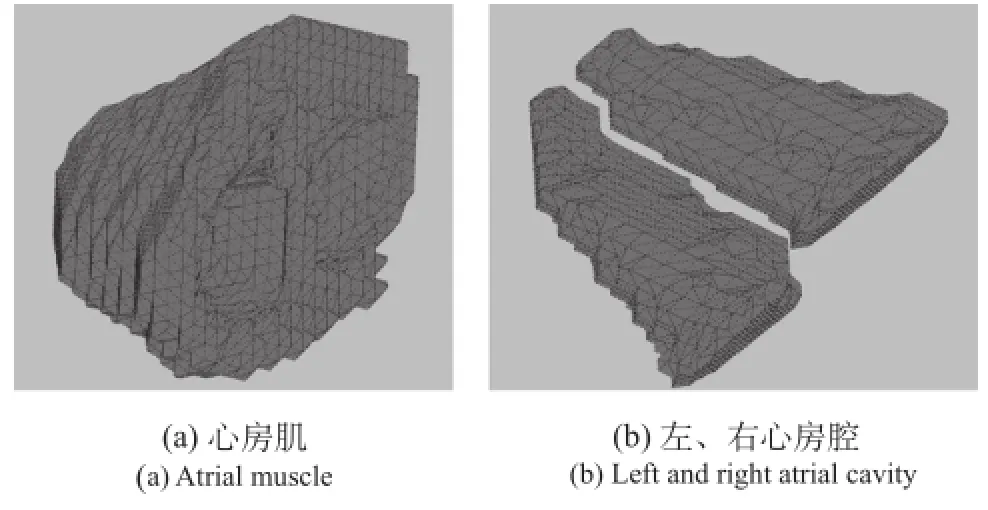
图1 Wei-Harumi模型的心房形态Fig.1 Wei-Harumi model of atrial morphology
本文使用ANSYS对所建心脏模型进行有限元求解。但由于ANSYS的建模能力仅限于规则图形,对于心脏这种有复杂边界的形状无能为力。故本研究通过以下几个步骤完成心脏的建模过程:
(1) 使用Matlab将心脏分成图1所述的3个部分,在提取每一部分的三维边界之后,将其转化成ANSYS能识别的3D object文件;
(2) 将上述3D object文件导入ANSYS软件后,进行边界网格划分,完成心房与心腔的分割。之后对分割完毕的三维对象进行四面体划分,如图2所示。
1.3 心房除颤电场分布的仿真
在电场分布仿真之前,首先指定材料属性为电导型;其次需要指定各个区域的电阻率,它是生物电场数值仿真的重要参数之一,用于数值模型的材料加载。人体各组织的电阻率文献[13]表明,心肌与心腔中的血液的电阻率分别为4.202Ω. m与1.47Ω. m 。
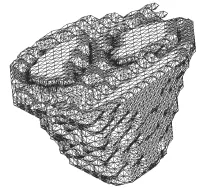
图2 四面体划分后的心房模型Fig.2 Tetrahedral atrial model after division
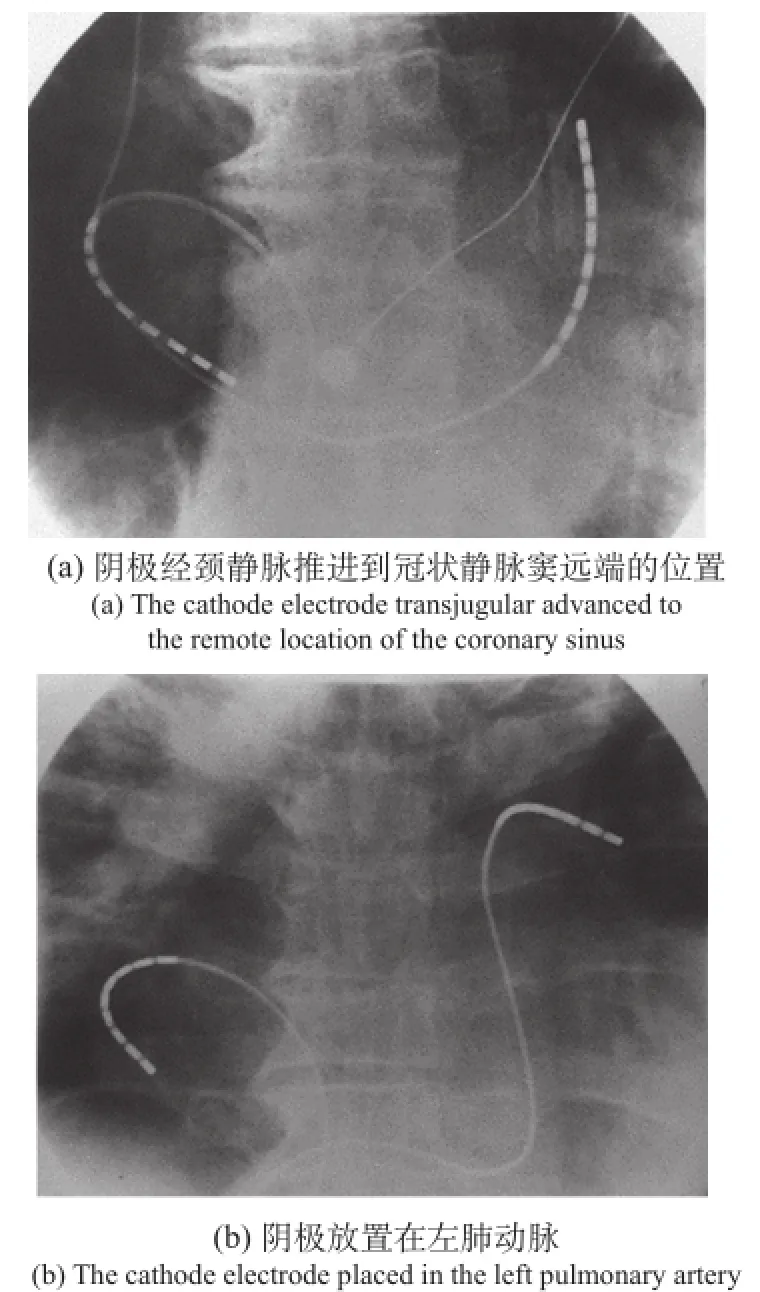
图3 造影图像[8]Fig.3 Angiographic images
之后对目标位置(即除颤电极所在位置)施加载荷,求解后便可以对感兴趣的项目进行结果后处理。
1.3.1 除颤电极的位置设置
为了实现经静脉心房除颤,需要经静脉向病人心房置入除颤导管电极。目前临床通常采用的电极置入位置是,一个电极放置在冠状静脉窦(Coronary Sinus)或肺动脉(Pulmonary Artery),另一电极放置在右心室自由壁(Right Atrium Anteriolateral,下文简称为阴极、阳极,如图3所示。该造影图像的阳极均是通过右股静脉进入右心腔,放置于右心房自由壁,且均为后位获得的。
在上述两种体内心房除颤电极置入位置进行除颤,均能够以较低能量有效地终止房颤[14]。但如何提高无痛除颤的可能性(通常指病人能够无需麻醉、清醒地接受心房除颤的手术)仍是低能量电击除颤研究的长期目标。文献[15]即提出了一种新的电极放置位置:将阴极安置在左心房自由壁(Left Atrium Anterolateral),阳极仍安置于右心房自由壁。
为了验证本文提出的心房除颤电场分布仿真方法的可行性,本文对上述三个除颤电极安放位置的除颤效果进行了仿真研究,并与文献报道的临床测试数据进行了对比。
本文将三种电极位置分别命名为:右心房自由壁-冠状静脉窦(Right atrium anteriolateral and Coronary Sinus position, RCS)、右心房自由壁-肺动脉(Right atrium anteriolateral and Pulmonary Artery position, RPA)。右心房自由壁-左心房自由壁(Right Atrium anteriolateral and Left Atrium anteriolateral, RLA)。
电极放置位置如图4所示,三种位置的电极的尺寸均为3 mm×40 mm(±2 mm)。
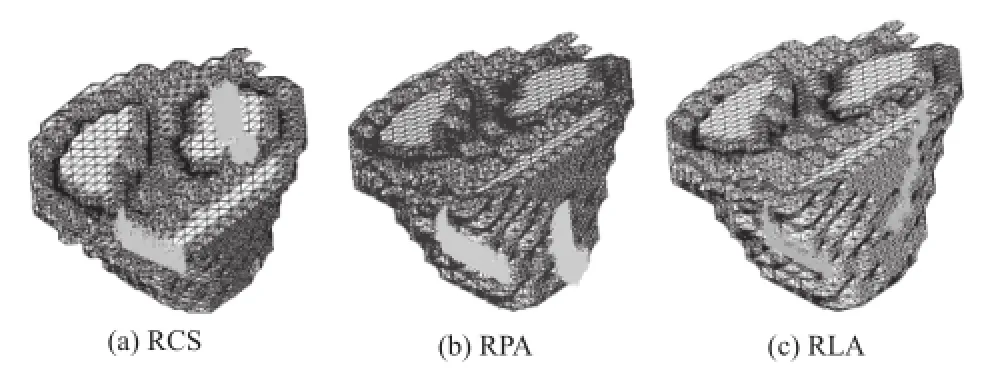
图4 除颤电极(稠密浅灰色标记)位置Fig.4 Def i brillation electrodes (green marker) position
1.3.2 除颤电极的尺寸设置
有研究表明[16],在经静脉心房除颤时选用面积较大(直径为3 mm,长度为80 mm)的除颤电极(意味着电极与心肌接触面积较大)能够得到较低的除颤阻抗和除颤电压阈值;与此相反,选用面积较小(直径为3 mm,长度为30 mm)的除颤电极可能会提高除颤电压阈值。本研究的第二部分即为在RLA位置下,改变右心房电极尺寸,比较不同尺寸阳极(anode)对于除颤效果的影响。本文分别对3 mm×26 mm±2 mm、3 mm×40 mm±2 mm、3 mm×56 mm±2 mm 几种规格电极的除颤效果进行了仿真研究。
1.3.3 除颤电场分布的评价参数
本文根据心脏电生理的基本原理并结合相关文献报道,综合考虑除颤效果和高能量电击对心肌的损伤作用,设计了一组参数对仿真结果进行量化评估。
根据心脏颤动中的“临界量心肌组织”概念以及文献[17]中报道的可有效除颤的电场强度阈值标准,本文将0.35 V/mm的电场强度作为除颤电场阈值EFth,同时设95%心房肌电场强度达到该阈值作为除颤成功率的标准。均匀的电场分布可以大幅度降低除颤电压阈值,达到降低除颤能量的目的。对于本研究建立的模型,我们可以假设心房肌的所有单元均为容积导体,电场强度与施加的电压呈线性关系,在模型上施加一定强度的标准电压VS(100 V),与计算得到的心房肌电场强度EF比等于除颤电压阈值Vth与EFth除颤电场阈值之比。
除颤电压阈值Vth求解方法如式(1)所示:
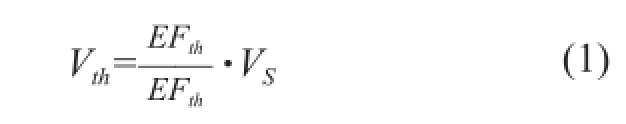
高场强率HR定义为当使用除颤阈值电压Vth激励心脏时,心房肌区域中电场强度达到或者超过10倍除颤电场强度阈值EFth的心肌区域Aover与全部心房肌区域的比值Atotal。高场强率HR如式(2)所示:

由于目前通常用除颤能量作为衡量除颤效率的指标,为了与临床测试数据进行对比,本文还计算了仿真结果的除颤能量阈值Eth。在计算能量时先作如下假定:除颤能量由放电电容C(130 μF)[18]提供,除颤能量阈值E与除颤电压阈值Vth关系如式(3)所示:

2 仿真结果
对于不同的电极放置位置,本研究在施加载荷时统一采用在阳极上施加100 V的电压载荷,在阴极上施加0 V的电压载荷的方式,来计算得到该心房模型的电势分布。之后再通过式(1)~(3)计算得到除颤电场分布的评价参数。

图5 不同电极安置位置除颤心房电势分布Fig.5 The atrial electrical potential distribution

图6 不同尺寸电极除颤时心房电势分布Fig.6 The atrial electrical potential distribution
2.1 直观电势分布
由图5可以看到不同位置的电势分布情况,模型下方的色条代表电势的大小。粗略看来,无论是RCS、RPA还是RLA位置,其电势总是由右心室前侧壁向另一电极方向衰减,由此可以得到放电的大致路径。右心室前侧壁部分的电势集中在(60~100) V 的范围,而冠状静脉窦、左肺动脉以及左心房前侧壁部分则集中在0~50 V 范围内。
图5为不同除颤电极位置除颤电场分布仿真结果示意图。比较这三幅图:RCS位置的黑色色条区域的值的区间分布数值最大,并且心脏外膜表面的最大值也是三者中最高的,接着依次是RPA位置和RLA位置。但是这仅是通过对图形的观察得到的定性结果。
图6所示的是在RLA电极位置下,不同右心房电极尺寸时的仿真结果。可以看到,电势也总是由右心室前侧壁向左心房前侧壁处方向衰减,可以看到电流的大致走向。电极面积越大,电势集中在(60~100) V的面积越大。直观上来讲,仿真场强分布符合预期,也符合文献报道的在电极附近的电场强度高出距电极较远区域的若干数量级的结论[19]。
虽然电势分布图很直观,但它仅仅能表明心脏各部位电位大小以及大体变化趋势,无法体现心肌是否能正常除颤。
2.2 除颤效果比较
随着除颤电压的增加,在三种位置下心房肌细胞成功除颤的比例不断增加,用一幅包含三条折线的图7可以说明电压值参数对于除颤效果的影响。
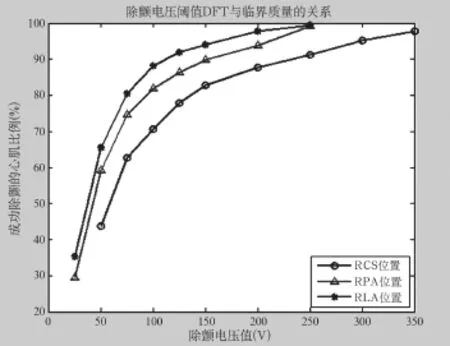
图7 除颤电压阈值DFT与临界质量的关系图Fig.7 The relationship between the def i brillation voltage threshold and critical mass in diagram
为了量化评估不同电极放置位置下除颤电场分布,对RCS、RPA、RLA三种心房除颤位置的除颤参数(见1.3.3对除颤电压阈值Vth、高场强率HR、除颤能量阈值Eth的描述)进行计算,得到表1。
由表1可知,传统的电极放置位置RCS(冠状静脉窦)和RPA(肺动脉)的除颤能量分别为6.61 J和2.76 J,与文献报道的心内低能量房颤复律的临床试验结果(2~6) J[17]的吻合度较高;且RCS位置的除颤能量与文献[20]报道的相关临床实验数据6.32±2.09 J(P <0.05)也相吻合。一定程度上验证了本文提出的方法的有效性。
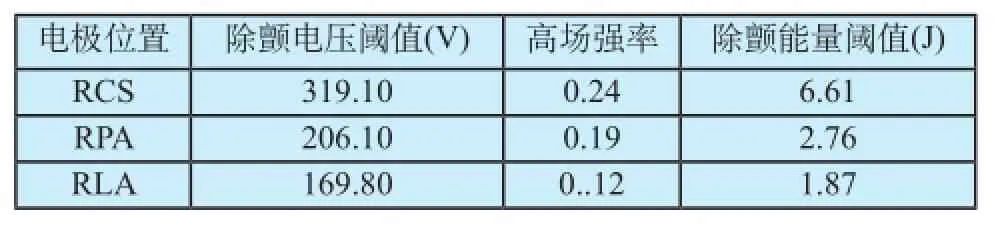
表1 不同电极放置位置的除颤效果比较Tab.1 The rate of bone formation after implanting the materials
从除颤电压阈值的角度看,RLA(左心房自由壁)位置比RCS位置的除颤电压阈值降低了46.8%,比RPA位置的除颤电压阈值降低了17.6%。从除颤能量的角度看,RLA位置的除颤能量仅为1.87 J,比RCS位置的除颤能量降低了71.7%,比RPA位置降低了32.2%。
研究表明,放电能量在1 J 以下时病人可以耐受,大于1 J 的能量则需要镇静。而放电能量 ≤ 2 J 时病人虽无疼痛, 但已感不适[20]。从仿真结果看, 除颤电极的安放位置对除颤能量阈值有较大影响,将除颤电极放置于RPA位置时的除颤能量显著低于传统电极位置(肺动脉与冠状静脉窦),有较高的临床参考价值。同理,为了量化评估不同电极尺寸下除颤电场分布,在RLA位置下,选择三种电极尺寸计算除颤参数,见表2。
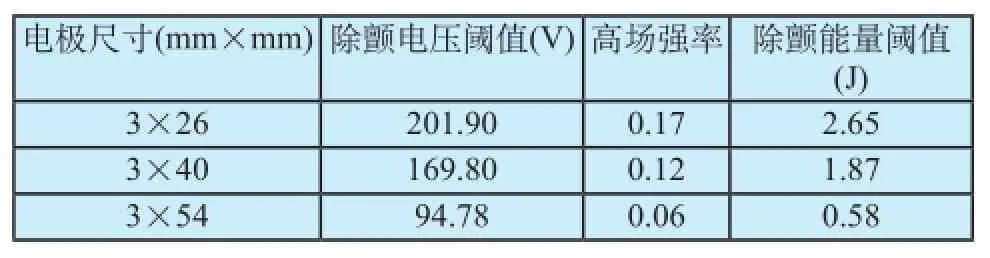
表2 不同电极尺寸的除颤效果比较Tab.2 The rate of bone formation after implanting the materials
从表2可知,当电极与心脏的接触面积不断增大时,相应的除颤电压阈值Vth会不断减小,除颤能量Eth也相应减小,高场强率HR也相应降低,一定程度上反映了心肌损伤的减轻。其指导意义在于,在条件允许的情况下,医生可以选择面积较大的除颤电极,以期通过更小的能量来完成除颤。
3 结论与讨论
针对目前缺少体内心房除颤电场仿真研究方法的问题,本文提出了一种基于心脏建模及有限元求解的心房除颤电场分布研究的方法及电场分布评价参数;在进行实际的临床测试之前,通过与文献报道的临床测试结果的比较,初步验证了本方法的可行性。
仿真结果显示,除颤电极安放位置不同,对除颤效果有显著影响。使用RLA的位置,除颤电压阈值要比RCS、RPA位置分别低46.8%、17.6%,可以有效降低除颤电压阈值。
除颤电极的尺寸也与除颤效果有着显著的联系,在一定范围内,电极尺寸越大,电极与心肌接触面积增大,整个心脏的电场分布更加均匀,需要的除颤阈值减小,心肌损伤率也降低。
虽然体内心房除颤不用考虑个体差异极大的经胸阻抗;但是心腔的大小、疾病的状态(例如心肌梗塞、血气、电解质紊乱、体内某些药物等),也会成为影响除颤电场分布,进而影响除颤效果的原因。而这些因素是计算机模型无法一一模拟的。在实际应用中,可以根据病人的心脏形态、用药情况适当更改模型的相关参数,以期获得更为准确的仿真结果。
[1] Kodoth V, Castro NC, Glover BM, et al. Waveform optimization for internal cardioversion of atrial fibrillation[J]. J Electrocard, 2011, 44(6): 689-693.
[2] Luther S, Fenton FH, Kornreich BG, et al. Low-energy control of electrical turbulence in the heart[J]. Nature, 2011, 7(14): 235-236.
[3] 方祖祥. 心律失常的电治疗进展[J]. 中国医疗器械杂志, 2002, 26(1): 3-6.
[4] 李重视, 闫丹丹, 朱善安, 等. 基于无网格有限元方法的心磁场计算仿真研究[J]. 浙江大学学报(工学版), 2010, 44(3): 463-467.
[5] 肖鹏飞. 基于有限元方法的心脏表面建模[J]. 计算机与现代化, 2011, 186(2): 58-59.
[6] Fahy JB, Kim Y, Ananthaswamy A. Optimal electrode configurations for external cardiac pacing and defibrillation: An inhomogeneous study[J]. IEEE Trans Biomed Eng, 1987, 34(9): 743-748.
[7] Ramirez IF, Eisenberg SR, Lehr JL, el al. Effects of cardiac conf i guration, paddle placement and paddle size on def i brillation current distribution: A finite element model[J]. Med Bid Eng Comput, 1989, 27(1): 587-594.
[8] Claydon FJ, Pilkington TC, Tang AS, el al. A volume conductor model of the thorax for the study of def i brillation fi elds[J]. IEEE Trans Biomed Eng, 1988, 11(35): 981-992.
[9] Karlon WJ, Eisenberg SR, Lehr JL. Effects of paddle placement and size on def i brillation current distribution: A three dimensional finite element model[J]. IEEE Trans Biomed Eng, 1993, 3(40): 246-255.
[10] 杨圣均, 郑懿, 邬小枚, 等. 基于有限元方法的心脏除颤仿真研究[J]. 中国生物医学工程学报, 2011, 30(6): 50-54.
[11] 魏大名. 心电现象的计算机模型与仿真[J]. 上海生物医学工程, 1996, 16(4): 19-24.
[12] Wei D, Okazaki O, Harumi K, el al. Comparative simulation of excitation and body surface electrocardiogram with isotropic and anisotropic, computer heart models[J]. IEEE Trans Biomed Eng, 1995, 42(4): 343-357.
[13] 方祖祥, 赖大坤, 邬小玫. 基于数值仿真方法的体外除颤电极配置分析与优化[J]. 中国生物医学工程学报, 2008, 13(1): 1-12.
[14] Li W, Janardhan A, Fedorov V, el al. Low-energy multistage atrial def i brillation therapy terminates atrial fi brillation with less energy than a single shock[J]. Circ Arrhythm Electrophysiol, 2011, 4(6): 917-927.
[15] Yang F, Sha Q, Patterson RP. A novel electrode placement strategy for low-energy internal cardioversion of atrial fibrillation: A simulation study[J]. Int J Cardiol, 2012, 158(1): 149-152.
[16] Timmermans C,Rodriguez LM, Ayers GM, et al. Effect of electrode length on atrial def i brillation thresholds[J]. J Cardiovasc Electrophysiol, 1998, 9(6): 582-587.
[17] Charbonnier FM. External defibrillators and emergency external pacemakers[J]. Proc IEEE, 1996, 84(3): 487-499.
[18] Jolley M, Stinstra J. Finite element modeling of subcutaneous implantable defibrillator electrodes in an adult torso[J]. Heart Rhythm, 2010, 5(7): 692-698.
[19] Wharton JM, Wolf PD, Smith WM, el al. Cardiac potential and potential gradient fields generated by single, combined, and sequential shocks during ventricular def i brillation[J]. Circulation, 1992, 85: 1512-1523.
[20] Saksena S, Mongeo NL , Kro IR, et al. Clinical eff i cacy and safety of atrial defibrillation using current nonthoracotomy endocardial lead configuration: a prospective randomized study[J]. Am J Cardiol, 1995, 11(76): 913-921.
Optimization of Electrode Location and Size on Simulation in Electric Field Distribution of Atrial Def i brillation
【 Writers 】Wang Cong1, Yang Shengjun1, Zheng Yi1, Wu Xiaomei1, Wang Qunshan2, Wei Daming3
1 State Key Laboratory of ASIC & System, Fudan University, Shanghai, 200433
2 Xinhua Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai, 200092
3 School of Computer Science and Technology, Hangzhou Dianzi University, Hangzhou, 310018
atrial fi brillation, low-energy endocardia de fi brillation, fi nite element, electric fi eld distribution simulation
R541.7
A
10.3969/j.issn.1671-7104.2014.02.003
1671-7104(2014)02-0088-06
2013-11-19
上海市科委重点课题攻关项目(11441901702)
邬小玫,E-mail: xiaomeiwu@fudan.edu.cn
【 Abstract 】A distributed simulation method of electric field based on the atrial defibrillation of the heart modeling and finite element solution is proposed in this study. In order to solve the problem that ordinary clinical trials could not measure the actual distribution of the de fi brillation electric fi eld in the heart accurately, this method provides a research tool for electrical de fi brillation. A complete atrial anatomical structure in the heart model is used in the research, the fi nite element method is proceeded to solve; Three parameters: de fi brillation threshold voltage, the high fi eld strength rate and the de fi brillation threshold energy are set to evaluate the effect of de fi brillation. The heart electric fi eld distributions of transvenous atrial de fi brillation with different electrode locations or sizes are simulated. The simulation results and the reported results match fairly well, which initially verify the feasibility of this method.
