急性冠状动脉综合征患者白细胞介素-37水平变化的研究*
2014-03-04陈少源贺五一金健方红城谢培益苏又苏
陈少源, 贺五一, 金健 ,方红城, 谢培益 ,苏又苏
急性冠状动脉综合征患者白细胞介素-37水平变化的研究*
陈少源, 贺五一, 金健 ,方红城, 谢培益 ,苏又苏
目的:检测白细胞介素(IL)-37在急性冠状动脉(冠脉)综合征(ACS)患者血清水平的变化,探讨IL-37与冠脉粥样硬化斑块的关系。
急性冠状动脉综合征;白细胞介素-37;炎症反应
(Chinese Circulation Journal, 2014,29:871.)
动脉粥样硬化(AS)是临床上常见的血管疾病之一。近年研究认为其发病机制是一种炎症和自身免疫性疾病。AS发病的中心环节是多种炎症因子的释放导致炎症级联效应[1-3]。AS斑块的不稳定是急性冠状动脉(冠脉)综合征(ACS)发病的始动因素。而ACS为患者急诊入院及死亡的常见原因。目前研究多在集中于基质金属蛋白酶、白细胞介素(IL)-18、IL-6、IL-1α、IL-1β、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)等促炎因子;对于保护性的细胞因子研究较少[4,5]。IL-37是新近发现的具有抗炎作用的白介素家族成员,具有抑制固有免疫应答和抗炎的作用,在动脉粥样硬化的发生、发展中具有特殊的作用[6,7]。但目前其在心血管动脉粥样硬化的临床研究较少,其生理功能尚待进一步深入研究。本文通过对血清IL-37水平在ACS患者中的变化对其进行初步探讨。
1 材料和方法
研究对象:入选2012-10至2014-01在深圳南山人民医院心内科住院符合入选标准且行冠状动脉造影的患者共105例。根据临床症状、心电图和酶学分为ACS(包括急性心肌梗死和不稳定性心绞痛)组,共60例,男42例、女18例,年龄(57.62±9.71)岁;稳定性心绞痛 (SAP) 组,共30例,男19例、女11例,年龄(58.50±8.65)岁。所有冠脉粥样硬化性心脏病患者同期行冠脉介入治疗(无需介入治疗或需外科干预者不纳入观察病例)。另选同期因胸痛或瓣膜病入院,冠脉造影正常,性别、年龄相匹配的15例患者作为对照(CG)组,男10例、女5例,年龄(56.14±10.35)岁。冠心病患者予阿托伐他汀钙20 mg/晚治疗;同时根据病情予阿司匹林、氯吡格雷、低分子肝素、硝酸酯、β受体阻断剂、血管紧张素转化酶抑制剂、血管紧张素受体II拮抗剂等基础药物;伴发糖尿病、高血压的患者均予以相应药物治疗。
排除标准:所有入选者严格除外急性感染、4周内创伤或手术史、恶性肿瘤、全身免疫性疾病、严重肝、肾功能不全以及应用炎症抑制药物如消炎镇痛药、类固醇及免疫抑制剂。
冠脉造影:所有入选患者签署知情同意书后行冠脉造影,常规多体位投照;由2名心内科医师阅读。冠脉造影确认罪犯血管后行介入治疗,术中只干预罪犯血管。
样本的收集及处理:所有实验者随访4周。入院即刻(使用药物前)、1周、4周时于左肘静脉采血10 ml;血标本放置在依地酸(EDTA)-2Na抗凝管;即刻以3000 r/ min的速度离心20 min,取上清液2 ml于离心管中,置于-70℃冰箱中保存待测。IL-37、IL-18:采用酶联免疫吸附法(ELISA)测定,试剂盒(Human IL-37及IL-18 ELISA Kit)由美国R&D System公司提供。IL-37、IL-18的浓度单位为μg/L。严格按照其使用说明书方法测定收集标本。
血清生化检测:所有患者入院时即刻采左肘静脉血,采用散射比浊法测定C反应蛋白(CRP);所有实验对象空腹12 h后采静脉血,常规检测血糖与低密度脂蛋白胆固醇(LDL-C)。
2 结果
三组患者的基本资料、生化指标比较: ACS组、SAP组低密度脂蛋白胆固醇较对照组高(P<0.05),ACS组CRP较对照组、SAP组高(P<0.01),差异均有统计学意义。 表1
表1 三组患者临床特征比较

表1 三组患者临床特征比较
注:与对照组比*P<0.05;与稳定性心绞痛组比△△P<0.01。LDL-C:低密度脂蛋白胆固醇
急性冠脉综合征组(n=60)男/女(例/例) 10/5 19/11 42/18年龄(岁) 56.14±10.35 58.50±8.65 57.62±9.71糖尿病(例) 5 14 34高血压(例) 6 17 36 LDL-C(mmol/L) 3.19±0.50 3.50±0.35* 3.61±0.49*吸烟(例) 5 12 18 C反应蛋白( mg/L) 5.82±1.17 6.54±1.26 14.25±2.25*△△对照组(n=15)稳定性心绞痛组(n=30)
IL-37、IL-18血清浓度变化情况比较:IL-37、入院即刻、入院1周、4周时SAP组、ACS组均低于对照组,差异有统计学意义(P<0.05)。只有入院即刻ACS组低于SAP组,差异有统计学意义(P<0.01)。IL-18 入院即刻、入院1周、4周时SAP组、ACS组均高于对照组(P<0.05),差异有统计学意义,只有入院即刻ACS组高于SAP组(P<0.05),差异有统计学意义。IL-18/ IL-37只有入院即刻SAP组、ACS组均高于对照组(P<0.05),ACS组高于SAP组(P<0.01)。差异均有统计学意义。表2
表2 三组患者血清IL-37和IL-18水平比较(μ g/L,
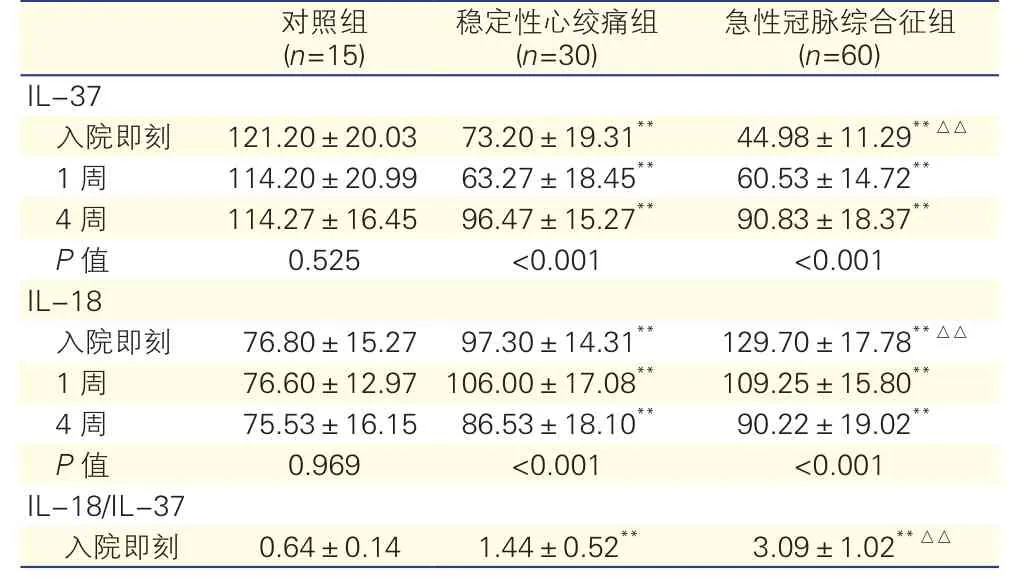
表2 三组患者血清IL-37和IL-18水平比较(μ g/L,
注:与对照组比**P<0.05;与稳定性心绞痛组比△△P<0.01。IL-37:白细胞介素-37 IL-18:白细胞介素-18
急性冠脉综合征组(n=60) IL-37入院即刻 121.20±20.03 73.20±19.31** 44.98±11.29**△△1周 114.20±20.99 63.27±18.45** 60.53±14.72**4周 114.27±16.45 96.47±15.27** 90.83±18.37**P值 0.525 <0.001 <0.001 IL-18入院即刻 76.80±15.27 97.30±14.31** 129.70±17.78**△△1周 76.60±12.97 106.00±17.08** 109.25±15.80**4周 75.53±16.15 86.53±18.10** 90.22±19.02**P值 0.969 <0.001 <0.001 IL-18/IL-37入院即刻 0.64±0.14 1.44±0.52** 3.09±1.02**△△对照组(n=15)稳定性心绞痛组(n=30)
急性冠脉综合征组血清IL-37水平与IL-18呈负相关,r为-0.79(P<0.05)。
IL-37与全球急性冠状动脉事件注册(GRACE)评分相关性:按GRACE评分将ACS组分成低危、中危、高危:评分<96分为低危患者,96~133为中危患者,>133分为高危患者。IL-37与GRACE评 分 呈 负 相 关,r=-0.71,P<0.05。IL-18与GRACE评分呈正相关,r=-0.68,P<0.05。IL-18/IL-37值与GRACE评分呈正相关,r=0.73,P<0.05。
按ROC曲线(灵敏度+1-特异度)取最大值为诊断界点,IL-37>77 μg/L时其灵敏度为0.983,特异度0.946可诊断ACS;大于此数值可排除ACS。
3 讨论
免疫介导炎症反应是动脉粥样硬化的重要发病机制。冠脉粥样硬化性心脏病为动脉粥样硬化在冠状动脉中的一种分布类型。冠心病的发生和发展过程与冠脉炎症反应及其内皮功能失调密切相关。研究证实ACS中大量免疫炎性细胞高度激活;而新近国外研究发现IL-37具有抑制固有免疫应答的作用。
白细胞介素首先发现在白细胞中表达,负责转递细胞间的信号,并参与机体的免疫应答反应。IL-1家族共享一个类似的β桶状结构,其中IL-1α、IL-6、IL-18均是主要的炎症反应的启动因子[8]。2000年Kumar等[7]发现了具有IL-1家族同源DNA的IL-37。研究发现IL-37参与了免疫调节的重要过程。Marcel发现IL-37b的出现会显著降低脂多糖(LPS)诱导的树突状细胞(DC)活性, LPS激活炎症反应能力随之减弱,提示IL-37可抑制免疫反应[9]。McNamee等[10]的研究提示相对于野生小鼠,IL-37的转基因小鼠(IL-37tg)在实验条件下结肠炎的组织学指标降低到三分之一以下,IL-1β和TNF-α的释放各减少5倍和13倍。IL-37还与Smad3、Tregs等可能存在某些相关机制,共同调节炎症及免疫反应[11-13]。
研究发现系统性红斑狼疮患者血清和类风湿性关节炎患者滑膜细胞中IL-37表达均与正常者有明显差别[14-15]。Toll-受体(TLRs)是免疫细胞表面识别病原分子模式的一个模式识别受体家族,其家族中的TLR4是诱导分泌多种炎症因子的模式识别受体;有证据表明,TLR4不仅产生多种诱导炎症因子诱导血管炎症的产生,而且促进了AS板块的形成及发展、破裂、表达及转导树突细胞的激活信号,从而激活幼稚T细胞,启动炎症级联效应[16]。IL-37可抑制TLR诱导的前炎症因子,形成反馈调节[17]。IL-37与丝裂酶原激活物(MAPK)相作用,抑制P38及cJun蛋白MAPK途径的磷酸化,减少干扰素等炎症物质的表达[6]。
本研究发现静脉血清中IL-37在急性冠脉综合征组明显低于稳定性心绞痛及对照组,而稳定性心绞痛低于对照组;提示IL-37可能通过免疫机制参与斑块的发生和发展。血清IL-37在ACS中明显下降,考虑可能由于血清IL-37的下降、其保护作用减弱导致ACS的发生;不排除由于不稳定斑块局部的炎症反应导致IL-37的趋化效应(血清中的IL-37聚集到局部斑块周围);尚待进一步研究明确。GRACE评分旨在对ACS患者急性危险度进行分层,决定治疗策略;GRACE评分是ACS患者一年心血管事件的重要预测因子。Grace危险评分系统计算公式中的入院时心率及收缩压、心电图ST段压低、开始的血肌酐浓度、心肌酶等危险因素均一定程度上反应了冠心病的发生发展过程中的炎症反应。本研究在ACS患者中进行亚组分析,发现IL-37水平越低,CRACE评分越高,呈负相关;而根据ROC曲线,血清IL-37>77 μg/L基本可排除ACS;进一步提示了IL-37在一定程度上可作为冠心病患者早期评估病情的参考指标,指导临床的干预策略。我们还发现ACS患者急性期随着病情好转,血清IL-37在1周、4周呈逐步升高趋势,治疗后ACS与SAP组无明显差别,但仍低于CG,提示IL-37有望作为临床ACS病情监测及疗效评估的指标。
IL-18是前炎症因子,在炎症反应发挥多效能作用。在动脉粥样硬化病变的血管IL-18的大量产生和分泌促进了血管炎症病变的发生、进展,可导致斑块的易损性增加,IL-18是独立于左心室射血分数的冠心病患者预后评估的危险因素[18,19]。IL-37并不是IL-18的直接拮抗剂,它通过与IL-18的天然抑制剂IL-18 bP形成复合物阻止IL-18的β链的活化,而达到抑制IL-18的激活[20]。本研究发现IL-18水平在ACS组患者的血清中比SAP、CG组升高,与目前研究总体一致。IL-37与IL-18呈负相关,IL-37升高时炎症因子下降,提示了IL-37的保护作用;稳定性心绞痛在介入干预后一过性IL-37下降、IL-18上升,考虑与介入干预过程中稳定斑块损伤激发炎症反应,可能与IL-18激活后IL-37消耗有关;而ACS本身存在严重的炎症反应,故介入干预对其无明显影响;同时支持IL-18与IL-37此消彼长的互动关系;也反映了ACS患者中存在抗炎与促炎因子的失衡。我们还通过IL-18/IL-37比值发现:入院时ACS组>SAP组>CG组;比值越高反映疾病的炎症程度越严重。而IL-18/IL-37值与Grace评分正相关,其比值越高Grace评分越高,一年心血管事件也越高;提示可把IL-18/IL-37比值作为CHD的病情评估及危险分层的指标。
但由于本试验样本量较少,试验人群范围非随机对照,结果尚待进一步研究支持。冠脉局部斑块中IL-37的表达与血清IL-37关系如何,IL-37通过什么机制影响了斑块的稳定性、如何从该途径进行药物干预也有待研究。
[1] 王晓琦, 杜乃立. ACS相关炎症因子研究进展. 新医学, 2013, 44: 515-518.
[2] 袁平年, 王焱. 冠状动脉易损斑块相关炎性因子的研究进展. 实用心脑肺血管病杂志, 2012, 20: 363-366.
[3] 赵青, 张抒扬. 冠心病相关的趋化素研究进展. 中国循环杂志, 2013, 28: 70-72
[4] 董梅, 任法新, 牟楠, 等. 急性心肌梗死患者经皮冠状动脉介入治疗术后慢血流发生与梗死相关动脉病变局部白细胞介素-6水平的关系. 中国循环杂志, 2014, 30: 185-188 。
[5] 陈少源, 苏又苏. 急性冠状动脉综合征患者基质金属蛋白酶-9来源的研究. 临床心血管病杂志, 2011, 27: 439-441.
[6] Boraschi D, Lucchesi D, Hainzl S, et al. IL-37: a new antiinflammatory cytokine of the IL-1 family. European Cytokine Network, 2011, 22: 127-147.
[7] Kumar S, McDommell PC, Lehr R, et al. Identification and initial characterization of four novel members of the interleukin-1 family. Biol Chem, 2000, 275: 10308-10314.
[8] Bulau AM, Fink M, Maucksch C, et al. In Vivo Expression of Interleukin-37 reduces local and systemic inflammation in concanavalin A-induced hepatitis. Scientific, World Journal, 2011, 11: 2480-2490.
[9] Nold MF, Nold-Petry CA, Zepp JA, et al. IL-37 is a fundamental inhibitor of innate innunity. Nat Immunol, 2010, 11: 1014-1022.
[10] McNamee EN, Masterson JC, Jedlicka P, et al. Interleukin 37 expression protects mice from colitis. Proc Nade Acad sci USA, 2011, 108: 16711-16716.
[11] Trotta R, Col JD, Caligiuri MA. TGF-beta utilizes SMAD3 to inhibit CD 16-mediated IFN-gamma production and antibody-dependent cellular cytotoxicity in human NK cells. Immunol, 2008, 181: 3784-3792.
[12] Laouar Y, Town T, Jeng D. TGF-beta signaling in dendritic cells is a prerequisite for the control of autoimmune encephalomyelitis. Proc Natl Acad Sci USA, 2008, 105: 10865-10870.
[13] Stephens GL, Shevach EM. Foxp3+ regulatory T cells: selfishness under scrutiny . Immunity, 2007, 27: 417-419.
[14] Boraschi D, Lucchesi D, Hainzl S, et al. IL-37: a new antiinflammatory cytokine of th IL-1 family.European Cytokine Network. 2011; 22: 127-147.
[15] 宋立军. 免疫负调控基因IL一37和TIPE2在SLE患者的表达及其意义. 济南: 山东大学出版社, 2012.
[16] 黄于朗,陈少源,苏又苏.白细胞介素-37与动脉粥样硬化的关系.广东医学,2013, 34: 3812-3814.
[17] Tete S,Tripodi D,Rosati M,et a1. IL-37(IL-1F7)the newest antiinflammatory cytokine which suppresses immune re-sponses and inflammation. Int J Immunopathol Pharmaeol,2012,25: 31-38.
[18] Hartford M, Wiklund O, Hulten LM, et al. Interleukin-18 as a predictor of future events in patients with acute coronary syndromes. Arterioscler Thromb Vasc Biol, 2010, 30: 2039-2046.
[19] 薛嬿, 刘琳琳, 贺芬, 等. IL-18通过MyD88依赖信号途径调控CSF-1表达. 生物化学与生物物理进展, 2011, 38: 311-319.
[20] Dinarello CA. Interleukin-18 and the Pathogenesis of inflammatory diseases. Semin Nephrol, 2007, 27: 98-114.
The Changes of Serum Interleukin-37 Levels in Patients With Acute Coronary Syndrome
CHEN Shao-yuan, HE Wu-yi, JIN Jian, FANG Hong-cheng, XIE Pei-yi, SU You-su.
Department of Cardiology, Nanshan Hospital, Guangdong Medical College, Shenzhen (518052), China
SU You-su, Email: SYS831@126.com
Objective: To study the serum interleukin-37 (IL-37) level changes in patients with acute coronary syndrome (ACS) and to explore the relationship between IL-37 and coronary atherosclerotic plaque.Methods: Our research included 3 groups. ACS group, n=60, SAP (stable angina pectoris) group, n=30 and Control group, the subjects with normal coronary artery, n=15. The peripheral serum levels of IL-37 were examined by ELISA and the differences were compared among different groups.Results:① The serum levels of IL-37 at admission were as ACS group < SAP group < Control group, P<0.05.②Intervention could transitionally decrease IL-37 level in SAP group. With 4 weeks treatment, IL-37 levels were signif i cantly increased in both ACS group and SAP group than admission time, while they were still lower than Control group, P<0.05.③The serum level of IL-37 at admission was negatively related to IL-18 (r=-0.79, P<0.05), the ratio of IL-18/IL-37 were as ACS group > SAP group > Control group, P<0.05. ④In ACS group, IL-37 level was negatively related to GRACE score (r=-0.71, P<0.05), the ratio of IL-18/IL-37 was positively related to GRACE score (r=0.73, P<0.05). ⑤The diagnosis of ACS could be basically excluded if the patients with IL-37>77ug/L.Conclusion: The serum IL-37 might be involved in the inf l ammatory process in ACS patients, it could be expected as an index for ACS monitor and evaluation in clinical practice.
Acute coronary syndrome; Interleukin-37; Inf l ammation
2014- 04-23 )
(编辑:常文静)
深圳市科技计划项目(201303183)
518052 广东省深圳市,广东医学院附属深圳南山医院 心血管内科
陈少源 副主任医师 硕士 主要研究方向为冠脉介入、冠脉炎症 Email:moter2002@163.com 通讯作者:苏又苏 Email:SYS831@126.com
R54
A
1000-3614(2014)11-0871-04
10.3969/j.issn.1000-3614.2014.11.004
方法: 60例ACS患者为ACS组、30例稳定性心绞痛 (SAP)为SAP组、15例冠状动脉正常者为对照组(CG)用酶联免疫吸附法(ELISA) 测定患者外周静脉血清IL-37水平。
结果:①入院时静脉血清IL-37水平ACS组<SAP组<CG组,差别有统计学意义(P<0.05);②介入干预可使SAP组IL-37一过性降低,治疗4周后血清IL-37在ACS及SAP组均较入院时明显升高,但仍低于CG组(P<0.05);③入院时静脉血清IL-37与IL-18呈负相关(r=-0.79,P<0.05),IL-18/IL-37值ACS组>SAP组>CG组(P<0.05);④ACS组中IL-37与GRACE评分呈负相关(r=-0.71,P<0.05),IL-18/IL-37值与GRACE评分呈正相关(r=0.73,P<0.05);⑤IL-37 > 77 μg/L可基本排除ACS。
结论:IL-37可能参与了ACS患者炎症过程,其有望作为临床ACS病情监测及疗效评估的指标。
