糖尿病减弱心肌组织肌浆网钙转运三磷酸腺苷酶的小泛素样修饰*
2014-03-04姚晶邵兴慧宋光远赵振燕高海洋武德崴滕思勇吴永健
姚晶,邵兴慧,宋光远,赵振燕,高海洋,武德崴,滕思勇,吴永健
糖尿病减弱心肌组织肌浆网钙转运三磷酸腺苷酶的小泛素样修饰*
姚晶,邵兴慧,宋光远,赵振燕,高海洋,武德崴,滕思勇,吴永健
目的:探索糖尿病是否可以通过心肌组织肌浆网钙转运三磷酸腺苷(ATP)酶(SERCA2a)的小泛素样修饰进而影响SERCA2a的活性与表达。
糖尿病;肌浆网钙转运ATP酶;小泛素样修饰
(Chinese Circulation Journal, 2014,29:932.)
糖尿病心血管并发症是糖尿病尤其是2型糖尿病最重要的并发症。除了对心脏血管的损伤之外,糖尿病对心肌本身也能造成损伤,最终发展成为糖尿病心肌病并导致心力衰竭。糖尿病心肌损伤的显著特点是以舒张功能不全为首发表现,并逐渐引发收缩功能不全,最终发展为心力衰竭[1,2]。多个糖尿病模型动物已经证实心肌组织肌浆网钙转运三磷酸腺苷(ATP)酶(SERCA2a)活性和表达下降是糖尿病心肌细胞Ca2+稳态失衡的主要原因[3,4],增加糖尿病心肌病大鼠模型中心肌细胞内SERCA2a的表达,可以大幅度改善大鼠的心功能[5]。最新研究显示小泛素样蛋白1(SUMO1)可以修饰SERCA2a,并增加其表达量、稳定性和ATP酶活性[6]。
糖尿病引起心肌细胞内SERCA2a的活性和表达下降是糖尿病引起心肌细胞主动舒张功能下降以及降低心肌细胞功能储备的重要原因,本研究试图探索糖尿病是否可以作用于SERCA2a的小泛素样修饰进而影响SERCA2a的活性与表达。
1 材料及方法
实验动物:2012-12至2013-02选用北京大学实验动物中心提供的8周龄SD大鼠16只,初始体重160g~180g,大鼠在12~12小时光照周期,恒温(22±2)℃,相对湿度30%~70%的无特定病原体(SPF)级屏障实验室饲养,所有实验操作均得到阜外心血管病医院实验动物伦理委员会的批准。
2型糖尿病模型大鼠建立:本研究使用高脂高糖饲料加小剂量链脲佐菌素(STZ)诱导2型糖尿病大鼠模型[7]。简言之:糖尿病组8只大鼠用高脂高糖饲料(10.0%熟猪油,20.0%蔗糖,10.0%蛋黄粉,0.5%胆酸钠和59.5%的基础饲料)喂养大鼠4周后,腹腔注射小剂量链脲佐菌素(30 mg/kg)后继续高脂饲料喂养12周诱导2型糖尿病;对照组8只大鼠普通饲料喂养,第4周以枸橼酸钠溶液作为对照腹腔注射后继续普通饲料喂养12周。
大鼠心肌取材: 大鼠腹腔注射10%水合氯醛(0.4 ml/100g)麻醉后,剪开大鼠胸腔,用50 ml注射器刺入左心耳,缓慢注入15~20 ml磷酸盐缓冲液(PBS)灌流心脏后,取下心脏置于位于冰上的含预冷的PBS 10 cm培养皿中,快速剪去多余组织并分离左右心室,将心肌组织分装后置于-80℃冰箱中保存。
大鼠超声心动图检查:大鼠麻醉后固定于恒温检查台,以头罩持续予以异氟烷吸入。选用胸骨旁左心室长轴、短轴切面和四腔心切面进行检查,并于短轴切面取M型超声,四腔心切面行组织多普勒测定。所有切面均连续采集10s 的动态图像,储存图像后使用图像分析系统(Vevo770,加拿大)分析获得心率(HR)、左心室收缩期内径(LVIDd)、左心室舒张期内径(LVIDs)、缩短指数(FS)、射血分数(EF)、舒张早晚期二尖瓣环峰值速率比(E’/A’) 等指标。
蛋白印迹法(Western-Blot): 具体方法如之前研究所述[8],取50~100 mg冻存的左心室前壁心肌组织提取组织蛋白,二喹啉甲酸(BCA)法测定蛋白浓度,制备聚丙烯酰胺凝胶,上样,电泳,转膜,封闭;一抗结合,4℃过夜,洗膜;二抗结合,洗膜;底物显色。采用凝胶成像仪(Alpha lnnotech,USA)采集图像,并使用凝胶成像分析系统(Alpha Innotech,USA)进行分析。
逆转录—聚合酶链反应(RT-PCR): 具体方法如之前研究所述[9],取50~100 mg冻存的左心室前壁心肌组织,用Trizol法提取总RNA,溶于适量无RNA酶水中。采用SuperScript RT-PCR试剂盒(Invitrogen, USA)逆转录,逆转录反应获得cDNA,实时荧光定量PCR并使用分析软件(Opticon Monitor 3,Bio-Rad)测定mRNA含量。
SERCA2a小泛素样修饰水平测定:本研究通过两种方法检测SERCA2a小泛素修饰水平。①免疫共沉淀[10]:采用免疫共沉淀试剂盒(Thermo Scientific, USA)并按照其步骤进行免疫共沉淀实验,将SUMO1抗体固定于树脂上,将提取好的蛋白溶液加入树脂中进行免疫共沉淀反应后,洗脱结合在树脂上的SUMO1以及与之结合的蛋白,行Western-Blot检测SERCA2a表达量即为SERCA2a-SUMO1量。②小泛素样试剂盒检测:采用Abcam公司的小泛素样修饰试剂盒(Abcam, UK),将SERCA2a抗体以及阴性对照分别于96孔板不同的孔中4℃孵育过夜,蛋白样本及阳性对照室温孵育1小时后,加入SUMO检测抗体以及染色液,于酶标仪(Thermo Scientific, USA)中测定450 nm处吸光度,并通过阳性、阴性对照以及吸光度计算出结合SERCA2a的SUMO1量,最后使用通过WB测定的每组SERCA2a表达量矫正得到SERCA2a小泛素样修饰程度。
2 结果
糖尿病模型建立:糖尿病组大鼠体重、空腹血糖、血C肽、HOMO-IR以及血脂水平均显著高于对照组大鼠,差异有统计学意义(P<0.05,表1),符合2型糖尿病特点。
表1 两组大鼠体重、胰岛素抵抗指数、血糖及血脂水平的变化

表1 两组大鼠体重、胰岛素抵抗指数、血糖及血脂水平的变化
注:与对照组比较*P<0.05。HOMO-IR:HOMO胰岛素抵抗指数FFA:游离脂肪酸 TG:甘油三酯 CHOL:胆固醇 LDL-C:低密度脂蛋白胆固醇。HOMO-IR=(空腹血糖×空腹胰岛素)/22.5(本研究使用空腹血C肽水平代替空腹胰岛素水平)
对照组 (n=8) 糖尿病组 (n=8)体重 (g) 287.7±14.89 378.3±19.22*空腹血糖 (mmol/L) 5.65±0.62 12.87±4.22*C肽 (pmol/L) 108.99±72.00 987.45±362.63*HOMO-IR 32.78±14.49 578.82±210.24*FFA (mmol/L) 0.58±0.21 1.68±0.42*TG (mmol/L) 0.58±0.03 2.78±0.74*CHOL (mmol/L) 1.27±0.42 3.31±0.71*LDL-C (mmol/L) 0.41±0.06 0.89±0.79*
两组大鼠心肌舒缩功能比较:与对照组比较,糖尿病组心肌收缩功能[等容收缩期左心室内压力上升的最大速率(dp/dtmax)、射血分数(EF)和缩短指数]和舒张功能[等容舒张期左心室压力下降的最大速率(-dp/dtmin) 和舒张早晚期二尖瓣环峰值速率比]均下降,尤其以舒张功能下降更为明显,差异均有统计学意义(P<0.05)。表2
表2 两组大鼠超声及血流动力学变化

表2 两组大鼠超声及血流动力学变化
注:与对照组比较*P<0.05。 dp/dtmax:等容收缩期左心室内压力上升的最大速率 -dp/dtmin:等容舒张期左心室压力下降的最大速率 EF:射血分数FS:缩短指数 E’/A’:舒张早晚期二尖瓣环峰值速率比
对照组 (n=8) 糖尿病组 (n=8)心率 (bpm) 366.40±59.06 347.83±95.29 dp/dtmax(mmHg/s) 3861.94±1039.26 3476.00±1053.61*-dp/dtmin(mmHg/s) 3561.63±1070.65 2225.34±884.46*EF (%) 72.76±11.63 69.21±11.89*FS (%) 45.11±6.65 39.21±12.90*E’/A’ 1.31±0.31 0.77±0.23*
糖尿病大鼠心肌组织内SERCA2a表达及其小泛素样修饰水平:通过Western Blot和RT-PCR可发现,与对照组比较,糖尿病组大鼠心肌组织内SERCA2a的蛋白含量和基因表达均显著下降,差异有统计学意义(P<0.05,图1); 通过免疫共沉淀实验和小泛素样修饰试剂盒检测,结果均显示相比于对照组大鼠,糖尿病组大鼠心肌组织内SERCA2a的小泛素样修饰程度显著下降,差异有统计学意义(P<0.05,图2A、2B)。
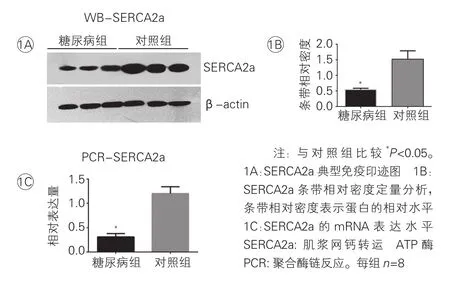
图1 蛋白印迹法和PCR分析糖尿病大鼠心肌SERCA2a蛋白及基因表达情况
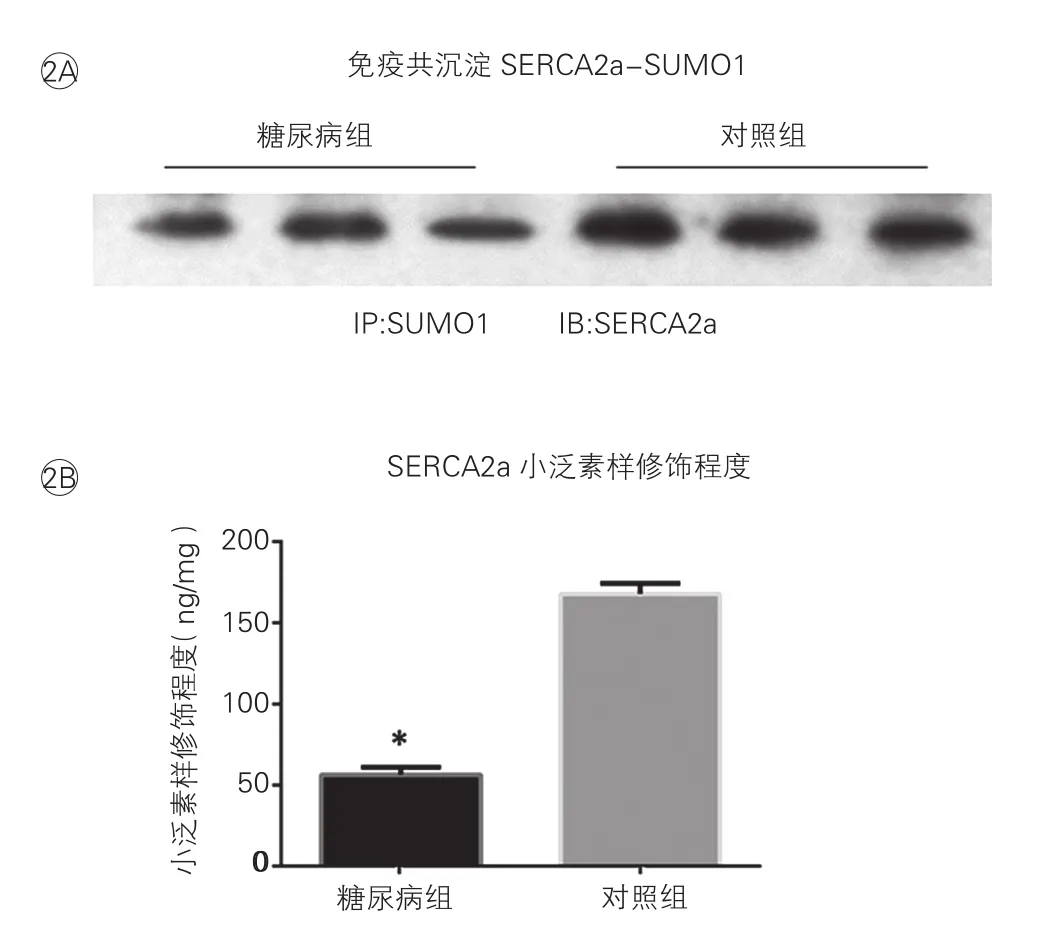
图2 免疫共沉淀分析及小泛素样试剂盒检测糖尿病大鼠心肌组织内SERCA2a小泛素样修饰水平
本研究继续评估了糖尿病大鼠及对照组大鼠心肌组织内小泛素样修饰SUMO1、激活酶E1(SAE1和SAE2组成的二聚体)和结合酶E2(Ubc9)的表达情况。结果显示糖尿病大鼠心肌组织内SUMO1及小泛素样修饰激活酶E1表达未有明显变化(图3A、3B),而结合酶E2(Ubc9)在糖尿病大鼠心肌组织内显著下降(图3C、3D)。

图3 分析比较糖尿病和对照大鼠心肌组织小泛素样修饰相关蛋白表达的变化
3 讨论
心肌细胞舒张期将Ca2+转运出胞质这一过程中有70%的Ca2+是通过SERCA2a被转运至肌浆网。近年来,众多研究也证实在增加心肌组织内SERCA2a的表达可以改善心力衰竭动物模型心功能和存活率,改善糖尿病大鼠的心功能[5]。应用于临床的心力衰竭基因治疗(通过冠状动脉注射含人类SERCA2a基因的腺相关病毒)也已取得很好的治疗效果[11]。可见SERCA2a在维持心肌细胞内钙离子平衡和心肌细胞收缩舒张功能中起到了极为重要的作用。
小泛素样蛋白属于泛素超家族中的一员,小泛素样修饰属于蛋白质翻译后修饰,由激活酶E1将SUMO激活并传递给结合酶E2,最后在连接酶E3的催化下,SUMO被结合在目的蛋白上。目前研究显示E1是SAE1(SUMO activating enzyme 1)和SAE2组成的异构二聚体;E2是蛋白Ubc9;在体外实验中发现E3对整个酶促反应是非必需的[12]。小泛素样修饰可以升高SERCA2a的表达量、稳定性和ATP酶活性[6];同增加SERCA2a本身的表达量的效果类似,增加心肌组织内SERCA2a的小泛素样修饰程度同样可以改善心力衰竭动物模型的心功能[6]。
糖尿病可引起心肌组织内SERCA2a的活性和表达下降,推测可能的原因可能有脂代谢异常,自由基损伤和ATP供应减少,但这些机制不足以完全解释SERCA2a下降的原因,故而本研究试图评估糖尿病是否可以影响心肌细胞内SERCA2a小泛素样修饰从而影响SERCA2a的表达及功能。本研究通过高脂饮食和小剂量STZ诱导建立2型糖尿病大鼠模型,糖尿病大鼠心肌收缩和舒张功能均显著降低,尤其以舒张功能下降更为明显;糖尿病大鼠心肌组织内SERCA2a的蛋白水平和基因表达水平均显著下降,同时,糖尿病大鼠心肌组织内SERCA2a的小泛素样修饰程度较对照组大鼠显著降低,提示小泛素样修饰很有可能在糖尿病引起心肌细胞内SERCA2a表达下降这一病理生理过程中起到了重要作用。通过分析大鼠心肌组织内SUMO1和小泛素样修饰相关酶的表达情况,我们发现糖尿病大鼠心肌组织内SUMO1,小泛素样修饰E1(SAE1和SAE2组成的二聚体)蛋白水平与对照组大鼠无显著区别,而小泛素样修饰E2(即Ubc9)的蛋白水平则显著下降,与SERCA2a小泛素样修饰程度变化保持一致。糖尿病对心肌组织内Ubc9以及SERCA2a小泛素样修饰的作用尚未见报道,本研究率先明确了在2型糖尿病大鼠心肌组织中存在Ubc9蛋白水平的下降,同时鉴于SUMO1蛋白和小泛素样修饰蛋白E1的蛋白水平在两组之间无明显变化,故而可推断糖尿病引起心肌细胞内SERCA2a小泛素样修饰程度下降的原因可能是通过降低Ubc9的蛋白水平来实现的。
国外有研究报道在严重胰岛素抵抗的2型糖尿病患者的骨骼肌中存在Ubc9下降[13],这篇研究中同样指出在糖尿病病程较短,胰岛素抵抗程度较轻的2型糖尿病患者骨骼肌中,Ubc9的表达与正常对照志愿者相比无明显差异;此外,虽然多个研究在不同角度上证实在糖尿病状态下,心肌组织内SERCA2a的蛋白含量和活性均下降[14-16],然而新近由Fredersdorf等[17]学者报道的一篇研究却显示在早期的2型糖尿病大鼠心肌组织内,SERCA2a的表达反而是上升的;该研究与既往研究和本研究最显著的差别是该研究使用的是早期2型糖尿病大鼠,胰岛素抵抗程度尚不显著。另外一篇关于早期饮食诱导的肥胖大鼠的研究中发现,出现显著的胰岛素抵抗的肥胖大鼠心肌组织内SERCA2a的表达同样明显降低[18]。上述研究提示胰岛素抵抗的出现和进展是糖尿病患者以及糖尿病动物模型Ubc9和SERCA2a表达下降的关键因素。考虑到SERCA2a被小泛素样修饰后ATP酶活性增强需要消耗更多的能量[6]、2型糖尿病特点虽然是高血糖和高胰岛素,然而由于胰岛素抵抗,心肌细胞内葡萄糖代谢反而不足、以及心肌细胞增加葡萄糖代谢的比例可以增加舒张功能这些已知的病理生理特点;结合本研究结果,我们推测,单纯的高葡萄糖或高胰岛素在增加心肌细胞内能量代谢和葡萄糖代谢水平的同时,也可以增加Ubc9以及小泛素样修饰水平,增加SERCA2a活性与功能,改善心肌细胞内钙离子稳态,但长期的高葡萄糖和高胰岛素可能会“透支”心肌细胞内SERCA2a以及小泛素样修饰的“潜能”,以及在胰岛素抵抗的作用下,心肌细胞葡萄糖代谢进一步下降,最终导致SERCA2a小泛素样修饰程度的下降,参与形成糖尿病心肌病的舒张功能不全。
本研究率先通过整体水平的研究,提出新近发现的SERCA2a调节机制——小泛素样修饰,可能是糖尿病心肌病引起心肌细胞舒张功能不全的内在机制,并予以初步证实,可以为糖尿病心肌病和糖尿病心肌损伤的研究和临床防治提供新的方向和思路。
[1] Aurigemma GP. Diastolic heart failure-a common and lethal condition by any name. New Engl J Med, 2006, 355: 308-310.
[2] 宋光远, 吴永健, 杨跃进, 等. 糖尿病对急性ST段抬高型心肌梗死后心力衰竭的影响. 中国循环杂志, 2008, 23: 196-199.
[3] Choi KM, Zhong Y, Hoit BD, et al. Defective intracellular Ca(2+) signaling contributes to cardiomyopathy in Type 1 diabetic rats. Am J Physiol Heart Circ Physiol, 2002, 283: H1398-408.
[4] Kim HW, Ch YS, Lee HR, et al. Diabetic alterations in cardiac sarcoplasmic reticulum Ca2+-ATPase and phospholamban protein expression. Life Sciences, 2001, 70: 367-379.
[5] Trost SU, Belke DD, Bluhm WF, et al. Overexpression of the sarcoplasmic reticulum Ca(2+)-ATPase improves myocardial contractility in diabetic cardiomyopathy. Diabetes, 2002, 51: 1166-1171.
[6] Kho C, Lee A, Jeong D, et al. SUMO1-dependent modulation of SERCA2a in heart failure. Nature, 2011, 477: 601-605.
[7] Feigh M, Hjuler ST, Andreassen KV, et al. Oral salmon calcitonin enhances insulin action and glucose metabolism in diet-induced obese streptozotocin-diabetic rats. European Journal of Pharmacology, 2014, 737: 91-96.
[8] 裴汉军, 宋光远, 王浩, 等. 糖尿病大鼠心肌梗死后易发心力衰竭的机制. 中国分子心脏病学杂志, 2008, 8: 8.
[9] 姚优修, 郑哲, 胡盛寿. 循环microRNA与冠状动脉搭桥围术期心肌损伤相关性研究. 中国循环杂志, 2013, (z1): 187-188.
[10] Adebiyi A, Narayanan D, Jaggar JH. Caveolin-1 assembles type 1 inositol 1, 4, 5-trisphosphate receptors and canonical transient receptor potential 3 channels into a functional signaling complex in arterial smooth muscle cells. The Journal of Biological Chemistry, 2011, 286: 4341-4348.
[11] Jessup M, Greenberg B, Mancini D, et al. Calcium upregulation by percutaneous administration of gene therapy in cardiac disease (CUPID): a phase 2 trial of intracoronary gene therapy of sarcoplasmic reticulum Ca2+-ATPase in patients with advanced heart failure. Circulation, 2011, 124: 304-313.
[12] Wang J. Cardiac function and disease: emerging role of small ubiquitin-related modifier. Wiley Interdisciplinary Reviews Systems Biology and Medicine, 2011, 3: 446-457.
[13] Kampmann U, Christensen B, Nielsen TS, et al. GLUT4 and UBC9 protein expression is reduced in muscle from type 2 diabetic patients with severe insulin resistance. PloS one, 2011, 6: e27854.
[14] Pereira L, Matthes J, Schuster I, et al. Mechanisms of [Ca2+]i transient decrease in cardiomyopathy of db/db type 2 diabetic mice. Diabetes, 2006, 55: 608-615.
[15] Netticadan T, Temsah RM, Kent A, et al. Depressed levels of Ca2+-cycling proteins may underlie sarcoplasmic reticulum dysfunction in the diabetic heart. Diabetes, 2001, 50: 2133-2138.
[16] Belke DD, Swanson EA, Dillmann WH. Decreased sarcoplasmic reticulum activity and contractility in diabetic db/db mouse heart. Diabetes, 2004, 53: 3201-3208.
[17] Fredersdorf S, Thumann C, Zimmermann WH, et al. Increased myocardial SERCA expression in early type 2 diabetes mellitus is insulin dependent: In vivo and in vitro data. Cardiovascular Diabetology, 2012, 11: 57.
[18] Huisamen B, Dietrich D, Bezuidenhout N, et al. Early cardiovascular changes occurring in diet-induced, obese insulin-resistant rats. Molecular and Cellular Diochemistry, 2012, 368: 37-45.
Diabetes Reducing the Intensity of Sarcoplasmic Reticulum Ca2+-ATPase-SUMOylation of Myocardium in Experimental Rats
YAO Jing, SHAO Xing-hui, SONG Guang-yuan, ZHAO Zhen-yan, GAO Hai-yang, WU De-wei, TENG Si-yong, WU Yong-jian.
Department of Cardiology, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
WU Yong-jian, Email: fuwaihospital@gmail.com
Objective: To investigate the effect of diabetes on the intensity of sarcoplasmic reticulum Ca2+-ATPase (SERCA2a)-SUMOylation and SERCA2a activity of myocardium in experimental rats.Methods: The 8 weeks old SD rats were divided into 2 groups, Diabetic group, with diet-induced type 2 diabetic rats and Control group, with normal rats. The systolic and diastolic cardiac functions were evaluated by echocardiography and left ventricular pressure measurement. The intensity of SERCA2a-SUMOylation was examined by co-immunoprecipitation and SUMOylation kit.Results: Compared with Control group, Diabetic group had decreased systolic and diastolic cardiac functions, especially for diastolic function; decreased SERCA2a protein expression and intensity of SUMOylation; decreased SUMOylation E2 (Ubc9 ) protein expression. The protein levels of SUMO1, SAE1 and SAE2 were similar between 2 groups.Conclusion: The intensity of SERCA2a-SUMOylation and Ubc9 decreased in diabetic myocardium which implies that SERCA2a-SUMOylation and Ubc9 were closely related to the damage of diabetic myocardium in experimental rats.
Diabetes; Sarcoplasmic reticulum Ca2+-ATPase; SUMOylation
2014-05-10)
(编辑:汪碧蓉)
教育部博士点基金(NO:20121106110010),协和医学院研究生创新基金(NO:2012-1002-30)资助
100037 北京市,中国医学科学院 北京协和医学院 国家心血管病中心 阜外心血管病医院 心内科
姚晶 博士研究生 主要从事糖尿病与冠心病研究 Email: desc1986@gmail.com 通讯作者:吴永健 Email: fuwaihospital@gmail.com
R54
A
1000-3614( 2014 ) 11-0932-05
10.3969/ j. issn. 1000-3614. 2014.11.020
方法:采用小动物超声和左心室压力测定评价2型糖尿病大鼠(糖尿病组)和对照大鼠(对照组)心肌收缩和舒张功能;比较糖尿病组大鼠和对照组大鼠心肌组织内SERCA2a的表达情况,用免疫共沉淀方法以及小泛素样修饰试剂盒比较糖尿病组大鼠和对照组大鼠心肌组织内SERCA2a小泛素样修饰程度。
结果:和对照组大鼠比较:糖尿病组大鼠心肌收缩、舒张功能均下降,尤以舒张功能下降更为明显;糖尿病组大鼠心肌组织内SERCA2a蛋白水平、基因表达和小泛素样修饰程度均下降;小泛素样修饰E2(Ubc9)的蛋白水平在糖尿病大鼠心肌中也下降,而小泛素样蛋白1(SUMO1)和小泛素样修饰E1(SAE1和SAE2组成的二聚体)蛋白水平无明显变化。
结论:SERCA2a小泛素样修饰程度和Ubc9蛋白水平在糖尿病心肌组织中下降,提示SERCA2a小泛素样修饰和Ubc9与糖尿病的心肌损伤密切相关。
