微生物燃料电池的研究应用进展
2014-03-03王维大李浩然冯雅丽唐新华杜竹玮杜云龙
王维大,李浩然,冯雅丽,唐新华,杜竹玮,杜云龙
(1 北京科技大学土木与环境工程学院,北京 100083;2 中国科学院过程工程研究所生化工程重点实验室,北京100190;3 新加坡国立大学土木与环境工程学院水研究中心,新加坡 117576)
微生物燃料电池(MFC)是通过产电菌代谢可生物降解的有机物,并将代谢产生的电子传递到外电路输出电能,因其独特的能源环境效应而受到了科研人员的广泛关注,原理及应用如图1所示。
目前,微生物燃料电池的研究已经历了近十年的快速发展时期,每年研究报道呈指数型增长,在提高MFC的功率输出、降低内阻、优化MFC结构及降低成本等方面进行了大量的研究,功率密度增长了几个数量级[1],研究成果为其将来的工业化应用提供了强有力的支撑,并且随着研究的深入,拓展出了微生物电解电池(MEC)、微生物脱盐电池(MDC)、微生物传感器、合成生物制品等新型发展方向,从而在产电的同时,实现污水处理、脱氮脱硝、制取燃料、合成化学品等,这使其具有了独特的技术及功能上的优势,显现出了广阔的应用前景。本文作者较为全面地概述了近几年MFC的研究现状及其应用进展,为将来的研究工作提供一定的参考与借鉴。
1 微生物燃料电池
1.1 产电微生物及其群落
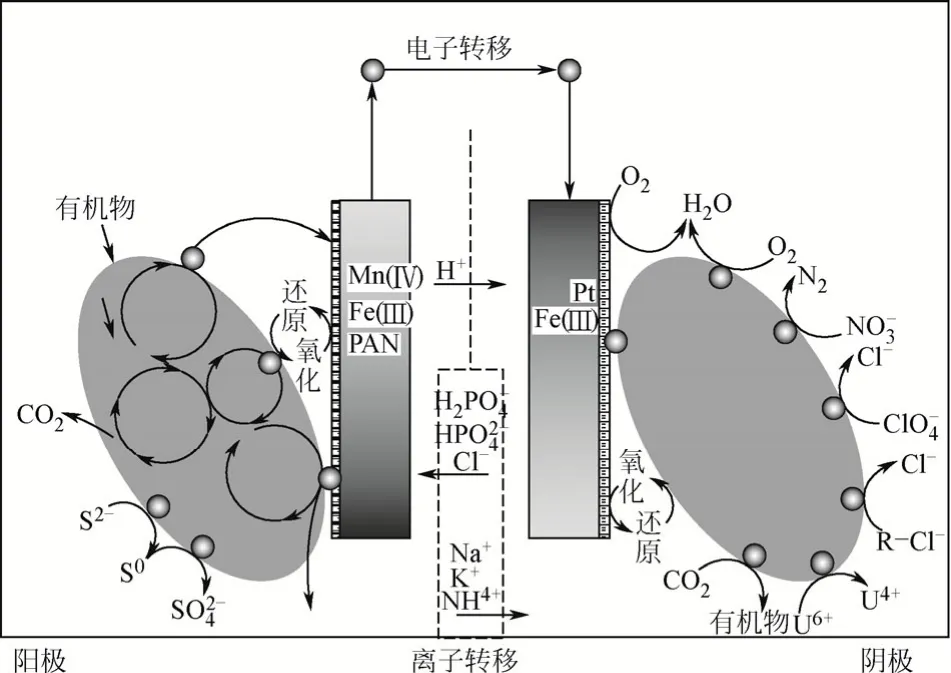
图1 微生物燃料电池及其应用原理图
目前,无介体微生物是MFC研究的主流,这类微生物可以自我产生电子介体或者通过自身的细胞组织进行电子传递,如细胞膜电子传递链和纳米导线,解决了需电子介体微生物燃料电池的高运行成本问题,同时也保证了功率密度的高效输出。目前,研究报道无需外加介体的产电微生物主要有Shewanella putrefacien、Geobacter sulferreducen、 Geobacter metallireducens、 Geopsychrobacter electrodiphilus、 Thermincola.sp.、 Rhodoferax ferrireducens、Lysinibacillus sphaericus等。国内的周良等[2-3]基于水-矿-微生物系统铁锰循环转化过程(图2),最早开始采用Geobacter metallireducens、Rhodoferax ferrireducens构建无介体微生物燃料电池,阐述了异化金属还原菌代谢的电子传递方式,并探索了微生物燃料电池用于废水处理的可能。邓丽芳等[4]分离出了一种肺炎克雷伯氏菌,并对其电子传递机制进行了研究,提出了克雷伯氏菌 MFC中的2,6-二叔丁基苯醌穿梭机制。Luo等[5]从利用活性污泥启动的 MFC中分离出了一种兼性厌氧产电菌Tolumonas osonensisa,其为革兰阳性菌,可降解多种有机物,并对菌体细胞进行了通透性处理,其产电功率得到了明显的提高,拓宽了 MFC的实际应用。

图2 水-矿-微生物系统铁锰循环转化过程
对于MFC阳极微生物的电子转移机制,普遍认可的方式主要有细胞接触转移、电子中介体转移和纳米导线转移 3种。在纳米导线方面,Lovley等[6]认为,诸如Desulfovibrio desulfuricans等产电微生物的微生物纳米线能更长距离地传导电子,穿越这种杆菌生物膜的菌丝网让生物膜具有了与广泛应用于电子工业的人造导电聚合物相媲美的导电性,电子可在其上传导,传导的距离可为细菌体长的几千倍,这种细菌的蛋白微丝就像真正的金属导线一样,这种作用代表了生物学领域一个基本的新特性。Reguera等[7-8]用电导探针原子力显微镜测定了Geobacter sulfurreducen表面菌毛的电导率并研究了Shewanella纳米导线的在100mV的电压下电子传递速率,相对于其他电子传递方式,纳米导线具有更优良的导电性。Ntarlagiannis等[9]向一根石英砂柱底部接种Shewanella oneidensis MR-1,并持续地投加乳酸作为电子供体,让氧气自然扩散于砂柱顶部,结果检测到明显的生物电流信号,扫描电镜证实在细菌或细菌矿物间形成了大量丝状的导电网络(图3),说明微生物产生的纳米导线可能在土壤中交织在一起,这个结果推进了人们对环境表层电子转移机制的理解。纳米导线的发现,不仅给微生物燃料电池在提高产电效率方面带来了希望、设计和制造廉价高效的生物阳极,还为环境污染修复、细胞生物信息学以及纳米生物电子学方面提供了潜在的应用前景,因此,生物纳米导线的人工制备方法是今后研究的主题之一[10]。

图3 沉积物界面微生物电缆传递电子示意图
对于MFC中阳极系统的微生物群落结构,有关研究表明,利用混合菌种构建MFC要优于纯菌构建MFC的性能,因为混合接种的MFC中微生物具有高度的生物多样性,这些微生物随着不同的运行条件的变化而变化,其中产电菌通过产电过程直接或间接获得能量,从而逐渐成为该体系中的优势微生物。Li等[11]研究了导电聚合物生物阴极应用和微生物群落结构的变化,结果表明导电聚合物改性后,阴极微生物群落中优势菌由β-Proteobacteria变为α,γ-Proteobacteria.Rubaba等[12]研究了不同膜电极装置 MFC的产电性能和群落结构,结果表明产电性能最好时,其细菌群落结构中乳酸发酵和铁还原菌属占主导地位,通过对其分离与筛选,主要为革兰阳性菌 Propioniferax sp.P7,表明该细菌在MFC中构建电子传递网络发挥了积极作用。MFC中微生物群落由于存在很大的差异,因此,产电微生物与其他微生物之间的相互作用以及整个阳极系统菌种的演替规律还有待于进一步研究。
1.2 电极材料
降低成本是推进MFC实用化的必经之路,开发廉价高效的电极材料是降低MFC成本的关键。MFC的电极分为阳极和阴极,其作为微生物和催化剂的载体,以及电子转移的导体,须具有良好的导电性、稳定性,一定的机械强度,廉价的成本以及电极表面与微生物具有良好的相容性。
1.2.1 阴极材料
21世纪初,微生物燃料电池的研究重点是功率输出的提高,经过十年左右的研究工作,其功率密度输出提高了100多倍。近年来,研究重心更偏向于微生物燃料电池的应用化研究。
目前在MFC中应用最多的还是铂催化剂,但金属铂价格昂贵。近几年来,非贵金属氧化物催化剂由于其来源广泛、价格低廉,被广泛应用于多种电池体系,如 PbO2、MnOx、TiO2、铁氧化物等,其中,MnO2和TiO2是目前研究较多的MFC阴极催化剂。Liu等[13-14]利用纳米二氧化锰作为阴极催化剂,构建了 MFC处理模拟生活污水,其最大功率密度可达722mW/m3,具有催化性能好、价格低廉等优点。Lu等[15]以涂载了TiO2的石墨板为阴极电极,分别比较了可见光照射和黑暗条件下阴极负载TiO2的MFC性能,并进一步与铂电极和石墨电极性能进行了对比,其功率密度比石墨阴极 MFC高230%,低于阴极负载铂催化剂MFC的功率密度。Wang等[16]利用羰基铁热解修饰MFC阴极,结果表明,阴极修饰后的MFC最大输出电压、功率密度和最小表观内阻分别为 220mV、925mW/m3和278Ω,其性能略高于铂碳修饰阴极的电池。
过渡金属大环化合物对氧具有电化学还原活性,尤其是过渡金属卟啉和酞菁化合物。由于大环类化合物的脱金属作用比较强,在中性或者碱性的环境中是稳定的,因此,这类催化剂适合成为中性操作条件下MFC的阴极催化剂。过渡金属大环化合物的中心离子通常为Fe、Co、Ni等,其中以Fe和Co形成的配合物具有较高的氧还原活性。有研究人员[17]以铁酞菁(FePc)和钴卟啉(CoTMPP)作双室MFC阴极催化剂,这两种阴极催化剂的性能均接近于贵金属铂催化剂的水平。也有研究人员[18]将铁钴双核双金属酞菁化合物作为MFC阴极催化剂进行了研究,结果表明,具有非常好的电催化活性。
导电聚合物因其对氧气具有较好的还原催化性在MFC领域占有很重要的比重。Yuan等[19]将聚吡咯与碳黑复合物(Ppy/C)用于阴极,研究了其作为阴极催化剂的作用。经过循环伏安扫描及线性伏安扫描分析发现,修饰了 Ppy/C后,氧化还原反应电位正移了约 260mV,电池的最大功率密度为401.8mW/m2,大于碳黑阴极(90.9mW/m2)和铁阴极(336.6mW/m2)的功率密度,虽低于铂电极的功率密度,但是单位成本的能源输出比铂电极高了15倍。他们还研究了聚苯胺-碳黑-酞菁铁(PANI/C/FePc)对氧气还原反应的催化作用[20],运行结果显示,PANI/C/FePc阴极催化剂的最大功率输出达到了630.5mW/m2,大于C/FePc(336.6mW/m2)和Pt(575.6mW/m2)阴极的功率输出。Fu等[21]在双室微生物燃料电池中,研究了普鲁士蓝/聚苯胺(PB/PANI)复合物的催化效果。通过电化学检测发现,PB/PANI具有很强的电化学反应活性;微生物燃料电池的运行结果显示,电池的输出功率能够达到13.12W/m3,与清洁碳阴极系统中加入K3Fe(CN)6所得到的功率输出相似(12.67W/m3)。Lai等[22]通过煅烧聚苯胺和铁复合物制备了一种新型的碳氮金属催化剂,其最大功率密度为 10.17W/m3,高于 Pt/C为催化剂的MFC,证明了碳氮金属催化剂在MFC中是一种潜在可替代Pt/C的催化剂。
1.2.2 阳极材料
微生物燃料电池系统的无介体产电菌群主要是异化金属还原菌,由于这些菌与过渡态金属之间的亲和作用,研究人员开始使用过渡态金属氧化物作为电极修饰剂,以促进微生物燃料电池系统产电能力的提升。研究比较成熟的金属化合物主要有Fe3O4、MnO2、WC等。
经修饰后的阳极能够通过静电吸附、与外膜表面的细胞色素酶作用等方式促进产电菌群在阳极表面的黏附,同时通过过渡金属本身晶格上电子的不稳定性促进了电子的传递。李少华等[23]将 NaVO3及 K3[VO(O)2(OOC-COO)]分别用于阳极及阴极催化,使电池最大输出功率提高了15倍。M yers等[24]研究发现,S.putrefaciens的呼吸电子传递过程与Fe3+、Mn4+的厌氧还原过程有直接关联,在厌氧条件下,微生物80%的呼吸色素都分布于细胞外膜表面。Lies等[25]的研究也发现 Shewanella oneidensis MR-1细胞在纳米多孔玻璃珠表面成膜的同时伴随着包裹在其中的三价铁的还原。
金属化合物修饰得到的电极比表面积一般较小,不利于微生物的大量附着,同时金属化合物的催化效能适用面较窄。随着多孔性阳极材料、新产电复合菌群的应用,电极修饰的方法已逐渐以非金属修饰法为主,如氨气下高温焙烧,电化学氧化及纳米、高分子材料修饰等。氨气保护下高温处理及电化学氧化处理两种方法是对阳极材料本体进行处理,活化电极表面基团,增大活性面积等。Cheng等[26]成功地将氨修饰的碳布材料应用到了微生物燃料电池中。碳布进行了氨基修饰后,由于氨基基团的存在,材料本体上的表面电荷得到了显著增加(从0.38meq/m2增加到3.99meq/m2),微生物与电极表面间的静电作用得到了显著增强,同时氨基与微生物表面的羧基形成肽键,增强它们之间的相互作用。由此,微生物燃料电池的产电性能得到了提高,最大功率密度得到了提升(达 115W/m3),同时启动时间也降低了许多(减少50%)。Wang等[27]通过对碳布进行不同的前处理发现,氨气氛围下高温处理使得电极表面的氮碳比增大,电池功率达到了51W/m3,与空白实验对比有了很大的提高。
电化学氧化修饰法主要是通过在酸性溶液中的电解,增加电极表面的羧基基团。虽然微生物表面净电荷为负电,电极表面羧基的增加会增大静电排斥力,但是由于微生物表面存在着大量细胞色素,其上含有许多活性基团,羧基可以与细胞色素上的活性基团形成强烈的氢键等化学键作用[28],增强了微生物与电极之间的化学相互作用。因而电极表面羧基化在微生物燃料电池产电性能的优化中具有一定的应用前景。Tang等[29]通过在硫酸条件下对石墨毡进行电解,发现石墨毡表面的羧基基团增加,生物膜在电极上的电化学活性显著提高。电池的启动时间从 170h减少到 70h,最大输出功率密度从(967±40)mW/m2增加到(1630±50)mW/m2,库仑效率从38.4%增大到57.1%。而纳米、高分子材料修饰则是对电极本体进行外接修饰基团,改变电极表面的活性基团或表面空间结构性质等,从而优化微生物燃料电池系统的阳极效率,典型的纳米、高分子材料修饰物有导电聚合物、碳纳米管等。Feng等[30]在吡咯(pyrrole)与蒽醌-2,6-二磺酸钠(AQDS)的混合溶液中采用恒电位的方法在碳毡表面制得一层导电聚合物薄膜(Ppy/AQDS),并将其作为阳极应用到一个双室微生物燃料电池中。通过与阳极未经修饰的微生物燃料电池进行对比研究发现,当在阳极表面修饰上一层导电聚合物膜后,微生物燃料电池的功率提高了13倍,阳极的比表面积增加了,电极上吸附的微生物数量也有增多。电极上固定AQDS作为一种电子转移介体,也进一步提高了电子传递的效率。
Li等[31]研究了导电聚合物对微生物燃料电池产电及电极表面生物多样性的影响。研究中使用导电聚苯胺以及聚(苯胺-邻氨基酚)对阳极进行修饰,发现修饰后的电极可以缩短电池的启动时间,电池的功率输出相较于清洁电极分别提高了35%、18%。同时,变性梯度凝胶电泳分析结果显示,修饰后电极上的微生物种类增多了,两类修饰电极上微生物种群所占的比例也不相同。Zou等[32]将聚吡咯做成纳米结构修饰到阳极上,并且对比了不同纳米结构的作用优劣。通过循环伏安法及电化学阻抗测定,发现修饰了纤维聚吡咯的电极内阻(4.3Ω)要小于球状聚吡咯的电极内阻(12.6Ω),同时纤维聚吡咯电极的功率输出密度(3.4mW/m2)要大于球状聚吡咯电极的功率输出密度(3.1mW/m2),由此显示出纳米纤维聚吡咯在电极上的作用要优于球状纳米聚吡咯的作用。Qiao等[33]合成了一种具有高比表面积、孔径分布均匀的纳米聚苯胺-二氧化钛复合物。实验结果表明,当聚苯胺所占质量分数为30%时,复合物的电催化及生物催化性能最好,功率密度达到了1495mW/m2,是之前有关研究报道的两倍。Lai等[34]对HSO掺杂聚苯胺修饰MFC阳极进行了研究,结果表明:修饰后电池最大功率输出为5.16W/m3,内阻为90Ω,启动时间缩短至4天。经聚苯胺修饰后负载生物量增多,防止了聚苯胺的脱落,并促进了电子的转移。
碳纳米管也被应用于微生物燃料电池的阳极修饰之中并取得了一定的研究进展,而更多的研究报告集中在碳纳米管及聚合物复合修饰电极的应用。Zou等[35]采用原位化学聚合的方法在碳纳米管(CNTs)上聚合形成的了一层聚吡咯膜,制得聚吡咯/碳纳米管(PPy-CNTs)修饰电极。通过循环伏安法、电化学阻抗谱图及放电实验测试,PPy-CNTs修饰电极相比于平板碳纸电极具有更加优良的电化学特性。电池的输出功率随着修饰密度的增大而增加。在大肠杆菌微生物燃料电池中,5mg/m2PPy-CNTs修饰密度的条件下,最大功率输出为228mW/m2,远大于其他使用电子传递中介体的大肠杆菌燃料电池。Kim等[36]采用多壁碳纳米管-聚丙烯腈复合物修饰碳纸阳极,研究结果显示复合物含有 5%(质量分数)的多壁碳纳米管时,微生物燃料电池的功率输出最大,电极的电化学活性最高。
随着研究的深入,相信会有更多的导电聚合物被用于微生物燃料电池的研究中,用于提高微生物燃料电池的性能与功率输出,为其工业化应用做出积极的影响。
1.3 MFC与MEC的放大
反应器的中试放大是微生物燃料电池工业应用的一个必经之路,但其由于涉及微生物、材料、技术以及经济等方面,给MFC实际应用带来了诸多困难。目前,制约微生物燃料电池的放大的因素主要包括:①电池功率密度较低,离实际应用相差较远;②电极材料,特别是铂催化剂价格昂贵;③微生物燃料电池长期运行容易造成电极和膜的污染,运行成本高和操作难度大。

图4 堆栈式微生物燃料电池堆
由于单个微生物燃料电池内阻较大,输出功率低,废水处理能力有限,并且电池的功率会随着单电池体积的增大而增大,电池的功率密度却是随着体积的增大而减小,这种规律决定了微生物燃料电池的放大应该是将多个相同的单电池有机地组合起来。因此,对于MFC放大的研究,目前主要包括两个方面:一方面是对反应器串并联的研究;另一方面是中试研究。在反应器串并联研究方面,李顶杰等[37]研究了不同联接形式对电池组宏观功率的影响,明确指出了通过混联消除反极现象的方法。Aelterman等[38]将6个微生物燃料电池串/并联起来(图4),阳极和阴极都为石墨棒,以乙酸钠为底物,铁氰化物为阴极电解质,当电池并联时产生59W/m3的最大功率密度,库仑效率为 78%;串联时产生51W/m3的最大功率密度,库仑效率为 12%。电池功率比单个电池提高了不少,但是电池电压不平衡,电极的反极使得某些电池产生负电压,严重影响电池的运行。Shin等[39]设计的由5个双极板微生物燃料电池构成的电池组,以葡萄糖为底物,以铁氰化物为阴极电解质,得到最大功率密度为1300mW/m2,而使用纯氧时,最大功率密度为230mW/m2,他们使用电容器将产生的电能储存起来,点亮了一个小灯泡。Rahimnejad等[40]利用酿酒酵母菌作为生物催化剂,构建了由4个单元组成的微生物燃料电池堆,运行结果表明,其最大电流和功率分别为6447mA/m2和2003mW/m2,库仑效率达到了 22%。Oh等[41]将两个微生物燃料电池串联起来,研究微生物燃料电池的电压反向问题。最初,两个电池的输出电压相同,但几个周期后,其中的一个电池输出电压降低,接下来是输出电压反向,导致电池总电压从380mV降到80mV。这表明底物消耗不均会导致电池的电压反向。Li等[42]对一个10L的蛇形微生物燃料电池堆(图5)处理啤酒废水的长期运行进行了考察,结果表明该电池堆的开路电压为 23.0V,最高功率密度为 4.1W/m3(0.7A/m3)。经过长时间的运行,对电池堆的性能进行了电化学测试,其性能下降的原因在于阴极而不是阳极,对阴极处理后其产电功率迅速的到了恢复,为MFCs的放大提供了一定的理论基础。不论哪种形式的装置,串并联电路时,往往单个电池的性能决定着电池堆的工作性能,电池内阻的差异是导致反极现象的主要因素,对于不同内阻的 MFC分组连接,可减少由MFC内阻差异而导致电能输出的下降[37]。

图5 蛇形式微生物燃料电池堆
在中试研究方面,昆士兰大学 Keller、Rabaey与福斯特(Foster)啤酒厂合作,建成了世界上第一个中试规模的MFC(图6),该MFC为单室,由12个模块构成,每个高3m,总容积大约1m3,其中阳极采用碳纤维刷,阴极采用石墨纤维刷,阳极置于装置的内部,阴极包裹于装置的外部,利用啤酒废水发电,可承受的有机负荷为10gCOD/ (L·d)。另外,美国宾州州立大学的研究人员[43]在纳帕(Napa)葡萄酒公司构建了一个MEC装置(图7),该装置采用浸泡的碳刷阳极和不锈钢阴极,共有24个模块,每个模块有6个电极,总体积约为1m3,其装置的性能仍在研究中。在国内,中国海洋大学的付玉彬等[44]构建了海洋沉积物微生物燃料电池,利用串并联升压的方式,在胶州湾浅海成功驱动小型电子装置的运行。

图6 管状微生物燃料电池中试装置(www.m icrobialfuelcell.org)
2 微生物燃料电池的应用
2.1 废水处理

图7 微生物电解电池的中试装置
利用微生物燃料电池处理废水可以实现废水到电能的一步转化,在处理废水的同时使废水资源化。结合微生物燃料电池的原理和废水中的污染物成分,包括单室和双室微生物燃料电池废水处理,而双室 MFC又分为阳极室废水处理、阴极室废水处理以及中间室废水处理。
大部分废水处理的研究是在阳极室中进行的,废水中所含的有机物主要是以碳源和电子供体的形式被阳极微生物所利用,其总能量的消耗途径主要包括未被氧化的能量、微生物的合成与代谢、阴极的活化电势、电阻和扩散消耗以及阴极再生,整个阳极系统有20%~30%被转化为电能,如图8所示。废水中有机物是否可生化降解是MFC处理废水的关键,因为其直接影响着能量的转换,目前,在MFC阳极处理的有机物主要包括易生物降解的废水,例如市政污水[45]、食品加工废水[46]、酿酒废水[47]等;对于难降解的有机污染物,需要添加易降解的有机物作为共基质,即在共代谢的条件下被有效降解。另外,含硫废水中的硫离子也可在 MFC阳极中作为电子供体被产电微生物所利用[48]。
在MFC阴极室,无氧气存在时,高氧化还原电势的物质在阴极表面得到电子发生还原反应,如果采用某种污染物作为电子受体,则该污染物接受电子被还原为无污染或低毒性的物质,该过程可以直接接受阴极电子发生还原反应,如硝基苯废水[50]、染料废水[51]等;也可在微生物的作用下发生间接还原,即利用微生物作为生物催化剂构建生物阴极,这些微生物利用阴极作为电子供体而利用污染物作为电子受体,从而达到在新陈代谢的过程中还原污染物而获得ATP,该原理通常用来处理较难被还原的污染物,改变其溶解性、毒性、放射性等,如含氮废水[52]、氯代烃废水[53]和重金属废水[54]等。对于含氮废水,也可以通过好氧阴极来实现,一部分氧用作电子受体,另一部分用于含氮废水的好氧降解,此外,阴阳两室可以协同作用来降解污染物。

图8 外阻为200Ω,Ag2O/Ag阴极微生物燃料电池的能量回收
中间室是指双室MFC阴阳两极室加入一组阳、阴离子交换膜,这两种膜之间形成空间,所形成的电池也称为微生物脱盐电池。该电池中间室主要用于含盐废水的净化,如苦咸水、海水等[55],也可结合废水处理和产氢实现多重功能[56],因此,MFC中间室在盐水淡化的处理上有着广阔的应用前景。
2.2 微生物电合成
近几年,在微生物燃料电池领域的研究热点已经从生物产电转变为制备化学品,使阳极释放的能量能够以化学品的形式在阴极储存,目前,在微生物电合成方面,所产物质主要包括氢气、H2O2以及低分子有机物。
2.2.1 制氢
用于产氢的微生物燃料电池通常被称为微生物电解电池(MEC),是微生物燃料电池领域的一个重要方向,其优势在于比发酵产生的氢更多,而且能把氢气储存起来,弥补了微生物燃料电池产电功率密度低的缺点,因此,微生物电解电池有着广阔的应用前景。
目前,MEC同 MFC一样,在改进反应器结构[57]、低成本高效阴极的开发[58]的同时,对反应器的放大也进行了研究,Heidrich等[59]构建了一个120L的微生物电解电池,利用生活污水产氢,每个周期运行3个月,其COD的容积负荷和能耗分别为0.14kg/(m3·d)和2.3KJ/(gCOD),较低于活性污泥的COD容积负荷和能耗,反应器每天产生0.015L的氢气,库仑效率为55%。Yu等[60]设计了一个3.7L装有膜电极的微生物电解电池,并对其性能进行了考察,在电压为1.2V,乙酸钠作为有机物,其反应器氢气产生速率为0.12m3/(m3·d)。Gil-Carrera等[61]利用一个中试微生物电解电池处理低浓度生活污水,在能耗较低[1.6kW·h/(kgCOD)]的情况下,COD的浓度可下降85%,氢气的产量与有机物的降解量及阴极的性能有关。虽然,较多的研究人员投入于MEC的中试研究,但是MEC用于工业化还比较远,仍需进一步对其影响因素和运行特性进行探索。
2.2.2 制备H2O2及合成Fenton试剂
H2O2是一种重要的化工原料,但目前工业生产存在能耗高的缺点。利用微生物燃料电池制备H2O2,是基于微生物在阳极室氧化废水中的有机物,在阴极通过溶解氧的不完全反应产生,是一种低成本的生产方法。Rozendal等[62]对生物电化学系统阳极降解废水中有机物,阴极产生 H2O2进行了研究,结果表明在工作电压0.5V下,H2O2的浓度为 0.13%时,系统的产出能力为(1.9±0.2)kgH2O2/ (m3·d),所需能源大部分源于乙酸盐,能耗需求低。如果这个过程能在工业上应用,H2O2的质量分数需要提高到 2%~3%。此外,在阴极原位合成 H2O2的同时,若加入Fe2+即形成了Fenton试剂,可用于处理难生化降解废水。Fu等[63]研究了产 H2O2的MFC与原位Fenton反应结合降解偶氮燃料进行了研究,体系消耗1mmolFe2+时,对于传统 MFC的Fenton系统,1h内染料的降解比例为82.5%;对于电化学MFC的Fenton系统,添加0.5mmolFe3+时,染料的降解比例达到76.43%,阴极电势可保持1h,最大功率密度为28.3W/m3,该研究为难生物降解废水绿色可持续处理同时产电提供了一条新途径。Li等[64]考察了利用黄铁矿作为阴极 Fenton催化剂对垃圾渗滤液中难降解有机物的去除效果,结果表明,黄铁矿涂覆石墨阴极其最大功率密度为4.2W/m3,比单纯石墨阴极高 133%;垃圾渗滤液的色度和COD去除率为77%和78%。Zhu等[65]利用MFC作为电Fenton反应器的能量来源处理有机污染物,结果表明在一个循环(22h),系统中总有机碳的去除75%±2%,苯酚被转化为可生化降解的有机酸,该系统对工业废水中特定污染物的处理是节能且低成本的。若能利用微生物燃料电池合成双氧水或Fenton试剂,有机地结合到废水处理工艺中,将会使微生物燃料电池更具发展前景。
2.2.3 合成生物化学品

图9 生物化学品的生产途径[67]
微生物电化学合成是将电流作为微生物催化还原或氧化能量的来源,对CO2进行固定,转换成燃料或生物化学品的一种新技术[66]。目前,相关生物化学品的制备途径如图9所示[67],目标产物是通过阳光和CO2来合成或工业发酵获得,也可通过利用电能固定二氧化碳直接生产或引起乙酰辅酶A和它的衍生物的形成,进一步合成所需产物。相关研究表明,在生物阴极MFC中,利用阳极降解有机物提供电子,而生物阴极合成有价值的生物化学品,如乙醇[68]、2,3-丁二醇[69]、甲烷[70]以及乙酸盐[71]等,其合成的过程经济高效,完全可以用于新兴的生物合成工业中。
2.3 微生物传感器
生物传感器是指能提供定量或者半定量分析的一种装置,包括生物识别元素和信号传输放大元素。由于微生物燃料电池的电流(电压)或电子库仑量与电子供体的含量之间存在对应关系,因此微生物燃料电池能用于某些底物含量的测定,如有机碳[72]、废水 BOD[73]以及有毒物质[74]等,其中用于废水中 BOD 测定的研究最为成熟,已有相关报道[75]。
微生物传感器的输出和输入信号之间在一定范围内存在良好的相关性,因此,适用于成分多样且不确定的废水水质,对MFC应用领域的扩大具有重要意义。
3 结 语
MFC能够利用废水及废弃物等生物质资源作为能源,降解污染物的同时产生电能,在环境保护和新能源开发的大力推动下,MFC具有巨大的产业化前景。将来还需从下面几个方向努力。
(1)在MFC中菌种方面,从极端环境中(如深海底泥、高温环境等)筛选耐受能力强的产电菌,进一步研究产电菌电子的产生、传递机理,微生物群落的多样性及其演替规律,对高效产电微生物进行基因改造等。
(2)优化MFC的结构、电极材料和运行方式等,尤其是空气阴极以及生物阴极方面,以使其能应用于实际生产中。
(3)微生物电化学合成是近两年微生物燃料电池新的发展方向,有待于进一步深入研究。
[1] Zhang F,Saito T,Cheng S,et al.M icrobial fuel cell cathodes w ith poly (dimethylsiloxane) diffusion layers constructed around stainless steel mesh current collectors[J].Environmental Science & Technology,2010,44(4):1490-1495.
[2] 周良,刘志丹,连静,等.利用微生物燃料电池研究 geobacter metallireducens异化还原铁氧化物[J].化工学报,2005,56(12):2398-2403.
[3] Liu Z,Du Z,Lian J,et al.Improving energy accumulation of m icrobial fuel cells by metabolism regulation using Rhodoferax ferrireducens as biocatalyst[J].Letters in Applied M icrobiology, 2007,44(4):393-398.
[4] 邓丽芳,李芳柏,周顺桂,等.克雷伯氏菌燃料电池的电子穿梭机制研究[J].科学通报,2009(19):2983-2987.
[5] Luo J,Yang J,He H,et al.A new electrochem ically active bacterium phylogenetically related totolumonas osonensis and power performance in MFCs[J].Bioresource Technology,2013,139:141-148.
[6] Lovley D R,Stolz J F,Nord G L,et al.Anaerobic production of magnetite by a dissim ilatory iron-reducing m icroorganism[J].Nature,1987,330(6145):252-254.
[7] Reguera G,M cCarthy K D,Mehta T,et al.Extracellular electron transfer via m icrobial nanow ires[J].Nature,2005,435(7045):1098-1101.
[8] Reguera G,Nevin K P,Nicoll J S,et al.Biofilm and nanow ire production leads to increased current in geobacter sulfurreducens fuel cells[J].Appl.Environ.Microbiol.,2006,72(11):7345-7348.
[9] Ntarlagiannis D,Atekwana E A,Hill E A,et al.M icrobial nanow ires:Is the subsurface “hardwired”[J].Geophysical Research Letters,2007,34(17):L17035.
[10] 许杰龙,周顺桂,袁勇,等.有“生命”的电线:浅析微生物纳米导线电子传递机制及其应用[J].化学进展,2012(9):1794-1800.
[11] Li C,Ding L,Cui H,et al.Application of conductive polymers in biocathode of m icrobial fuel cells and m icrobial community[J].Bioresource Technology,2012,116:459-465.
[12] Rubaba O,Araki Y,Yamamoto S,et al.Electricity producing property and bacterial community structure in m icrobial fuel cell equipped w ith membrane electrode assembly[J].Journal of Bioscience and Bioengineering,2013,116(1):106-113.
[13] Liu X W,Sun X F,Huang Y X,et al.Nano-structured manganese oxide as a cathodic catalyst for enhanced oxygen reduction in a microbial fuel cell fed w ith a synthetic wastewater[J].Water Research,2010,44(18):5298-5305.
[14] Roche I,Katuri K,Scott K.A microbial fuel cell using manganese oxide oxygen reduction catalysts[J].Journal of Applied Electrochemistry,2010,40(1):13-21.
[15] Lu A,Li Y,Jin S,et al.Microbial fuel cell equipped with a photocatalytic rutile-coated cathode[J].Energy & Fuels,2009,24(2):1184-1190.
[16] Wang P,Lai B,Li H,et al.Deposition of Fe on graphite felt by thermal decomposition of Fe(CO)5for effective cathodic preparation of m icrobial fuel cells[J].Bioresource Technology,2013,134:30-35.
[17] HaoYu E,Cheng S,Scott K,et al.M icrobial fuel cell performance w ith non-Pt cathode catalysts[J].Journal of Power Sources,2007,171(2):275-281.
[18] Zhou M,Chi M,Luo J,et al.An overview of electrode materials in m icrobial fuel cells[J].Journal of Power Sources,2011,196(10):4427-4435.
[19] Yuan Y,Zhou S,Zhuang L.Polypyrrole/carbon black composite as a novel oxygen reduction catalyst for m icrobial fuel cells[J].Journal of Power Sources,2010,195(11):3490-3493.
[20] Yuan Y, Ahmed J, Kim S.Polyaniline/carbon black composite-supported iron phthalocyanine as an oxygen reduction catalyst for m icrobial fuel cells[J].Journal of Power Sources,2011,196(3):1103-1106.
[21] Fu L,You S J,Zhang G Q,et al.Pb/pani-modified electrode used as a novel oxygen reduction cathode in m icrobial fuel cell[J].Biosensors and Bioelectronics,2011,26(5):1975-1979.
[22] Lai B,Wang P,Li H,et al.Calcined polyaniline-iron composite as a high efficient cathodic catalyst in m icrobial fuel cells[J].Bioresource Technology,2013,131:321-324.
[23] 李少华,杜竹玮,祝学远,等.Rhodoferax ferrireducens微生物燃料电池中钒化合物的催化性能[J].过程工程学报,2007(3):589-593.
[24] M yers C R,M yers J M.Localization of cytochromes to the outer membrane of anaerobically grown shewanella putrefaciens MR-1[J].Journal of Bacteriology,1992,174(11):3429-3438.
[25] Lies D P,Hernandez M E,Kappler A,et al.Shewanella oneidensis MR-1 uses overlapping pathways for iron reduction at a distance and by direct contact under conditions relevant for biofilms[J].Appl.Environ.Microbiol.,2005,71(8):4414-4426.
[26] Cheng S,Logan B E.Ammonia treatment of carbon cloth anodes to enhance power generation of m icrobial fuel cells[J].Electrochemistry Communications,2007,9(3):492-496.
[27] Wang X,Cheng S,Feng Y,et al.Use of carbon mesh anodes and the effect of different pretreatment methods on power production in m icrobial fuel cells[J].Environmental Science & Technology,2009,43(17):6870-6874.
[28] Crittenden S R,Sund C J,Sumner J J.Mediating electron transfer from bacteria to a gold electrode via a self-assembled monolayer[J].Langmuir,2006,22(23):9473-9476.
[29] Tang X,Guo K,Li H,et al.Electrochem ical treatment of graphite to enhance electron transfer from bacteria to electrodes[J].Bioresource Technology,2011,102(3):3558-3560.
[30] Feng C,Ma L,Li F,et al.A polypyrrole/anthraquinone-2,6-disulphonic disodium salt (ppy/aqds)-modified anode to improve performance of m icrobial fuel cells[J].Biosensors and Bioelectronics,2010,25(6):1516-1520.
[31] Li C,Zhang L,Ding L,et al.Effect of conductive polymers coated anode on the performance of m icrobial fuel cells and its biodiversity analysis[J].Biosensors and Bioelectronics,2011,26(10):4169-4176.
[32] Zou Y,Pisciotta J,Baskakov I V.Nanostructured polypyrrole-coated anode for sun-powered m icrobial fuel cells[J].Bioelectrochemistry,2010,79(1):50-56.
[33] A llen R M,Bennetto H P.M icrobial fuel cells[J].Applied Biochemistry and Biotechnology,1993,39(1):27-40.
[34] Lai B,Tang X,Li H,et al.Power production enhancement w ith a polyaniline modified anode in m icrobial fuel cells[J].Biosensors and Bioelectronics,2011,28(1):373-377.
[35] Nandy A,Kumar V,Kundu P P.Utilization of proteinaceous materials for power generation in a mediatorless microbial fuel cell by a new electrogenic bacteria Lysinibacillus sphaericus VA5[J].Enzyme and Microbial Technology,2013,53(5):339-344.
[36] Kim S I,Roh S H.Multiwalled carbon nanotube/polyarcylonitrile composite as anode material for microbial fuel cells application[J].Journal of Nanoscience and Nanotechnology,2010,10(5):3271-3274.
[37] 李顶杰,何辉,卢翠香,等.串/并联微生物燃料电池的性能[J].过程工程学报,2009(2):338-343.
[38] Aelterman P,Rabaey K,Pham H T,et al.Continuous electricity generation at high voltages and currents using stacked m icrobial fuel cells[J].Environmental Science & Technology,2006,40(10):3388-3394.
[39] Shin S,Choi Y,Na S,et al.Development of bipolar plate stack type m icrobial fuel cells[J].Bulletin-korean Chemical Society,2006,27(2):281.
[40] Rahimnejad M,Ghoreyshi A,Najafpour G,et al.A novel microbial fuel cell stack for continuous production of clean energy[J].International Journal of Hydrogen Energy,2012,37(7):5992-6000.
[41] Oh S E,Logan B.E.Voltage reversal during microbial fuel cell stack operation[J].Journal of Power Sources,2007,167(1):11-17.
[42] Zhuang L,Yuan Y,Wang Y,et al.Long-term evaluation of a 10-liter serpentine-type m icrobial fuel cell stack treating brewery wastewater[J].Bioresource Technology,2012,123:406-412.
[43] Logan B E.Scaling up m icrobial fuel cells and other bioelectrochem ical systems[J].Applied Microbiology and Biotechnology,2010,85(6):1665-1671.
[44] 付玉彬,李建海,赵仲凯,等.海底生物燃料电池作为电源驱动小型电子器件的应用研究[J].中国海洋大学学报:自然科学版,2012(6):93-98.
[45] Navanietha Krishnaraj R,Karthikeyan R,Sheela Berchmans,et al.Functionalization of electrochem ically deposited chitosan films w ith alginate and prussian blue for enhanced performance of microbial fuel cells[J].Electrochimica Acta,2013,112:465-472.
[46] Mansoorian H J,Mahvi A H,Jaafari A J,et al.Bioelectricity generation using two chamber m icrobial fuel cell treating wastewater from food processing[J].Enzyme and Microbial Technology,2013,52(6-7):352-357.
[47] Wen Q,Wu Y,Zhao L,et al.Production of electricity from the treatment of continuous brewery wastewater using a m icrobial fuel cell[J].Fuel,2010,89(7):1381-1385.
[48] Liang F Y,Deng H,Zhao F.Sulfur pollutants treatment using m icrobial fuel cells from perspectives of electrochem istry and m icrobiology[J].Chinese Journal of Analytical Chemistry,2013,41(8):1133-1139.
[49] Xie X,Ye M,Hsu P C,et al.M icrobial battery for efficient energy recovery[J].Proceedings of the National Academy of Sciences,2013,110(40):15925-15930.
[50] Li J,Liu G,Zhang R,et al.Electricity generation by two types of m icrobial fuel cells using nitrobenzene as the anodic or cathodic reactants[J].Bioresource Technology,2010,101(11):4013-4020.
[51] Solanki K,Subramanian S,Basu S.M icrobial fuel cells for azo dye treatment with electricity generation:A review[J].Bioresource Technology,2013,131:564-571.
[52] Zhang X,Zhu F,Chen L,et al.Removal of ammonia nitrogen from wastewater using an aerobic cathode m icrobial fuel cell[J].Bioresource Technology,2013,146:161-168.
[53] Huang L,Chai X,Quan X,et al.Reductive dechlorination and m ineralization of pentachlorophenol in biocathode m icrobial fuel cells[J].Bioresource Technology,2012,111:167-174.
[54] Li Z,Zhang X,Lei L.Electricity production during the treatment of real electroplating wastewater containing Cr6+using microbial fuel cell[J].Process Biochemistry,2008,43(12):1352-1358.
[55] Cao X,Huang X,Liang P,et al.A new method for water desalination using m icrobial desalination cells[J].Environmental Science & Technology,2009,43(18):7148-7152.
[56] Mehanna M,Kiely P D,Call D F,et al.M icrobial electrodialysis cell for simultaneous water desalination and hydrogen gas production[J].Environmental Science & Technology,2010,44(24):9578-9583.
[57] Guo K,Tang X,Du Z,et al.Hydrogen production from acetate in a cathode-on-top single-chamber m icrobial electrolysis cell w ith a m ipor cathode[J].Biochemical Engineering Journal,2010,51(1-2):48-52.
[58] Tenca A,Cusick R D,Schievano A,et al.Evaluation of low cost cathode materials for treatment of industrial and food processing wastewater using m icrobial electrolysis cells[J].International Journal of Hydrogen Energy,2013,38(4):1859-1865.
[59] Heidrich E,Dolfing J,Scott K,et al.Production of hydrogen from domestic wastewater in a pilot-scale m icrobial electrolysis cell[J].Applied Microbiology and Biotechnology,2013,97(15):6979-6989.
[60] Jia Y H,Ryu J H,Kim C H,et al.Enhancing hydrogen production efficiency in m icrobial electrolysis cell w ith membrane electrode assembly cathode[J].Journal of Industrial and Engineering Chemistry,2012,18(2):715-719.
[61] Gil-Carrera L,Escapa A,Moreno R,et al.Reduced energy consumption during low strength domestic wastewater treatment in a sem i-pilot tubular m icrobial electrolysis cell[J].J.Environ Manage,2013,122:1-7.
[62] Rozendal R A,Leone E,Keller J,et al.Efficient hydrogen peroxide generation from organic matter in a bioelectrochemical system[J].Electrochemistry Communications,2009,11(9):1752-1755.
[63] Fu L,You S J,Zhang G Q,et al.Degradation of azo dyes using in-situ fenton reaction incorporated into H2O2-producing microbial fuel cell[J].Chemical Engineering Journal,2010,160(1):164-169.
[64] Li Y,Lu A,Ding H,et al.M icrobial fuel cells using natural pyrrhotite as the cathodic heterogeneous fenton catalyst towards the degradation of biorefractory organics in landfill leachate[J].Electrochemistry Communications,2010,12(7):944-947.
[65] Zhu X,Logan B E.Using single-chamber m icrobial fuel cells as renewable power sources of electro-fenton reactors for organic pollutant treatment[J].Journal of Hazardous materials,2013,252-253:198-203.
[66] Lovley D R,Nevin K P.Electrobiocommodities:Powering m icrobial production of fuels and commodity chem icals from carbon dioxide w ith electricity[J].Current Opinion in Biotechnology,2013,24(3):385-390.
[67] Rabaey K,Girguis P,Nielsen L K.Metabolic and practical considerations on microbial electrosynthesis[J].Current Opinion in Biotechnology,2011,22(3):371-377.
[68] Köpke M,M ihalcea C,Brom ley J C,et al.Fermentative production of ethanol from carbon monoxide[J].Current Opinion in Biotechnology,2011,22(3):320-325.
[69] Köpke M,M ihalcea C,Liew F,et al.2,3-butanediol production by acetogenic bacteria,an alternative route to chem ical synthesis,using industrial waste gas[J].Appl.Environ.Microbiol.,2011,77(15):5467-5475.
[70] Villano M,Aulenta F,Ciucci C,et al.Bioelectrochem ical reduction of CO2to CH4via direct and indirect extracellular electron transfer by a hydrogenophilic methanogenic culture[J].Bioresource Technology,2010,101(9):3085-3090.
[71] Nevin K P,Hensley S A,Franks A E,et al.Electrosynthesis of organic compounds from carbon dioxide is catalyzed by a diversity of acetogenic m icroorganisms[J].Appl.Environ.Microbiol.,2011,77(9):2882-2886.
[72] Peixoto L,M in B,Martins G,et al.In situ m icrobial fuel cell-based biosensor for organic carbon[J].Bioelectrochemistry,2011,81(2):99-103.
[73] Di Lorenzo M,Curtis T P,Head I M,et al.A single-chamber microbial fuel cell as a biosensor for wastewaters[J].Water Research,2009,43(13):3145-3154.
[74] Shen Y,Wang M,Chang I S,et al.Effect of shear rate on the response of m icrobial fuel cell toxicity sensor to Cu (Ⅱ)[J].Bioresource Technology,2013,136:707-710.
[75] 杜竹玮,佟萌,李少华,等.在线测定样品中生化需氧量的装置及方法:中国,101315347[P].2007-05-29.
