磷酸肌酸钠对血管紧张素Ⅱ诱导的乳鼠心肌成纤维细胞增殖和胶原合成的影响及机制研究
2014-03-03魏子寒王颖杨国杰孙丽娜
魏子寒,王颖,杨国杰,孙丽娜
磷酸肌酸钠对血管紧张素Ⅱ诱导的乳鼠心肌成纤维细胞增殖和胶原合成的影响及机制研究
魏子寒,王颖,杨国杰,孙丽娜
目的:观察磷酸肌酸钠对血管紧张素Ⅱ(AngⅡ)诱导的乳鼠心肌成纤维细胞(CF)增殖和胶原合成的影响,并初步探索磷酸肌酸钠抗心肌纤维化的作用机制。
磷酸肌酸钠;心肌;成纤维细胞;磷酸化细胞外信号调节激酶
(Chinese Circulation Journal, 2014,29:738.)
心肌纤维化(myocardial fibrosis, MF)是多种心脏疾病发展至终末期的共同病理改变,是心室重塑的重要表现[1,2]。有研究显示[3],血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)刺激心肌成纤维细胞增殖,胶原合成,介导心肌纤维化的形成。
以往的研究显示[4,5],磷酸肌酸钠具有保护心肌、改善心功能的作用,广泛应用于冠心病、心力衰竭等疾病的治疗,但其对AngⅡ诱导的心肌成纤维细胞(cardiac fibroblasts,CF)增殖及胶原合成的影响如何,其机制如何,目前并不十分清楚。
为此,本研究采用AngⅡ建立乳鼠心肌纤维化模型,应用流式细胞技术检测细胞周期分布、VG染色检测心肌间质胶原合成及免疫细胞化学法检测心肌组织中磷酸化细胞外信号调节激酶(phosphated extracellular signal regulated kinase 1/2,pERK1/2)蛋白表达等方法,探讨磷酸肌酸钠对AngⅡ诱导的CF增殖及胶原合成的影响及机制。
1 材料与方法
动物与主要试剂 :清洁级新生Wistar乳鼠(1天)2012-07由郑州大学医学院实验动物中心提供(编号:TJLA-2003-168)[许可证:SCXX(豫)2010-0002.合格证:0008508]; 新生胎牛血清购自杭州四季青公司;DMEM培养基为美国HyClone公司产品(产地:北京)、AngⅡ、碘化丙啶(PI)、核糖核酸(RNA)酶均购自美国Sigma公司(产地:美国);胰蛋白酶购自美国Difco公司(产地:北京);Ⅱ型胶原酶购自美国Invitrogen公司(产地:美国);TritonTriton X-100购自美国Amresco公司(产地:美国);磷酸肌酸钠0.5 g/支为吉林英联生物制药股份有限公司生产;免疫细胞化学试剂盒、对氨基联苯胺(DAB)底物显色试剂盒、小鼠抗波形蛋白单克隆抗体(mAb)均购自北京中杉金桥公司;小鼠抗 p-ERK1/2 mAbAnti- p-ERK1/2 Mouse Monoclonal Antibody购自美国Cell Signaling公司(产地:美国)。其余产品均为市售分析纯。
心肌成纤维细胞的原代、传代培养:取Wistar乳鼠20只 ,在无菌条件下开胸取出心脏,取左心室,将其剪成1 mm3大小的碎块,反复冲洗,加入0.08%胰蛋白酶、0.01%Ⅱ型胶原酶消化10分钟,反复多次,直至组织块消失,分别收集每次消化悬液,离心弃上清,加入含20%胎牛血清的DMEM培养液制成细胞悬液,置于5% CO2培养箱中37℃培养。根据心肌细胞和成纤维细胞贴壁时间的不同,采用差速贴壁2小时,弃上清,获得心肌成纤维细胞。待细胞长满瓶壁后用0.25%胰酶消化传代。实验采用2~3代的成纤维细胞。
心肌成纤维细胞鉴定:CF爬片培养,至细胞连接成片后,倾去培养基。取出玻片,磷酸盐缓冲液(PBS 0.01 mol, pH 7.3,成分: Na2HPO4、KH2PO4、NaCl、KCl)冲洗,4%多聚甲醛室温固定,3%H2O2孵育,正常山羊血清封闭,滴加鼠抗波形蛋白抗体工作液(1:50),室温孵育3小时,滴加生物素化二抗工作液(北京中杉金桥) 生物素标记山羊抗小鼠白免疫球蛋G(IgG),室温孵育,滴加辣根酶标记链酶卵白素工作液,室温孵育。二氨基联苯胺(DAB)显色剂显色,自来水充分冲洗。苏木素复染,梯度酒精脱水,二甲苯透明,中性树脂封固。于倒置显微镜下观察心肌成纤维细胞呈梭形,胞体较大,细胞浆透明,细胞核较大,呈椭圆形,无自发性搏动,通常含2~3个核。细胞内出现棕黄色颗粒为阳性,细胞纯度达98%。图1
分组及处理:取原代乳鼠CF进行培养后,无血清培养基饥饿培养细胞24小时后,根据加入条件培养基不同分组(每组n=3): AngⅡ组:含AngⅡ1×10-6mol/L的无血清DMEM培养液;磷酸肌酸钠组:含磷酸肌酸钠10 mmol/L的无血清DMEM培养液; AngⅡ+磷酸肌酸钠组:含磷酸肌酸钠10 mmol/L加AngⅡ10-6mol/L的无血清DMEM培养液;对照组:无血清的DMEM培养液培养CF。

图1 心肌成纤维细胞鉴定图
流式细胞仪测定细胞周期分布[6]:取各处理组处理24 h的细胞及对照组细胞制成单细胞悬液,测定细胞不同周期(G0/G1期、S期、G2/M期)。以70%酒精固定细胞,上机前加入500 μl碘化丙啶综合染液(碘化丙啶5 mg,RNA 2 g,1% Triton 0.25 ml,生理盐水65 ml,加蒸馏水至100 ml,PH 7.2~7.6),室温染色30分钟后上机检测,重复3次。
VG染色观察胶原合成[7]:CF爬片培养,待细胞相互连接成片时,根据上述分组处理细胞24小时。倾去培养基,冲洗,经苏木素染色,冲洗。滴加VG工作液(1%酸性品红水溶液10 ml,苦味酸饱和水溶液90 m1)染色。分化、脱水、透明、封片。常规封片后,切片装在OlympusCK2型显微镜下观察并摄片,使用Biosins Digital Imaging Systems测量心肌间质胶原含量(积分光密度值)。
免疫细胞化学法检测心肌成纤维细胞中pERK1/2蛋白表达:CF爬片培养,待细胞连接成片后,各处理因素孵育细胞30分钟,倾去培养基。取出玻片, PBS冲洗,4%多聚甲醛室温固定,3%H2O2孵育,正常山羊血清封闭,滴加pERK1/2抗体工作液比例(1:200),室温孵育3小时,滴加生物素化二抗工作液生物素标记山羊抗小鼠IgG工作液,室温孵育15分钟,滴加辣根酶标记链酶卵白素工作液,室温孵育10分钟。DAB显色剂显色,充分冲洗。苏木素复染,梯度酒精脱水,二甲苯透明,中性树脂封片。切片装在OlympusCK2型显微镜下观察并摄片,采用Biosins Digital Imaging Systems软件分析。
统计学处理:采用SPSS 17.0软件进行统计分析,所有数据以均数±标准差表示,应用单因素方差分析(one-way ANOVA),以P<0.05表示差异有统计学意义。
2 结果
2.14组心肌成纤维细胞周期情况
与对照组相比,AngⅡ组中CF的S期细胞百分率明显增加, G0/G1期、G2/M期细胞百分率降低,差异具有统计学意义(P<0.01 )。磷酸肌酸钠组对CF细胞周期的影响与对照组比较,差异无统计学意义(P>0.05)。与AngⅡ组比较,AngⅡ+磷酸肌酸钠组G0/G1期、G2/M期细胞百分率升高,S期百分率降低,差异具有统计学意义(P<0.01)。详见表1
表1 四组心肌成纤维细胞周期情况(n=3,
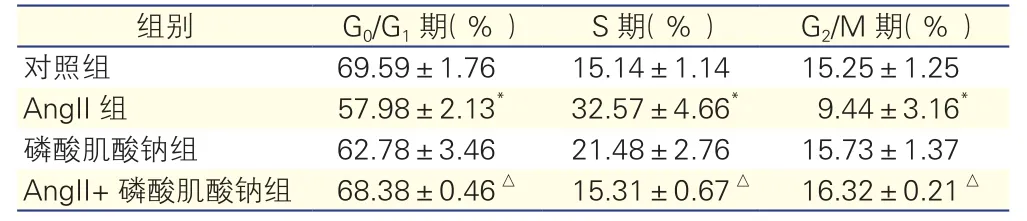
表1 四组心肌成纤维细胞周期情况(n=3,
注:与对照组比较*P<0.01;与AngII组比较△P<0.01。AngⅡ:血管紧张素Ⅱ
组别 G0/G1期(%) S期(%) G2/M期(%)对照组 69.59±1.76 15.14±1.14 15.25±1.25 AngII组 57.98±2.13* 32.57±4.66* 9.44±3.16*磷酸肌酸钠组 62.78±3.46 21.48±2.76 15.73±1.37 AngII+磷酸肌酸钠组 68.38±0.46△ 15.31±0.67△ 16.32±0.21△
2.24组胶原含量及pERK1/2蛋白表达积分光密度值情况
与对照组相比,AngⅡ组胶原含量增加,pERK1/2蛋白表达增高,差异均有统计学意义(P均<0.01 )。与对照组比较,磷酸肌酸钠组胶原含量和pERK1/2蛋白表达,差异均无统计学意义(P均>0.05)。与对照组比较,AngⅡ+磷酸肌酸钠组pERK1/2蛋白表达升高,差异有统计学意义(P<0.01 ),胶原含量差异无统计学意义(P>0.05)。与AngⅡ组比较,AngⅡ+磷酸肌酸钠组胶原含量减少,pERK1/2蛋白表达降低,差异均有统计学意义(P均<0.01)。表2,图2、3
表2 四组胶原含量及pERK1/2蛋白表达积分光密度值情况(n=3,

表2 四组胶原含量及pERK1/2蛋白表达积分光密度值情况(n=3,
注:与对照组比较*P<0.01;与AngII组比较△P<0.01。pERK1/2:磷酸化细胞外信号调节激酶。缩略语余注见表1
组别 胶原含量 PERK1/2表达对照组 120.68±4.43 115.12±7.25 AngII组 150.74±3.68* 130.53±10.15*磷酸肌酸钠组 119.32±2.76 113.43±5.83 AngII+磷酸肌酸钠组 117.71±2.61△ 120.79±4.27*△
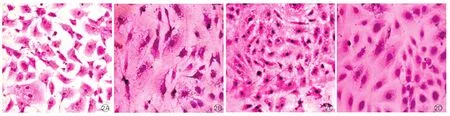
图2 四组VG染色法胶原合成图片(×200)
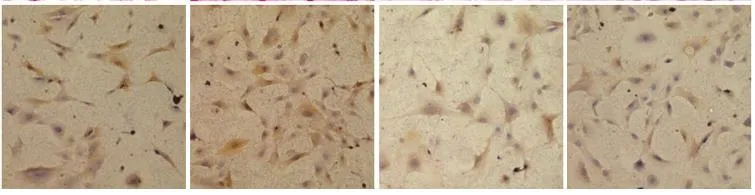
图3 四组免疫细胞化学法检测磷酸化细胞外信号调节激酶(pERK1/2)蛋白图片(×200)
3 讨论
CF是一类具有分裂潜力的细胞,病理条件下,CF在各种促纤维化的细胞因子、血管活性物质的作用下,通过多种信号通路的介导,引起CF的过度增殖,最终导致心脏间质胶原沉积、心室僵硬度增加,促进心肌纤维化的发生,进一步导致心肌顺应性降低,心脏舒缩及电传导功能障碍[1,2,8,9]。因此,有效抑制病理状态下心肌成纤维细胞的过度增殖是心肌保护的重要一环。
有研究显示[10,11],AngⅡ通过与血管紧张素Ⅱ受体(AT1R)结合,可增加其细胞内底物的酪氨酸残基磷酸化,通过酪氨酸激酶途径活化丝裂素活化蛋白激酶级联反应,促进CF的增殖及表型转化,是肾素-血管紧张素-醛固酮系统(RASS)的关键效应分子,在高血压、心肌梗死、心力衰竭过程中的心肌重构的发生、发展中发挥重要作用[12]。本研究结果显示, AngⅡ组的心肌成纤维细胞S期的百分率、心肌间质胶原含量均较对照组明显增加,证实AngⅡ可以促进心肌成纤维细胞增殖,胶原合成增加。这与以往国内外的研究结果相符[13,14],进一步证实了AngⅡ具有促进胶原的沉积,破坏细胞外基质的稳态而诱导心肌纤维化的作用。
丝裂素活化蛋白激酶(MAPK)是连接细胞外受体和细胞内靶蛋白的重要信号调节酶,是细胞内众多信号转导途径的汇聚点和共同通道[15]。已经证实[16],MAPK信号通路的过度激活与细胞的生长、增殖、分化关系密切。胞外信号调控激酶(ERK)是在哺乳动物细胞发现3种不同的MAPK之一。ERK通过相邻的丝氨酸/苏氨酸和酪氨酸残基的双磷酸化而激活。研究证实[17,18],ERK1/2通路参与调节细胞增殖、分化、转移、血管发生、凋亡等过程,在心肌纤维化发生发展过程中具有重要的作用。pERK1/2是ERK的活化形式,本研究发现,pERK1/2在AngⅡ诱导的CF中表达上调,这一结果证实了ERK1/2通路在AngⅡ诱导CF增殖及心肌间质胶原合成增多中起到重要作用。
磷酸肌酸钠是体内一种重要的高能化合物,在骨骼肌、心肌、大脑等高耗能组织中含量较高,主要功能是作为线粒体能量转运的载体并为三磷酸腺苷(ATP)补充能量维持体内ATP浓度的恒定,是人体重要的能量供应源。磷酸肌酸分子已被证实能透过细胞膜进入细胞,而且它在细胞内的扩散系数比ATP和二磷酸腺苷都大,这就为由于细胞膜破损所导致的不正常能量代谢反应“链”重新运作起来创造了条件[19,20]。当心肌细胞缺血缺氧时,补充足够的磷酸肌酸钠后,在肌酸激酶(CPK)及其同工酶的作用下,磷酸肌酸钠可将二磷酸腺苷(ADP)转化为ATP,保证Na+-K+-ATP离子泵和Ca2+泵的能量供应,为肌动蛋白-肌球蛋白丝的滑行提供能量,恢复心肌收缩力,改善心肌收缩功能。本研究结果显示,磷酸肌酸钠组单独作用时,与对照组比较CF的分布周期比例及胶原的合成无明显增多,提示无外源性因素刺激时磷酸肌酸钠不干扰CF的生长。在AngⅡ(1×10-6mol/L)过度刺激的条件下,磷酸肌酸钠能够部分抑制AngⅡ诱导的CF的增殖及胶原合成。并且该作用是通过部分抑制ERK激活引发的。目前国内外尚未有关于磷酸肌酸钠相关的信号转导通路研究,但有研究发现[21], ATP呈时间依赖性激活前列腺癌细胞中ERK1/2信号通路,从而影响肿瘤细胞的脱氧核糖核酸(DNA)合成。因此我们推测磷酸肌酸钠通过转化成ATP,继而干扰ERK通路信号级联反应,从而抑制AngⅡ诱导的CF细胞周期分布及胶原合成。在今后的工作中,我们将使用ERK阻断剂及ATP阻断剂进行干预,对磷酸肌酸钠的信号转导通路进一步研究。
综上所述,本研究初步探讨了磷酸肌酸钠对心肌纤维化的防治作用及其机制,证实磷酸肌酸钠通过作用于ERK1/2信号转导通路,部分抑制AngⅡ诱导的pERK1/2蛋白表达,抑制心肌成纤维细胞的增殖,降低胶原合成,从而改善心肌纤维化的发生。磷酸肌酸钠还可作为防治心肌纤维化的药物,本研究为磷酸肌酸钠的临床应用提供了新的领域。
[1] Porter KE, Turner NA. Cardiac fibroblasts: At the heart of myocardial remodeling. Pharmacol Ther,2009,123:255-278.
[2] 杨四宝,高永建,杨萍. 转化生长因子β与microRNAs的串话效应在心肌纤维化中的研究进展. 中国循环杂志,2013, 28:552-554.
[3] Wang LP, Wang Y. Angiotensin Ⅱ upregulates KCa3. 1 channels and stimulates cell proliferation in rat cardiac fibroblasts. Biochemical Pharmacology,2013,85: 1486.
[4] Fragasso G, Perseghin G, De Cobelli F, et al. Effects of metabolic modulation by trimetazidine on left ventricular function and phosphocreatine/adenosine triphosphate ratio in patients with heart failure. Eur Heart J, 2006, 27: 942-948.
[5] Feng NC, Satoh H, Urushida T, et al. A selective inhibitor of Na+/ Ca2+ exchanger, SEA0400, preserves cardiac function and highenergy phosphates against ischemia/reperfusion injury. Cardiovasc Pharmacol, 2006,47: 263-270.
[6] 崔巍, 李玉琳, 吴依娜. 高内涵筛选与流式细胞分析技术在心肌成纤维细胞增殖研究中的应用. 生理学报,2014,66:215-222.
[7] Sun L,Zheng Z. Effect of Salvia Miltiorrhiza Bge on Left Ventricular Hypertrophy and the Expression of Tumor Necrosis Factor-α in Spontaneously Hypertensive Rats. Journal of Huazhong University of Science and Technology, 2007,27: 245-247.
[8] Stein M, Noorman M, van Veen TA, et al. Dominant arrhythmia Vulnerability of the right ventricle in senescent mice. Heart Rhythm, 2008, 5: 438-448.
[9] Zannad F, Radauceanu A. Effect of mr blockade on collagen formation and cardiovascular disease with a specific emphasis on heart failure. Heart Fail Rev, 2005, 10: 71-78.
[10] Mehta PK, Griendling KK. Angiotensin Ⅱ cell signaling: physiological and pathological effects in the cardiovascular system. Physiol Cell Physiol,2007,292: C82-97.
[11] 唐兵,何国详,李德,等. 血管紧张素II2型受体介导抑制大鼠颈动脉新生内膜增生的机制. 中国循环杂志,2006, 21:148-151.
[12] Stein M, Boulaksil M, Jansen JA, et al. Reduction of fibrosis-related arrhythmias by chronic renin-angiotensin-aldosterone system inhibitors in an aged mouse model. Am J Physiol Heart Circ Physiol, 2010, 299: H310-321.
[13] Zhang W, Chen XF, Huang YJ, et al. 2, 3, 4, 5-Tetrahydroxystilbene-2-O-b-d-glucoside inhibits angiotensin Ⅱ -induced cardiac fibroblast proliferation via suppression of the reactive oxygen species-extracellular signal-regulated kinase 1/2 pathway. Clin Exp Pharmacol Physiol,2012,39: 429.
[14] Olson ER, Shamhart PE, Naugle JE, et al. Angiotensin Ⅱ -induced extracellular signal-regulated kinase 1/2 activation is mediated by protein kinase C delta and intracellular calcium in adult rat cardiac fibroblasts. Hypertension,2008,51: 704.
[15] Morley JE, Kaiser FE, Perry HM, et al. Longitudinal changes in testosterone, luteinizing hormone, and follicle-stimulating hormone in healthy older men. Metabolism1,1997,46: 410.
[16] Schilling M, Maiwald T, Hengl S, et al. Theoretical and experimental analysis links isoform- specific ERK1/2 signalling to cell fate decisions. Mol Syst Biol, 2009,5: 334.
[17] Yeh CC, Li HZ, Malhotra D, et al. Distinctive ERK1/2 and p38 Signaling in Remote and Infarcted Myocardium During Post-MI Remodeling in the Mouse. Cell Biochem,2010, 109: 1185-1191.
[18] Zhang J, Bian HJ, Li XX, et al. ERK1/2-MAPK Signaling Opposes Rho-Kinase to Reduce Cardiomyocyte Apoptosis in Heart Ischemic Preconditioning. Mol Med,2010, 16: 307-315.
[19] Nakae I,Mitsunami K,Omura T,et a1. Proton magnetic resonance spectroscopy can detect creatine depletion asso-ciated with the progression of heart failure in cardiomyopa-thy. Am Coll Cardiol,2003,42: 1587-1593.
[20] 郭晓纲,吕新圆,程卫平,等. 磷酸肌酸对体外循环冠状动脉旁路移植术患者心肌保护和血流动力学的影响. 中国循环杂志,2006, 21:461-464.
[21] 贺慧颖,方伟岗,郑杰,等. 丝裂原活化蛋白激酶磷酸酶5调节人前列腺癌细胞生长及侵袭的信号转导机制研究. 中华医学杂志,2003,20:1812-1817.
Effect of Phosphocreatine on Angiotensin II Induced Proliferation and Collagen Synthesis of Cardiac Fibroblasts in Neonatal Rats With its Mechanism
WEI Zi-han, WANG Ying, YANG Guo-jie, Sun Li-na.
Department of Geriatrics Cardiology, First Aff i liated Hospital of Zhengzhou University, Zhengzhou (450052), Henan, China
WANG Ying, Email: 2414714561@qq.com
Objective: To investigate the effect of phosphocreatine (PCr) on angiotensin II (Ang II) induced proliferation and collagen synthesis of cardiac fi broblasts in neonatal rats with its mechanism.Methods: The cardiac fi broblasts (CF) from neonatal rats were cultured in vitro and were divided into 4 groups.①Control group, the CF was cultured in non-serum DMEM, ②Ang II group, the CF was cultured with Ang II at (1×10-6) mol/L, ③PCr treated group, the CF was cultured with PCr at 10 mmol/L, and ④Ang II + PCr group. The CF cell cycle percentage was detected by fl ow cytometric assay, myocardial collagen content was observed by VG staining and protein expression of phosphorylated extracellular signal-regulated kinase (pERK1/2) was detected by immuneohistochemistry.Results: ① Compared with Control group, the CF in Ang II group showed increased percentage of S phase and decreased percentage of G0/G1and G2/M phases, increased collagen content and pERK1/2 protein expression, all P<0.01.② The CF cell cycle, collagen content and pERK1/2 protein expression were similar between Control group and PCr treated group, all P>0.05. ③ Compared with Control group, Ang II + PCr group had elevated pERK1/2 protein expression, P<0.01, while the CF cell cycle and collagen content were similar with Control group, P>0.05. ④Compared with Ang II group, the CF in Ang II + PCr group had increased percentage of G0/G1and G2/M phases, decreased percentage of S phase, decreased collagen content and pERK1/2 protein expression, all P<0.01.Conclusion: PCr may partially inhibit Ang II induced CF proliferation and collagen synthesis which might be related to the inhibition of excessively activated ERK1/2. Therefore, PCr could improve Ang II induced myocardial fi brosis in neonatal rats.
Phosphocreatine; Myocardium; Fibroblasts; Phosphorylated extracellular signal-regulated kinase
2014-04-21)
(编辑:王宝茹)
450052 河南省郑州市,郑州大学第一附属医院 老年心血管科
魏子寒 主治医师 硕士 主要从事心血管内科的临床及科研工作 Email: weizihan1985@163.com 通讯作者:王颖 Email: 2414714561@qq.com
R54
A
1000-3614(2014)09-0738-05
10.3969/j.issn.1000-3614.2014.09.020
方法:将20只Wistar乳鼠取出心脏,体外原代、传代培养CF。实验分4组(每组n=3),对照组:无血清的DMEM培养液培养CF; AngⅡ组:含 AngⅡ 1×10-6mol/L的无血清DMEM培养液;磷酸肌酸钠组:含磷酸肌酸钠10 mmol/L的无血清DMEM培养液;AngⅡ+磷酸肌酸钠组:含磷酸肌酸钠10 mmol/L 加AngⅡ 1×10-6mol/L的无血清DMEM培养液。采用流式细胞术测定细胞周期分布,Van Gieson(VG)氏染色法测定胶原含量,免疫细胞化学法检测磷酸化细胞外信号调节激酶(pERK1/2)蛋白的表达水平。
结果:与对照组相比,AngⅡ组CF的S期细胞百分率明显增加, G0/G1期、G2/M期细胞百分率降低,胶原含量增加,pERK1/2蛋白表达增高,差异均有统计学意义(P均<0.01 )。与对照组比较,磷酸肌酸钠组CF细胞周期、胶原含量和pERK1/2蛋白表达,差异均无统计学意义(P均>0.05)。与对照组比较,AngⅡ+磷酸肌酸钠组pERK1/2蛋白表达升高,差异有统计学意义(P<0.01 ),CF细胞周期和胶原含量差异均无统计学意义(P均>0.05)。与AngⅡ组比较,AngⅡ+磷酸肌酸钠组G0/G1期、G2/M期细胞百分率升高,S期百分率降低,胶原含量减少,pERK1/2蛋白表达降低,差异均有统计学意义(P均<0.01)。
结论:磷酸肌酸钠可部分抑制AngⅡ诱导的CF增殖和胶原合成增加,其机制可能与抑制ERK1/2过度激活有关。这提示磷酸肌酸钠可以明显改善AngⅡ诱导的心肌纤维化。
