运动预处理对压力超负荷诱导的大鼠病理性心肌肥厚的影响*
2014-03-03徐同毅韩庆奇张本龚德军袁扬蔡成良丁云邹良建
徐同毅,韩庆奇,张本,龚德军,袁扬,蔡成良,丁云,邹良建
运动预处理对压力超负荷诱导的大鼠病理性心肌肥厚的影响*
徐同毅,韩庆奇**,张本,龚德军,袁扬,蔡成良,丁云,邹良建
目的:探究运动预处理(EP)对压力超负荷引起的大鼠病理性心肌肥厚和心力衰竭(心衰)的影响。
运动预处理;压力超负荷;病理性心肌肥厚;主动脉缩窄
(Chinese Circulation Journal, 2014,29:728.)
1999年,Yamashita等[1]正式提出了运动预处理(EP)概念。EP是通过运动诱导机体产生内源性的自身保护,从而提高心脏耐受缺血缺氧能力的现象。其本质就是通过一定的应激手段,诱导机体产生内源性的自身保护,提高机体耐受缺血缺氧的能力,从而更好的适应诸如缺血再灌注损伤、压力超负荷等不良应激的刺激,保护心功能,是缺血预处理的一种特殊形式。
病理性心肌肥厚早期阶段,心肌细胞体积增大、新肌小节蛋白形成,心功能代偿性增强,但是到了晚期,心脏纤维化程度增加、心肌细胞坏死或凋亡,心功能将失代偿,最终转化为心力衰竭(心衰)。现有研究已经公认病理性心肌肥厚是心衰的前期病变,是心衰、脑卒中、冠心病、猝死等的独立危险因素[2]。心肌肥厚发生机制等相关研究的正确评价有赖于动物实验, 压力超负荷法建立病理性心肌肥厚的模型是最常见的,而主动脉缩窄(TAC)法是目前应用最广泛的建立压力超负荷诱导病理性心肌肥厚动物模型的方法[3]。
EP是否对压力超负荷引起的病理性心肌肥厚有保护作用目前研究尚少,本研究通过EP后进行TAC手术来建立心肌肥厚的模型,与TAC建立的病理性心肌肥厚模型对比,用组织形态学、超声心动图、分子标志物对模型进行全面评估,确定EP对压力超负荷引起的病理性心肌肥厚的影响。
1 材料与方法
1.1实验动物
2013-02至2013-08在第二军医大学附属长海医院胸心外科实验中心完成实验。健康雄性6 周龄SPF级SD大鼠60只,体重120~140 g,购自上海西普尔—必凯实验动物有限公司,生产许可证号:SCXK(沪)2008-0016。饲养于上海第二军医大学实验动物中心,使用许可证号:SYXK(沪)2012-0003,SPF级条件饲养,繁育饲料购于上海仕林生物科技有限公司。本研究全部内容通过第二军医大学附属长海医院科学研究伦理委员会认证,所有操作均遵循国家实验动物管理条例及国家实验动物管理实施细则。
1.2实验动物模型的建立
将实验动物随机分为三组,每组20只,分别是假手术组(Sham组)、主动脉缩窄组(TAC组)和运动预处理+主动脉缩窄组(EP+TAC组),在完全相同的环境中饲养,可以自由的获取水和食物。
建立TAC组诱导病理性心肌肥厚对照模型:将20只10 周龄正常SD大鼠与上述跑台EP完成后的大鼠同时进行TAC手术,手术方法同上。后装笼饲养。
建立Sham组模型:将20只10 周龄正常SD大鼠按照TAC手术步骤,但不结扎胸主动脉。
1.3心功能评价方法及观察指标
上述各实验模型组分别在术后4周(n=10)和8周(n=10)时用戊巴比妥(80 mg/kg)麻醉后行超声心动图(加拿大VisualSonics Vevo770超声及17.5 MHz超声探头)检查。各组动物胸部备皮,获得M型超声心动图像,每只大鼠在每个切面上检测两次,每次读取连续5个心动周期的数值,取平均值用于统计。所有测量均由两位超声医师双盲法操作,取两者均值。
1.4标本采集与处理
颈椎离断法处死大鼠,称量体重,电子天平称取心脏重量,室间隔、左心室游离壁作为左心室重量,用电子天平称量左心室重量,并称取双肺脏重量以及测量胫骨长度,计算心脏重量指数、左心室重量指数、肺脏重量指数和左心室重量/胫骨长度。用于心衰标志物心钠肽和脑钠肽蛋白检测的心肌组织立即置于液氮中保存。余心肌组织用10%甲醛液固定,制片后用于用苏木素伊红(HE)染色。
1.5实时定量聚合酶链式反应检测
2014年,为深化转型升级,公司在东莞桥头镇建设了力嘉环保包装印刷产业园,该项目于2014年被东莞市委、市政府列入重大项目,项目分两期开发建设,一期园区占地面积160亩,投资规模达6.8亿元,已成功打造10万平方米的自动化环保生产基地,目前已吸引超30家印刷包装上下游企业入驻。此外,公司还精心打造了包装印刷博物馆、苹果树创客空间、包装设计展厅、多功能会议厅、嘉湖观休闲区等包装印刷公共配套,并陆续把园区的配套设施共享给行业协会,实现资源共享。
取大鼠左心室心肌组织经Trizol(Invitrogen)提取总核糖核酸(RNA),取1.0 pg 总 RNA经PrimeSeript RT master mix perfect real-time(TaKaRa)逆转录为互补脱氧核糖核酸(cDNA),根据SYBR Premix Ex TaqTM试剂盒操作,在ABI StepOne Real-Time 聚合酶链式反应 System (Applied Biosystems)进行聚合酶链式反应,以GAPDH为内参,检测心肌肥厚相关分子标志物表达。各个基因的引物(上海生工)如下:心钠肽:上游:5'- AGAGAGTGAGCCGAGACAGC-3', 下游:5'-TGGACACCGCACTGTATACG-3'; 脑钠肽:上游:5'-CCGGATCCAGGAGAGACTTC-3',下游:5'-TCTGCAGCCAGGAGGTCTTC-3';GAPDH上 游:5'- GCCATCACTGCCACTCAGAA-3',下游:5'-GGCATGTCAGATCCACAACG-3'。
1.6蛋白质印迹法检测
根据以前描述的方法进行大鼠左心室总蛋白的提取[7,8],按100 mg样品加1 ml组织裂解液的比例加入裂解液提取大鼠左心室心肌组织蛋白。配制12% SDS-PAGE分离胶和5%积层胶,每孔加入40 µg蛋白样品,置电泳缓冲液中,80 V电泳约30 min,待样品进入分离胶后,110 V电泳至所需时间。将蛋白转印至PVDF膜,用5%脱脂奶粉于室温封闭1 h,分别加一抗[ANP抗体(sc-18811,美国Santa Cruz公司)(1:200),脑钠肽抗体(ab-19645,英国abcam公司)(1:1000)]。4℃孵育过夜,次日TBST清洗液[10×TBS液(Tris:12.1 g,NaCl :40 g,蒸馏水至500 ml ,浓盐酸调pH值至7.6) 100 ml,蒸馏水 900 ml,Tween-20 1 ml]洗膜3次,每次5 min,再加相应二抗室温孵育1 h,发光剂孵育6 min,曝光、显影、定影,结果用Image J凝胶图像分析系统对条带进行分析,实验重复6次。
1.7统计学方法
应用SPSS 18.0统计软件进行数据处理。计量数据用均数±标准差表示。两组间计量资料采用双因素方差分析和LSD检验。P<0.05为差异具有统计学意义。
2 结果
2.1各组心脏超声和病理结果比较
术后4 周时,与Sham组相比,TAC组和EP+TAC组的心率和左心室壁厚度已经开始升高,差异有统计学意义(P<0.05),但其后两手术组间比较差异无统计学意义。术后8 周时,与Sham组相比,TAC组和EP+TAC组的观察指标明显增加,差异有统计学意义(P<0.01)。进一步比较发现, EP+TAC组的心率、左心室前壁收缩末期厚度和左心室后壁收缩末期厚度与TAC组相比分别低17%、12%和12%(P均<0.05),左心室射血分数增加15%,差异均有统计学意义(P均<0.05)。图1

图1 三组大鼠心肌肥厚模型的超声心动图结果分析
术后8 周时,与Sham组相比,TAC组和EP+TAC组的心脏重量指数、左心室重量指数、左心室重量/胫骨长度和肺脏重量指数差异均有统计学意义(P均<0.01),而术后4周时与Sham组相比,差异不明显,且TAC组和EP+TAC组两手术组间比较无明显差异。术后8周时,EP+TAC组与TAC组相比上述指标分别低15.7%、20.0%、22.6%和17.8%,差异均有统计学意义(P<0.05)。图2

图2 三组大鼠心肌肥厚模型的病理结果分析
2.2病理组织形态学观察结果
病理组织切片HE染色观察发现:Sham组心肌纤维排列正常,EP+TAC组比TAC组表现为心肌细胞胞浆变宽,细胞核变大,在相同倍数单位面积细胞数减少,但心肌细胞排列整齐、着色均匀,心肌细胞间连接紧密。图3
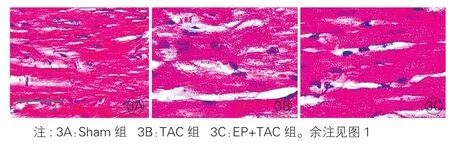
图3 主动脉缩窄术后8 周三组大鼠心肌肥厚模型心肌细胞苏木素伊红染色比较 (×400)
2.3实时定量聚合酶链式反应检测结果
在术后4 周时,与Sham组比较,TAC组的心钠肽和脑钠肽的mRNA表达量分别增加1.07倍和2.75倍(P均<0.05),而EP+TAC组未见明显变化,与TAC组相比,EP+TAC组的上述指标分别低47%和62%(P<0.05)。术后8 周时,与Sham组比较,TAC组和EP+TAC组的指标均增加明显,且比术后4周时增加明显,但其后两手术组间比较,心钠肽和脑钠肽的mRNA表达量变化较术后4周时减小,EP+TAC组分别低44.0%和28.1%。图4

图4 三组大鼠心肌肥厚模型心钠肽和脑钠肽mRNA相对表达量分析
2.4心钠肽和脑钠肽蛋白的表达量分析
蛋白质印迹法结果显示,与Sham组相比,TAC组在4 周和8周时心钠肽和脑钠肽蛋白表达量明显升高(P<0.01),EP+TAC组的变化在术后4周时不明显,但术后8周时也明显升高(P<0.05)。而且,与TAC组相比,EP+TAC组的蛋白表达量分别低42.3%、48.0%(术后4周)和21.5%、38.3%(术后8周),差异均有统计学意义(P<0.05)。图5
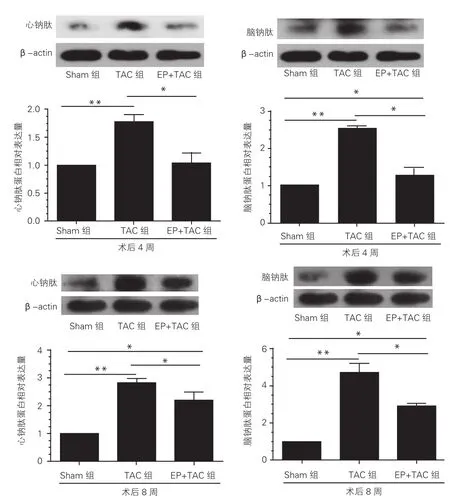
图5 三组大鼠心肌肥厚模型心钠肽和脑钠肽蛋白相对表达量分析
3 讨论
我们第一次将EP应用于病理性心肌肥厚的保护,而且我们发现EP能够延缓病理性心肌肥厚发展为心衰的进程。目前EP对心肌缺血再灌注损伤的研究较多,其通过缩小心肌梗死面积,降低心律失常的发生率,减少心肌细胞凋亡的发生和改善心功能而减轻缺血再灌注损伤。中等强度有氧运动的实验动物模型是了解心肌缺血再灌注损伤心肌保护作用的细胞机制一个重要途径[9]。
根据超声和病理结果发现,与Sham组相比,在两个时间点,所测的指标均出现不同程度的变化,特别是在术后8周时差异比较明显,说明两个手术模型建立成功。在TAC组和EP+TAC组之间比较,在术后4周时变化不是很明显,而在术后8周时差异显著,考虑原因为在术后4周时两组大鼠的心功能均处于代偿期,心功能变化不明显,但是到了术后8周时,TAC组进入了失代偿期,心功能变化明显,而EP+TAC组在EP的保护下心衰的进程延缓。
利钠肽家族包括:心钠肽、脑钠肽、C型钠尿肽、肾利钠肽及树眼镜蛇属利钠肽[10]。心钠肽和脑钠肽作为心衰标志物,已经越来越多地应用于心衰的诊断、鉴别诊断、危险度分层、预后判定及治疗指导[11-13]。利钠肽家族在血压调节、平衡体液及维护心血管功能等方面起重要作用,心脏负荷过大、机械牵引、心肌损伤、心室壁张力过大等刺激,均可促使其的合成与释放[14-18]。本研究中从心钠肽和脑钠肽相对mRNA和蛋白表达量检测来看,与Sham组比较,TAC组在两个时间点表达量均明显升高,但是EP+TAC组的变化在术后4周时不明显,而且与TAC组相比,两个时间点相对mRNA和蛋白表达量均出现下降,并且在术后8周时两个标志物的表达量变化较术后4周时减小,这提示EP在病理性心肌肥厚早期的保护作用是明显的,随着时间的推移,保护作用逐渐减弱,不能最终阻止进入失代偿期的结局。本研究能为进一步研究EP对病理性心肌肥厚的作用机制提供基础。
本实验EP是根据Bedford标准进行中等量负荷运动,尽量避免出现运动量过大造成心脏一些不可逆的病理变化,加快TAC后心功能的衰竭。曾报道心衰患者运动后出现舒张末期左心室内径扩大,导致病理性扩张型心肌病的发生可能[19]。因此采用什么样的运动方式、运动强度和运动时间才能诱发最佳的预适应效果都是以后研究的方向。
本研究已经证实EP对压力超负荷诱导的大鼠病理性心肌肥厚有保护作用,为进一步研究EP的作用机制提供可靠的动物模型,我们相信随着对EP的不断深入研究和认识,将更有助于对运动保护心功能的研究,为科学制定心血管疾病的预防和康复提供新的思路。
[1] Yamashita N, Hoshida S, Otus K, et al. Execise provides direct biphasic cardioprotection via manganese superoxide dismutase activation.J Exp Mde, 1999, 189: 1699-1706.
[2] Hughes SE. The pathology of hypertrophic cardiomyopathy. Histopathology, 2004, 44: 412.
[3] Berry JM, Naseem RH, Beverly A, et al. Models of cardiac hypertrophy and transition to heart failure. Drug Diseovery Today: Disease Models, 2007, 4: 197-206.
[4] Beadford TG, Tipton CM, Wilson NC, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures.J Appl Physiol, 1979, 47: 1278-1283.
[5] deAlmeida AC, van Oort RJ, Wehrens XH. Transverse aortic constriction in mice. J Vis Exp, 2010, 38: 1729.
[6] Wu Y, Yin X, Wijaya C, et al. Acute myocardial infarction in rats. J Vis Exp, 2011, 48: 2464.
[7] Bhuiyan MS, Shioda N, Fukunaga K. Ovariectomy augments pressure overload-induced hypertrophy associated with changes in Akt and nitric oxide synthase signaling pathways in female rats. Am J Physiol Endocrinol Metab, 2007, 293: E1606-E1614.
[8] Bhuiyan MS, Shioda N, Shibuya M, et al. Activationof endothelial nitric oxide synthase by a vanadium compoundameliorates pressure overload-induced cardiac injury in ovariectomizedrats. Hypertension, 2009, 53: 57-63.
[9] Quindry JC, Hamilton KL. Exercise and cardiac preconditioning against ischemia reperfusion injury. Curr Cardiol Rev, 2013 , 9: 220-229.
[10] Del Ry S, Cabiati M, Martino A, et al. High concentration of C-type natriuretic peptide promotes VEGF-dependent vasculogenesis in the remodeled region of infarcted swine heart with preserved left ventricular ejection fraction. Int J Cardiol, 2013, 168: 2426-2434.
[11] 杨跃进. 应加强B型利钠肽在心力衰竭临床诊治中的应用研究.中国循环杂志, 2006, 21: 161-162.
[12] 木胡牙提, 邓勤, 马依彤, 等. 慢性心力衰竭患者B型利钠肽与尿酸的变化及意义. 中国循环杂志, 2009, 24: 267-269.
[13] 赵雪燕, 杨跃进, 倪新海, 等. 左心衰竭患者B型利钠肽与心功能指标的相关性分析. 中国循环杂志, 2006, 21: 168-171.
[14] Richards AM. Brain natriuretic peptide-guided management of chronic heart failure: first do no harm. Eur J Heart Fail, 2013, 15: 832-834.
[15] Eurlings LW, van Pol PE, Kok WE, et al. Management of chronic heart failure guided by individual N-terminal pro-B-type natriuretic peptide targets: results of the PRIMA (Can PRo-brain-natriuretic peptide guided therapy of chronic heart failure IMprove heart fAilure morbidity and mortality?) study. J Am Coll Cardiol, 2010, 56: 2090-2100.
[16] Hunt SA, Abraham WT, Chin MH, et al. 2009 focused update incorporated into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines: developed in collaboration with the International Society for Heart and Lung Transplantation. Circulation, 2009, 119: e391-479.
[17] Richards AM. The natriuretic peptides in heart failure. Basic Res Cardiol, 2004, 99: 94-100.
[18] Iqbal N, Alim KS, Aramin H, et al. Novel biomarkers for heart failure. Expert Rev Cardiovasc Ther, 2013, 11: 1155-1169.
[19] Maron BJ, Pelliccia A. The heart of trained athletes: cardiac remodeling and the risks of sports, including sudden death. Circulation, 2006, 114: 1633-1644.
Exercise Preconditioning Improving the Pathological Cardiac Hypertrophy in Pressure Over-loaded Rats
XU Tong-yi, HAN Qing-qi, ZHANG Ben, GONG De-jun, YUAN Yang, CAI Cheng-liang, DING Yun, ZOU Liang-jian.
Department of Cardiothoracic Surgery, Changhai Hospital, Second Military Medical University, Shanghai (200433), China
ZOU Liang-jian, Email: zouliangjiansh@gmail.com
Objective: To explore the effect of exercise preconditioning (EP) on pathological cardiac hypertrophy and heart failure (HF) in pressure over-loaded experimental rats.Methods: A total of 60 SD rats at the age of 6 weeks were randomly divided into 3 groups, n=20 in each group. Sham-operation group, Transverse aortic constriction (TAC) group and EP + TAC group. The cardiac function and structure were evaluated by echocardiography, patholgical changes and HF biomarkers were examined for EP effect at 4 and 8 weeks after TAC.Results: Compared with Sham-operation group, the cardiac function and structure had obvious changes in the other 2 groups. Compared with TAC group, the ejection fraction in EP + TAC group increased 15%, the heart weight index and left ventricular weight index decrease 15.7% and 20% respectively at 8 weeks after TAC, all P<0.05. Compared with Sham-operation group, the mRNA and protein expressions of ANP and BNP increased in TAC group at 4 and 8 weeks after TAC, increased in EP + TAC group at 8 week after TAC. Compared with TAC group, the mRNA expressions of ANP and BNP in EP + TAC group decreased 47% and 62% at 4 weeks after TAC, decreased 44% and 28.1% at 8 weeks afterTAC, all P<0.05; the protein expression of ANP and BNP in EP + TAC group decreased 22.3% and 48% at 4 weeks after TAC, decreased 21.5% and 38.3% at 8 weeks after TAC, all P<0.01.Conclusion: EP may improve cardiac pathological hypertrophy in pressure over-loaded rats at the early stage, and delay the heart failure process.
Exercise preconditioning; Pressure over-load; Pathological cardiac hypertrophy; Transverse aortic constriction
2014-01-14)
(编辑:漆利萍)
上海市卫生局科研基金(20124361)
200433 上海市,第二军医大学长海医院 胸心外科(徐同毅、韩庆奇、张本、龚德军、袁扬、蔡成良、丁云、邹良建);解放军第401医院 胸心外科(徐同毅)
徐同毅 主治医师 博士研究生 主要从事胸心外科的临床和基础研究 Email: tonyi_xu@163.com 通讯作者:邹良建
Email: zouliangjiansh@gmail.com**为共同第一作者
R541
A
1000-3614(2014)09-0728-05
10.3969/j.issn.1000-3614.2014.09.018
方法:雄性6周龄SPF级SD大鼠60只分为Sham组、主动脉缩窄(TAC)组和运动预处理+主动脉缩窄(EP+TAC)组,每组20只。分别在TAC术后4 周和8周时行超声心功能评价、病理检查以及心衰标志物检测来探讨EP的作用。
结果:超声心动图和病理检测提示两个手术组的检测指标相比Sham组均有明显变化,而且两手术组间比较,EP+TAC组的各项指标均优于TAC组,特别是在术后8周时,左心室射血分数增加15%,心脏重量指数减少15.7%和左心室重量指数减少20%(P<0.05),差异有统计学意义。从心衰标志物心钠肽和脑钠肽信使核糖核酸(mRNA)和蛋白表达来看,与Sham组比较,TAC组在两个时间点表达量均明显升高,EP+TAC组的变化在TAC术后4 周时不明显,但在术后8周时升高明显。与TAC组相比,EP+TAC组的mRNA表达量在术后4周时分别下降47%和62%,术后8周时减少44.0%和28.1%(P<0.05);蛋白表达量术后4周时下降42.3%和48.0%,术后8周时下降21.5%、38.3%(P<0.01),在术后8周时两手术组心衰标志物表达量差异较术后4周时减小。
结论:EP能改善压力超负荷诱导大鼠病理性心肌肥厚,且在早期的保护作用明显,能够延缓心衰的进程,为进一步探究作用机制提供模型基础。
