Apelin对血管紧张素Ⅱ诱导的心肌细胞肥大的作用及其机制
2014-03-03周颖陈游洲乔树宾
周颖,陈游洲,乔树宾
Apelin对血管紧张素Ⅱ诱导的心肌细胞肥大的作用及其机制
周颖,陈游洲,乔树宾
目的:探讨Apelin对血管紧张素Ⅱ(AngⅡ) 诱导的心肌细胞肥大的作用及其细胞内信号转导机制。
血管紧张素Ⅱ;心肌细胞肥大;钙调神经磷酸酶;钙调蛋白依赖的蛋白激酶Ⅱ
(Chinese Circulation Journal, 2014,29:733.)
心肌肥厚是各种心脏疾病的重要表现之一。引起心肌肥厚的因素很多,包括神经体液因素、应力负荷等[1,2]。肾素-血管紧张素系统(RAS)中的血管紧张素Ⅱ(AngⅡ)通过不同的信号转导途径诱导心肌肥厚[3]。在钙依赖的信号通路中,AngⅡ通过延长动作电位, 使心肌细胞内Ca2+水平升高,激活钙调神经磷酸酶(Calcineurin)和钙调蛋白激酶Ⅱ(CaMKⅡ)[4],促进心肌肥厚的发展。
1993年,发现了一个结构与血管紧张素Ⅱ1型受体(AT1R)相似的蛋白,命名为血管紧张素1型受体相关蛋白(APJ)[5],1998年从牛胃分泌物中提取了APJ内源性配体,命名为Apelin[6]。Apelin与AngⅡ具有同源性,APJ与AT1R在疏水跨膜区也有40%~50%的同源性,是RAS的新成员[7]。研究表明,Apelin与AngⅡ在体内,尤其在心血管系统影响着若干相同的生物过程,例如Apelin扩张血管,降低血压;在慢性心室压力超负荷所致的心肌肥厚模型中,Apelin mRNA明显减少,而AngⅡmRNA明显增加[8,9];机械牵拉是引起心肌肥厚的因素之一,牵拉心肌细胞12 h或24 h后,心肌细胞的Apelin和APJ mRNA水平也显著减少,与AngⅡ正好相反[10]。说明Apelin可能在心肌肥厚的发生发展过程中起到与AngⅡ相反的作用。
本实验以AngⅡ诱导SD大鼠乳鼠原代心肌细胞肥大,采用不同浓度Apelin进行干预,观察Apelin能否拮抗AngⅡ诱导的心肌细胞肥大,并且进一步探讨其细胞内信号转导机制。
1 材料与方法
试验材料:实验动物:1~3 d 的SD乳鼠1只(维通利华实验动物有限公司,中国)。试剂:Apelin-13(Sigma公司,美国),Ang Ⅱ(Sigma公司,美国),DMEM培养基(Gibco公司,美国),胰蛋白酶(Sigma公司,美国),胶原酶Ⅱ(Invitrogen公司,美国),无钙镁PBS,胎牛血清(Gibco公司,美国),5-溴脱氧尿嘧啶核苷(Brdu)、青霉素、链霉素、乙醇、鼠抗横纹肌肌动蛋白单克隆抗体(Sigma-Aldrich公司,美国),[3H]-亮氨酸、闪烁液、闪烁瓶(Perkin Elmer公司,美国),心肌细胞裂解液、苯甲基磺酰氟(PMSF)、BCA蛋白浓度测定试剂盒(增强型)(碧云天生物技术研究所,江苏,中国),一抗B型脑钠肽(BNP)抗体、CaMKⅡ 抗体、p-CaMK Ⅱ抗体(Santa Cruz公司,美国)、β-肌球蛋白重链(β-MHC)(Abacam and Alpha公司,美国)、Calcineurin抗体、p-Calcineurin抗体、活化T细胞的核因子3(NFATc3)抗体(BD公司,美国)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体、β-actin抗体(全式金生物技术公司,中国),二抗(兔抗鼠IgG)(Invitrogen公司,美国)、Superscript Ⅱ逆转录酶 (Invitrogen公司,美国),SYBR Green Realtime PCR Master Mix(TaKaRa公司,日本)。仪器:CO2培养箱(SANYO 17-AC,日本),倒置相差显微镜(Olympus BHl,日本),超净工作台(苏州安泰空气技术有限公司,中国),荧光显微镜,酶标仪,高速低温离心机,RT-PCR仪,液体闪烁仪(Tri-Carb 2900TR,美国)。
试验方法:心肌细胞培养:取1~3 d SD乳鼠心室肌,用0.1%胰蛋白酶加0.04%胶原酶Ⅱ消化,差速贴壁1.5 h,将未贴壁的心肌细胞用含10%胎牛血清及青霉素、链霉素DMEM培养液稀释成1×108/L,并加入0.1 mmol/L Brdu抑制非心肌细胞增殖,接种于6孔培养板,置于37℃、5%CO2培养箱中培养24 h。换用普通培养基再培养24 h。倒置相差显微镜镜下观察,24 h后90%的细胞都自发性搏动,频率一致,约200次/分。
肌动蛋白单克隆抗体的免疫组化染色:将原代心肌细胞放入预先放置有载玻片的培养皿中培养48 h后,取出载玻片,采用肌动蛋白单克隆抗体进行免疫组化染色,90%以上的细胞呈阳性染色,则继续以下实验。
实验分组:SD乳鼠的心肌细胞换无血清培养液,培养24 h。Apelin及AngⅡ均由无菌过滤器过滤除菌后加入心肌细胞。实验分组如下:①对照组:正常心肌细胞不加任何干预因素;② Apelin组:正常心肌细胞分别给予Apelin-13 10 nmol/L(10 nM亚组)、100 nmol/L(100 nM亚组)和1000 nmol/L(1000 nM亚组);③AngⅡ组:心肌细胞给予AngⅡ 100 nmol/L,刺激心肌细胞肥大;④AngⅡ+Apelin组:心肌细胞给予AngⅡ 100 nmol/L,同时再分别给予Apelin-13 10 nmol/L[AngⅡ+A(10 nM)亚组]、100 nmol/L [AngⅡ+A(100 nM)亚组]和1000 nmol/ L[AngⅡ+Apelin(1000 nM)亚组]。每天加药1次,每2天换液1次。
观测指标:心肌细胞表面积测定:加药后72 h,每孔随机选择5个视野摄片,每个视野再任取15个细胞,用美国Image-Proplus专业图像分析软件测定细胞表面积,取其平均值。
心肌细胞蛋白合成速率测定:心肌细胞加入各种干预因素和18.3 kBq[3H]-亮氨酸继续培养72 h。弃培养液,用磷酸缓冲盐溶液(PBS)冲洗3遍,用0.1%胰蛋白酶消化后收集细胞于玻璃纤维素膜上,用10%三氯乙酸固定,滤膜烘干后用液体闪烁仪测定掺入量。
心肌细胞蛋白的提取和总蛋白含量的测定:各组心肌细胞培养72 h后,终止细胞培养,用冰PBS收集贴壁心肌细胞,加入心肌细胞裂解液50 μl和苯甲基磺酰氟(PMSF)1 μl,冰上裂解30 min。4 000 g离心15 min,移上清于1 ml的EP管中。用二辛可酸(BCA)法测定心肌细胞样品总蛋白含量[11]。
免疫印迹法测BNP、β-MHC和Calcineurin抗体、p-Calcineurin抗体、NFATc3、CaMK Ⅱ、p-CaMKⅡ的蛋白表达:每组取50 μl蛋白进行SDS-PAGE电泳分离,转移到硝酸纤维素膜上,封闭后以一抗(1:2000)4℃孵育过夜,继与辣根过氧化物酶标记抗体(1: 2000)37℃孵育1 h。常规洗膜,ECL显色系统(Amersham)检测,Ban&can图像分析系统定量各蛋白条带的总灰度值。
逆转录-聚合酶链反应(RT-PCR)测BNP、β-MHC的mRNA表达:各组心肌细胞培养72 h后,终止细胞培养,1×106细胞经PBS洗涤后用Trizol提取总RNA。取总RNA 4 μg,加入Oligo-(dt)18(0.5 μg/ μl)1 μl,再加入DEPC水,配成总体积为12 μl的反应体系,逆转录合成cDNA。实时荧光定量PCR扩增目的基因。引物由上海生工设计合成。
统计学处理:采用SPSS 17.0 统计软件进行数据的分析处理。所有计量资料采用均数±标准差表示,组间差异只有两组时用t检验,有多组时用单因素方差分析(one-way ANOVA)。以P<0.05作为差异有统计学意义。
2 结果
2.1Apelin对肥大心肌细胞的表面积、蛋白合成速率、总蛋白表达量的影响
在AngⅡ组,肥大心肌细胞给予AngⅡ(100 mmol/L)作用72 h后,可以使心肌细胞表面积、总蛋白表达量明显增加,与对照组相比差异均有统计学意义(P<0.01)。在AngⅡ+Apelin组,不同浓度的Apelin与AngⅡ共同作用于心肌细胞72 h后,心肌细胞表面积、亮氨酸掺入量和总蛋白表达量与AngⅡ组相比明显减少,呈Apelin剂量依赖性。在Apelin组,单独以不同浓度Apelin作用于心肌细胞,以上指标与对照组相比差异无统计学意义。图1
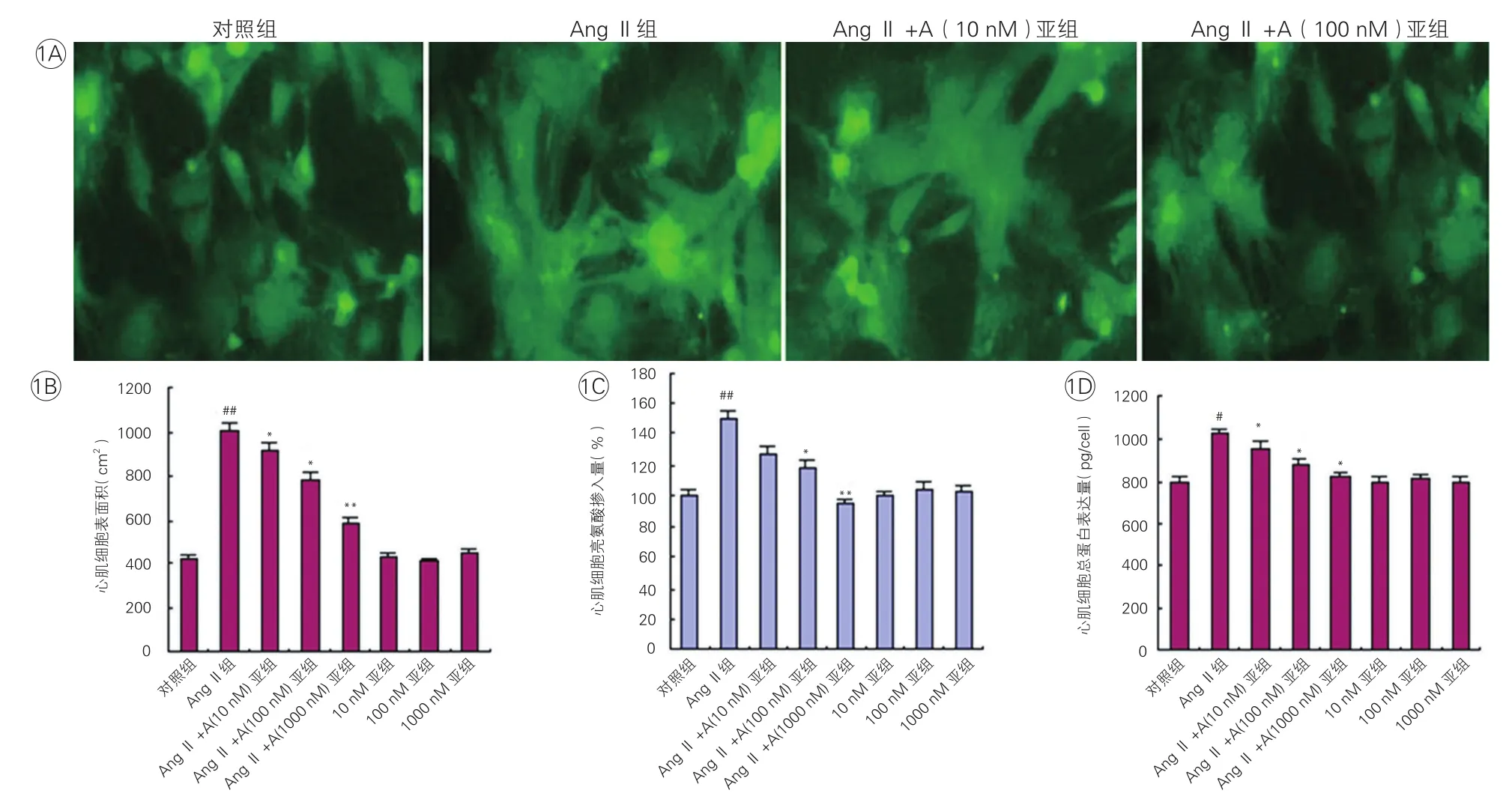
图1 Apelin在体外可剂量依耐性地抑制血管紧张素Ⅱ诱导的心肌细胞肥大
2.2Apelin对心肌细胞肥大标志物的影响
在AngⅡ组,100 mmol/L的AngⅡ作用72 h后,心肌细胞BNP和β-MHC的mRNA和蛋白表达水平明显升高,与对照组相比差异有统计学意义(P<0.01)。在AngⅡ+Apelin组,Apelin与AngⅡ共同作用于心肌细胞时,随着Apelin作用浓度的增加,BNP和β-MHC的mRNA和蛋白表达水平逐渐下降,呈剂量依赖性。在Apelin组,单独以不同浓度的Apelin(10 mmol/L,100 mmol/L,1000 mmol/L)作用于心肌细胞,其BNP和β-MHC的mRNA和蛋白表达水平与对照组相比无显著性差异。图2

图2 Apelin对心肌细胞肥大标志物的影响
2.3Apelin对心肌细胞内钙调神经磷酸酶、活化的T细胞核因子3和钙调蛋白激酶Ⅱ信号通路的影响
在AngII组,AngⅡ对心肌细胞Calcineurin蛋白表达无明显影响,但可明显上调其磷酸化产物p-Calcineurin的蛋白表达水平,同时提高心肌细胞NFATc3的蛋白表达水平。同时,AngⅡ可明显提高心肌细胞CAMK Ⅱ及其磷酸化产物p-CAMK Ⅱ的蛋白表达水平。在AngⅡ+Apelin组发现上述作用可被Apelin抑制,并呈剂量依赖性。在Apelin组,单独以不同浓度的Apelin作用于心肌细胞,以上指标与对照组相比差异有统计学意义。图3
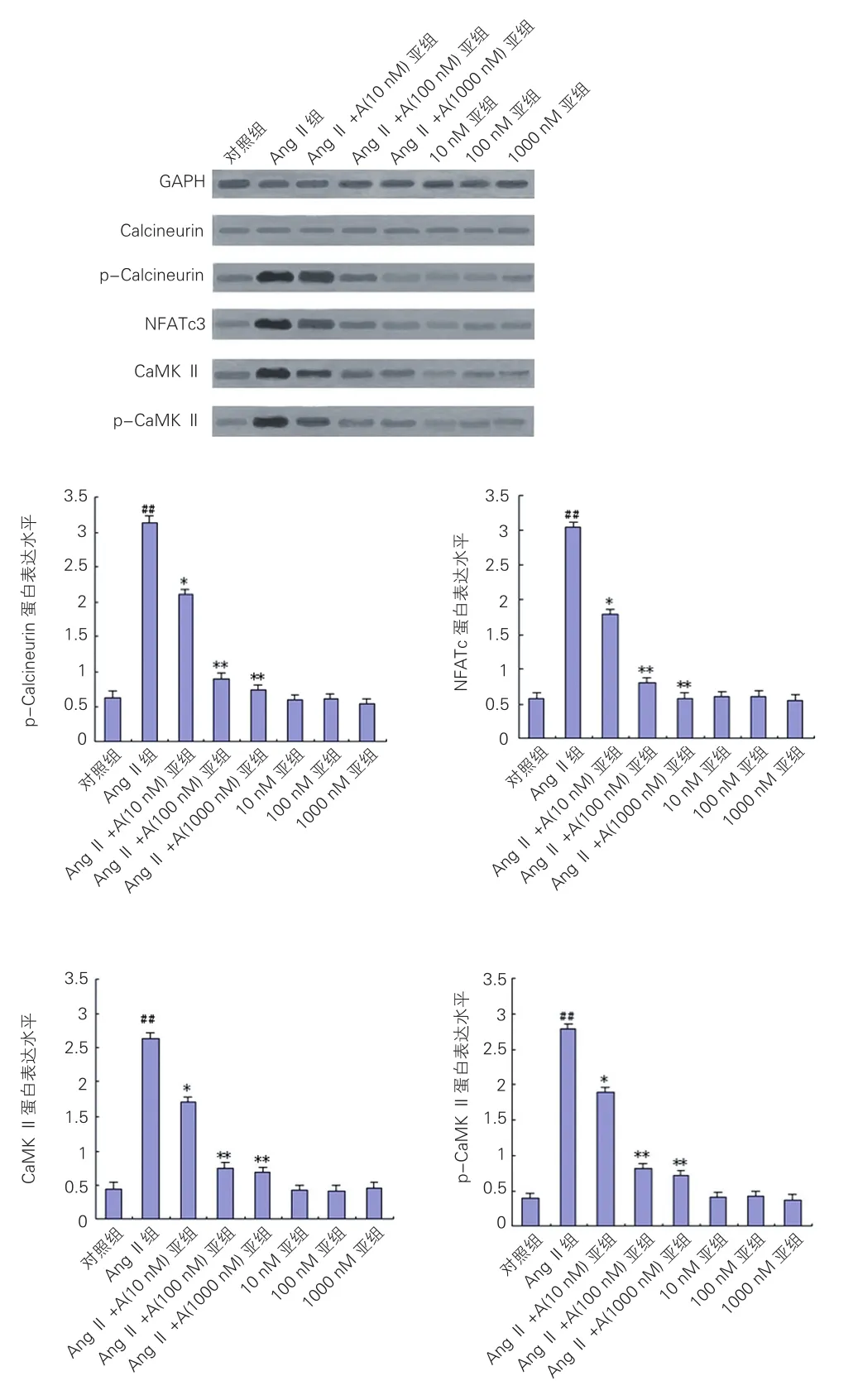
图3 免疫印迹分析Apelin对心肌细胞内钙调神经磷酸酶,活化的T细胞核因子3和钙调蛋白激酶Ⅱ蛋白表达量的影响
3 讨论
心肌肥厚是心血管疾病死亡率升高的一个独立危险因素。循环中或心肌局部Ang Ⅱ是引起心肌细胞肥大的最重要的活性物质之一[12]。Apelin扩张血管、降低血压,与AngⅡ所致的缩血管效应相反[6]。我们假设Apelin能够发挥与AngⅡ相反的作用,改善心肌肥厚,并进一步探讨了Apelin在AngⅡ诱导的心肌细胞肥大中的作用机制。
Apelin在体内分为Apelin-36,Apelin-13和Apelin-12[7]。本研究使用的是生物活性最强的Apelin-13。
本研究发现,当Apelin与AngⅡ联合作用时,AngⅡ的促心肌细胞肥大作用显著受到抑制。表现为心肌细胞表面积明显减小,蛋白合成速率下降,总蛋白合成量减少,同时可使BNP和β-MHC的蛋白表达水平明显下降。以上作用呈剂量依赖性。
研究发现,AngⅡ致心肌细胞肥大, 主要通过激活钙依赖的信号通路,活化Calcineurin及其下游的活化的T细胞核因子,调节心脏肥大基因的表达[3,4]。通过转基因的方法过表达Calcineurin或者NFAT可以诱导明显的心肌肥厚[13]。阻断NFATc3活性能逆转心肌肥厚进程[14,15]。CaMKⅡ被激活后也可诱导肥大基因表达,促进心肌肥厚[4]。肥厚心肌中CaMKⅡ的表达增加[16]。阻断CaMKⅡ可以抑制心肌肥厚[17]。预先给予Apelin可以抑制缺血再灌注损伤造成的心肌细胞内钙超载[18]。因此,我们假设Apelin可以通过Ca2+介导的Calcineurin和CaMKⅡ信号转导通路,对抗AngⅡ诱导的心肌肥厚。
本研究首次探讨了Apelin在肥大的心肌细胞中对Ca2+/calmodulin (CaM)依赖的Calcineurin和CaMKⅡ信号通路的影响。在本研究中,AngⅡ可明显上调Calcineurin的磷酸化产物p-Calcineurin及其下游因子NFATc3,以及CaMKⅡ的蛋白表达水平,与心肌细胞肥大的趋势一致。而Apelin可以明显抑制AngII的促心肌细胞肥大作用,并呈剂量依赖性。因此推断,Apelin可能通过Ca2+介导的Calcineurin-NFAT和CaMKⅡ信号通路,抑制AngⅡ诱导的心肌细胞肥大。可行进一步的研究探索Apelin的抗心肌肥厚的作用是否能被Calcineurin、NFATc3和/或CaMKⅡ的拮抗剂所抑制,明确Calcineurin-NFAT和CaMKⅡ信号通路在Apelin抗心肌肥厚作用中的作用。
[1] 胡海锋, 邹云增, 葛均波. 机械压力刺激导致心肌肥厚的分子机制.中国循环杂志,2006, 10: 152-155.
[2] 刘健, 何作云, 王培勇. 压力超负荷性心肌肥厚大鼠心肌细胞内钙激活蛋白酶活性分布的研究. 中国循环杂志, 2001, 12: 469-471.
[3] Zhang Y, Bloem LJ, Yu L, et al. Protein kinase C betaⅡ activation induces angiotensin converting enzyme expression in neonatal rat cardiomyocytes. Cardiovasc Res, 2003, 57: 139-146.
[4] Fischer TH, Herting J, Tirilomis T, et al. Ca2+/calmodulindependent protein kinase Ⅱ and protein kinase A differentially regulate sarcoplasmic reticulum Ca2+leak in human cardiac pathology. Circulation, 2013, 128: 970-981.
[5] O’Dowd BF, Heiber M, Chan A, et a1. A human gene that shows identity with the gene encoding the angiotensin receptor is located on chromosome 11.Gene, 1993, 136: 355-360.
[6] Tatemoto K, Hosoya M, Habata Y, et a1. Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor. Biochem Biophys Res Commun, 1998, 251: 471-476.
[7] Lee DK, Cheng R, Nguyen T, et al. Characterization of apelin, the ligand for the APJ receptor. J Neurochem, 2000, 74: 34-41.
[8] Yu XH, Tang ZB, Liu LJ, et al. Apelin and its receptor APJ in cardiovascular diseases. Clin Chim Acta, 2014, 428: 1-8.
[9] Iwanaga Y, Kihara Y, Takenaka H, et al. Down-regulation of cardiac apelin system in hypertrophied and failing hearts: Possible role of angiotensin Ⅱ-angiotensin type 1 receptor system. J Mol Cell Cardiol, 2006, 41: 798-806.
[10] De Mota N, Reaux-Le Goazigo A, El Messari S, et al. Apelin, a potent diuretic neuropeptide counteracting vasopressin actions through inhibition of vasopressin neuron activity and vasopressin release. Proc Natl Acad Sci USA, 2004, 101: 10464-10469.
[11] Smith PK, Krohn RI, Hermanson GT, et al. Measurement of protein using bicinchoninic acid. Anal Biochem, 1985, 150: 76-85.
[12] Chun HJ, Ali ZA, Kojima Y, et al. Apelin signaling antagonizes AngⅡ effects in mouse models of atherosclerosis. J Clin Invest, 2008, 118: 3343-3354.
[13] Bueno OF, Wilkins BJ, Tymitz KM, et al. Impaired cardiac hypertrophic response in calcineurin Abeta -deficient mice. Proc Natl Acad Sci USA, 2002, 99: 4586-4591.
[14] Wang LN, Wang C, Lin Y, et al. Involvement of calcium-sensing receptor in cardiac hypertrophy-induced by angiotensinⅡ through calcineurin pathway in cultured neonatal rat cardiomyocytes. Biochem Biophys Res Commun, 2008, 369: 584-589.
[15] Wilkins BJ, De Windt LJ, Bueno OF, et al. Targeted disruption of NFATc3, but not NFATc4, reveals an intrinsic defect in calcineurinmediated cardiac hypertrophic growth. Mol Cell Biol, 2002, 22: 7603-7613.
[16] Anderson ME, Brown JH, Bers DM. CaMK Ⅱ in myocardial hypertrophy and heart failure. J Mol Cell Cardiol, 2011, 51: 468-473.
[17] Ke J, Chen F, Zhang C, et al. Effects of calmodulin-dependent protein kinase Ⅱ inhibitor, KN-93, on electrophysiological features of rabbit hypertrophic cardiac myocytes. J Hua zhong Univ Sci Technolog Med Sci, 2012, 32: 485-489.
[18] Wang C, Liu N, Luan R, et al. Apelin protects sarcoplasmic reticulum function and cardiac performance in ischaemia-reperfusion by attenuating oxidation of sarcoplasmic reticulum Ca2+-ATPase and ryanodine receptor. Cardiovasc Res, 2013, 100: 114-124.
Effect of Apelin on Angiotensin II-induced Cardiomyocyte Hypertrophy With its Mechanism in Experimental Rats
ZHOU Ying, CHEN You-zhou, QIAO Shu-bin.
Department of Cardiology, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
QIAO Shu-bin, Email: qsbfw@sina.com
Objective: To explore the effect of apelin on angiotensin II (Ang II)-induced cardiomyocyte hypertrophy and intracellular signal transduction mechanism in experimental rats.Methods: The cardiomyocyte from 1 to 3 days neonatal rats were cultured with Ang II to induce the cardiomyocyte hypertrophy, and the cells were treated by apelin at different concentrations. The [3H] Leucine incorporation, cardiomyocyte surface area and total protein expression were analyzed to evaluate the degree of cardiomycyte hypertrophy. The protein expressions of intracellular BNP, β-MHC, nuclear factor 3 of activated T cells (NFATc3), calcineurin, phospho-calcineurin, calmodulin kinase II (CaMK II) and phospho-CaMK II were assessed by Western blot analysis. The mRNA expressions of BNP and β-MHC were examined by RT-PCR.Results: Apelin may inhibit Ang II induced cardiomyocyte hypertrophic response in a dose-dependent manner, the maximum inhibition was achieved at Ang II 1000 nmol/L. Meanwhile, apelin may inhibit Ang II-induced elevations of intracellular resting free calcium level, mRNA expressions of BNP and β-MHC, protein expressions of NFATc3, phosphocalcineurin, CaMK II and phospho-CaMK II in a dose-dependent manner.Conclusion: Apelin may inhibit Ang II-induced cardiomyocyte hypertrophy in experimental rats which might be related to Ca2+-dependent calcineurin signal pass ways.
Angiotensin II; Cardiomyocyte hypertrophy; Calcineurin; Calmodulin kinase II
2014-05-05)
(助理编辑:许菁)
100037 北京市,北京协和医学院 中国医学科学院 国家心血管病中心 阜外心血管病医院 冠心病诊治中心
周颖 主治医师 博士研究生 主要从事冠心病、心肌病等研究 Email: drzhouying@gmail.com 通讯作者: 乔树宾 Email: qsbfw@sina.com
R363.16
A
1000-3614(2014)09-0733-05
10.3969/j.issn.1000-3614.2014.09.019
方法:培养1~3 d新生Sprague-Dawley大鼠心肌细胞,给予AngⅡ刺激。在此基础上给予不同浓度Apelin。测定[3H]亮氨酸掺入量、细胞表面积以及总蛋白表达量评价心肌细胞肥大程度。免疫印迹法测定细胞B型尿钠肽、β肌球蛋白重链、活化T细胞的核因子3、钙调神经磷酸酶、磷酸化钙调神经磷酸酶、钙调蛋白激酶Ⅱ、磷酸化钙调蛋白激酶Ⅱ的蛋白表达水平。逆转录-聚合酶链反应法测定B型尿钠肽和β肌球蛋白重链mRNA表达水平。
结果:Apelin可以抑制AngⅡ诱导的心肌细胞肥大,其作用呈剂量依赖性。同时,Apelin可以抑制AngⅡ诱导的B型尿钠肽和β肌球蛋白重链mRNA表达水平、B型尿钠肽和β肌球蛋白重链、活化T细胞的核因子3、磷酸化钙调神经磷酸酶、钙调蛋白激酶Ⅱ和磷酸化钙调蛋白激酶Ⅱ的蛋白表达水平升高,且均与Apelin浓度呈剂量依赖性。
结论:Apelin可以抑制AngⅡ诱导的心肌细胞肥大,其机制与Ca2+依赖的钙调神经磷酸酶信号转导通路有关。
