Cochrane偏倚风险评估工具在随机对照研究Meta分析中的应用
2014-03-02谷鸿秋王杨李卫
谷鸿秋,王杨,李卫
学习园地
Cochrane偏倚风险评估工具在随机对照研究Meta分析中的应用
谷鸿秋,王杨,李卫
Meta分析;Cochrane偏倚风险评估工具;随机对照
20世纪70年代,随着随机对照试验以及循证医学的兴起,系统综述和Meta分析的研究在医学领域的应用越来越普遍,各种证据分级体系也将其列为最高的证据级别[1]。但系统综述和Meta分析研究本身的质量也引起了研究者的注意,因此学界也提出了规范此类研究的声明如PRISMA[2](早期称为QUOROM[3])和MOOSE[4]。尽管如此,诸多研究表明,已发表的系统综述和Meta分析研究其本身的质量仍然存在着各种各样的问题[5]。其实Meta分析作为定量系统综述的一种数据合并方法,其结论的质量不仅依赖于严格的Meta分析操作流程,更依赖于研究文献本身的质量及其对偏倚的控制。故对纳入Meta分析的研究文献的进行质量评价和偏倚评估,一直是比较关注的议题。
Meta分析中,不同类型的研究文献有不同的质量评价标准。例如,观察性研究常用的评价工具是NOS量表[6];非随机对照研究常用的评价工具是MINORS条目[7];而对随机对照研究进行质量评价,目前应用最为广泛是Jadad量表[8],以及Cochrane协作组推荐的Cochrane偏倚风险评估工具[9,10]。其它评价工具如CAPS清单、Reisch以及AHRQ评价等更多工具在此不作过多阐述[11-13]。
随机对照试验作为证据级别仅次于Meta分析的研究形式,是高质量Meta分析研究的基石。因此,本文将对Cochrane协作组推荐使用的Cochrane偏倚风险评估工具作一简要介绍。
1 Cochrane偏倚风险评估工具的内容
Cochrane偏倚风险评估工具主要从选择(包括随机序列产生和分配隐藏)、实施(包括对研究者和受试者施盲)、测量(研究结局盲法评价)、随访(结局数据的完整性)、报告(选择性报告研究结果)及其他(其他偏倚来源)这6个方面总计7个条目对偏倚风险进行评价。对每个条目依据偏倚风险评估准则做出“低风险偏倚”、 “高风险偏倚”和“不清楚”的判定结果(表1)。
2 使用Cochrane风险偏倚评估工具评估偏倚的例子
Cochrane协作组织提供的Revman软件内置了Cochrane风险偏倚评估工具,并可提供可视化的结果。图1展示的便是Cochrane系统评价手册里提供的风险偏倚评估结果的例图。图中可用不同的颜色(绿、红、黄)及符号(“+”、“-”、“?”)来分别表示“低风险偏倚”、 “高风险偏倚”和“不清楚”。
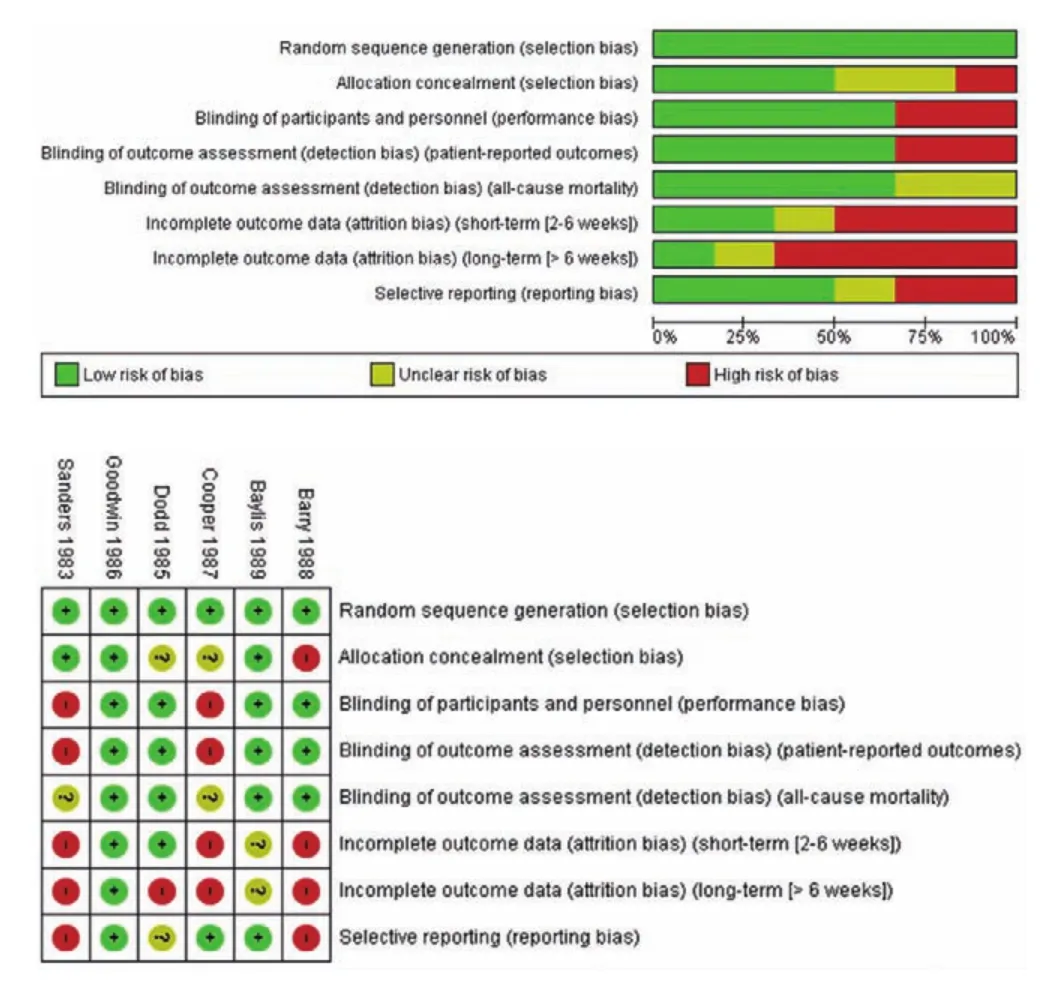
图1 Cochrane风险偏倚评估结果
对于随机对照研究的质量评价,现有的评价工具众多,并不断有新的评价工具出现。但这些工具繁简各异,结构各异,缺乏共识,Cochrane协作组现已不推荐使用任何一种清单或量表, Cochrane偏倚风险评估工具是Cochrane协作网的方法学家、编辑和系统评价员的共识,也是Cochrane 手册所推荐的偏倚风险评估工具[10,14],其结构明晰,方便易用,研究者在进行Meta分析评估随机对照研究时,应优先考虑此工具。

表1 Cochrane偏倚风险评估工具中偏倚风险的评估准则
[1] 陈耀龙, 李幼平, 杜亮, 等. 医学研究中证据分级和推荐强度的演进. 中国循证医学杂志, 2008, 8: 127-133.
[2] Moher D, Liberati A, Tetzlaff J, et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. Annals of internal medicine, 2009, 151: 264-269.
[3] Moher D, Cook D J, Eastwood S, et al. Improving the quality of reports of meta-analyses of randomised controlled trials: the QUOROM statement. Lancet, 1999, 354: 1896-1900.
[4] Group M, Others. Meta-Analysis of Observational studies in Epidemiology. A proposal for reporting. JAMA, 2000, 283: 2008-2012.
[5] Sacks HS, Berrier J, Reitman D, et al. Meta-analyses of randomized controlled trials. The New England Journal of Medicine, 1987, 316: 450-455.
[6] Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses. Eur J Epidemiol, 2010, 25: 603-605
[7] Slim K, Nini E, Forestier D, et al. Methodological index for nonrandomized studies (minors): development and validation of a new instrument. ANZ J Surg, 2003, 73: 712-716.
[8] Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary?. Control Clin Trials, 1996, 17: 1-12.
[9] 马捷, 刘莹, 钟来平, 等. Jadad 量表与 Cochrane 偏倚风险评估工具在随机对照试验质量评价中的应用与比较. 中国口腔颌面外科杂志, 2012, 10: 417-422.
[10] Higgins J, Green S. Cochrane Collaboration: Cochrane Handbook for Systematic Reviews of Interventions Version 5.1. 0 [updated March 2011]. John Wiley & Sons Ltd and The Cochrane Collaboration, Chichester, 2011,
[11] 曾宪涛, 刘慧, 陈曦, 等. Meta分析系列之四:观察性研究的质量评价工具. 中国循证心血管医学杂志, 2012, 4: 297-299.
[12] 曾宪涛, 包翠萍, 曹世义, 等. Meta分析系列之三:随机对照试验的质量评价工具. 中国循证心血管医学杂志, 2012, 4: 183-185.
[13] 曾宪涛, 庄丽萍, 杨宗国, 等. Meta分析系列之七:非随机实验性研究、诊断性试验及动物实验的质量评价工具. 中国循证心血管医学杂志, 2012, 4: 496-499.
[14] Higgins JP, Altman DG, Gotzsche PC, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ, 2011, 343: d5928.
(交稿日期:2014-01-14)
(助理编辑:许菁)
100037 北京市,北京协和医学院 中国医学科学院 国家心血管病中心 阜外心血管病医院 心血管疾病国家重点实验室医学研究统计中心
谷鸿秋 博士研究生 主要研究方向:临床试验设计及统计分析 Email: guhongqiu@mrbc-nccd.com 通讯作者:李卫
Email: liwei@mrbc-nccd.com
R54
C
1000-3614(2014)02-0147-02
10.3969/j.issn.1000-3614.2014.02.017
