趋化因子受体6基因敲除对载脂蛋白E基因敲除小鼠动脉粥样硬化斑块形成的影响
2014-03-02张小娟任满意曹晓青张春盛刘同宝
张小娟,任满意,曹晓青,张春盛,刘同宝
基础与实验研究
趋化因子受体6基因敲除对载脂蛋白E基因敲除小鼠动脉粥样硬化斑块形成的影响
张小娟,任满意,曹晓青,张春盛,刘同宝
目的:探讨趋化因子受体6(CCR6)基因敲除对ApoE基因敲除(ApoE-/-)小鼠主动脉粥样硬化斑块形成的影响及其作用机制。
方法:杂交培育CCR6基因敲除(CCR6-/-)ApoE-/-小鼠20只作为实验组,普通CCR6+/+ApoE-/-小鼠20只作为对照组,给予高脂饮食。12周后将小鼠处死进行取材固定,主动脉根部冰冻切片进行苏木素伊红(HE)染色、油红O染色及巨噬细胞和单核细胞趋化蛋白1(MCP-1)的免疫组化染色,对斑块的形态、面积及组成进行观测。并培育巨噬细胞,进行了噻唑蓝比色实验及细胞迁移实验,对机制进一步分析。
结果:实验组与对照组相比斑块面积显著减小[(8.3±1.9)% vs (16.1±2.0)%, P<0.05];实验组与对照组相比主动脉根部脂质沉积 [(14.4±2.1)% vs (28.5±3.4)%] 及主动脉大体脂质沉积[(4.9±2.8)% vs (13.6±3.2)%] 均提示实验组脂质沉积显著减小(P<0.05);实验组与对照组相比斑块内巨噬细胞[(18.9±2.8)% vs (35.7±4.5)%] 及MCP-1表达减少[(16.3±2.2) % vs (23.1±5.6)%]。差异均有统计学意义(P<0.05)。
结论:CCR6通过影响脂质沉积、巨噬细胞增殖迁移促进动脉粥样硬化的形成。
动脉粥样硬化;趋化因子受体6;巨噬细胞;单核细胞趋化蛋白1
Methods: Our research included 2 groups, Experimental group, n=20 CCR6-/-ApoE-/-mice and Control group, n=20 CCR6+/+ApoE-/-mice. Both groups received high-fat diet for 12 weeks, and then, the aortic roots were collected for HE staining, the monocyte chemoattractant protein-1 (MCP-1) in macrophages for immune-histochemisty staining, the macrophages were cultured for migration study, and the results were compared between 2 groups.
Results: The plaque areas in Experimental group was signif i cantly smaller than those in Control group, (8.3±1.9) % vs (16.1±2.0) %, P<0.05. The Experimental group had less lipid deposition in aortic root, (14.4±2.1) % vs (28.5±3.4) %, and less lipid deposition in aorta (4.9±2.8) % vs (13.6±3.2) %, all P<0.05. The Experimental group showed less macrophages and lower MCP-1 expression in plaques, (18.9±2.8) % vs (35.7±4.5) % and (16.3±2.2) % vs (23.1±5.6) %, all P<0.05.
Conclusion: CCR6 promotes atherogenesis plaque formation by lipid deposition and macrophage migration in ApoE-/-mice.
(Chinese Circulation Journal, 2014,29:300.)
动脉粥样硬化(atherosclerosis,AS)是一种以脂质斑块在动脉壁聚积为特征的疾病,伴有动脉管壁增厚变硬、血管弹性减退及管腔缩窄。随着研究的深入,人们发现动脉粥样硬化是一种巨噬细胞介导
的,多种炎症因子参与的炎症性疾病[1]。血液中脂质在管壁的过度沉积造成内皮细胞损伤,单核细胞浸润,当单核细胞从损伤的内皮细胞之间移行至内膜下后,在各种炎症介质的刺激下活化为巨噬细胞,又是动脉粥样硬化发生发展的关键步骤[2]。
巨噬细胞迁移的过程以及导致其迁移的趋化因子及其受体已经成为关注的焦点。趋化因子通过特异性地偶联其在靶细胞表面的G蛋白偶联受体而调节白细胞的迁移。在众多的趋化因子和受体中,趋化因子受体6 (chemokine receptor 6, CCR6)及其配体CC趋化因子配体20(C-C chemokine ligand 20,CCL20)被认为具备稳定内环境的功能,新近发现它们同样能在炎症中发挥作用[3]。本研究利用CCR6基因敲除(CCR6-/-)及载脂蛋白E基因敲除(ApoE-/-)小鼠分析CCR6在动脉粥样硬化发生过程中发挥的作用。
1 材料和方法
1.1动物来源、饲养及分组
动物模型的建立:于2012-03至2013-06,将清洁级6周龄雌性ApoE-/-小鼠(维通利华,北京,中国)和CCR6-/-小鼠(Jackson Labs,Bar Harbor, Maine 04609 USA)进行杂交培养,饲养于山东大学实验动物中心。
分 组:20只 8周 龄 的 杂 交 培 育 CCR6-/-ApoE-/-小鼠纳入实验为实验组,对照组为20只普通CCR6+/+ApoE-/-小鼠。两组小鼠均给予高脂饲料(含胆固醇0.15%,脂肪21%)喂养12周后,将小鼠处死并行血清血脂及主动脉病理学检查。
1.2检测指标
苏木素伊红(HE)染色:取冰冻切片常规做HE染色,从每只小鼠主动脉根部连续切片,每间隔5张取l张,共取3张切片。在光学显微镜下观察斑块大小,用多功能彩色病理图像分析系统软件(ImagePro-Plus soft-ware)分别测出斑块面积及血管内、外膜长度,回归标准圆形后计算斑块面积与血管管腔面积之比。
油红O染色:制备冰冻切片,常规行油红O染色,在光学显微镜下观察斑块内脂质含量的多少。完整取下小鼠主动脉,剥离主动脉外膜,抛开主动脉行油红O染色,ImagePro-Plus soft-ware计算脂质与血管面积之比。
免疫组化染色:冰冻切片晾干30 min,入蒸馏水中水化30 min,再入0.3%过氧化氢(H2O2)溶液内室温100 min。然后血清封闭1 h,以减少非特异性反应。抗单核—巨噬细胞标志物抗体(Monocyte/ Macrophage Marker,MOMA-2,1:200)检测组织切片中巨噬细胞表达[4],抗单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)抗体(1:100)检测组织切片中MCP-1表达。在光学显微镜下观察棕黄色颗粒为阳性表达,采用ImagePro-Plus soft-ware做图像数字采集及半定量分析。
1.3细胞实验
细胞培养:小鼠巨噬细胞系RAW264.7细胞购自American Type Culture Collection (ATCC,美国标准生物品收藏中心),用含有10%胎牛血清(杭州四季青公司)的RPMI1640(GIBCO,Life Technologies,上海,中国)培养基在37℃、5%的二氧化碳(CO2)培养箱中培养,2~3 d细胞长满,即可传代培养。
蛋白质印迹法(Western blot):细胞经过裂解后,4℃,12 000 g离心10 min,二辛可宁酸法蛋白检测(bicinchoninic acid protein assay, BCA)法定量检测蛋白质浓度[5]。加入蛋白上样缓冲液,煮沸使蛋白质变性。相同蛋白含量的提取液加入积层胶90 V,分离胶120 V,电泳分离细胞蛋白,200 mA将胶上的蛋白质转移至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)膜上。5%脱脂牛奶室温封闭2 h后,加入一抗(兔抗小鼠MCP-1浓度1:1000),4℃孵育6~12 h。TBST(Tris 25 mM, NaCl 150 mM, Tween-20 0.5%, pH=7.6)洗膜3次,每次5~10 min。加入二抗(山羊抗兔二抗1:20 000),室温孵育2 h,Tris盐水吐温缓冲液(TBST)洗膜3次。最后加入显影液,印记曝光于X光片上后,进行图像分析。
噻唑蓝比色(MTT)实验:将RAW264.7细胞消化成单细胞悬液,以每孔5 000个细胞的浓度将经小分子干涉RNA(siRNA)干扰的细胞和对照组细胞分别加入96孔板,每孔200 µl。12 h后每孔均加入MTT溶液(5 mg/ml)20 µl,继续孵育4 h后,弃上清液,加入150 µl二甲基亚砜(DMSO),震荡10 min使结晶物充分溶解,选择490 nm波长检测每孔吸光度,并绘制生长曲线。
细胞迁移(Transwell)实验:24孔板内每孔加有600 µl的培养基(含10%血清),后在细胞迁移的内室分别加入经或未经siRNA处理的RAW264.7细胞(100 µl,含0.1%血清),放入培养箱,12 h后,取出细胞迁移,用棉签擦去聚碳酸膜(PVPF膜)靠近内室那一面的细胞,另一面的细胞用甲醛室温固定30 min,结晶紫染色20 min,用清水洗3遍以上,后在显微镜下观察细胞,记数。
CCR6 siRNA干扰实验:CCR6 siRNA试剂盒购
自 Selleck (Houston, TX 77054 USA),500 μl Opti-MEM(GIBCO)稀释siRNA (转染细胞的终浓度为33 nM),500 µl Opti-MEM稀释1.0 µl LipofectamineTM2000 (Invitrogen, Life Technologies,上海),轻轻吹吸3 次混匀,室温下静置5 min。混合转染试剂和siRNA 稀释液,室温下静置20 min。转染复合物加入到6孔细胞板中,1 ml/孔转染6 h后换新鲜培养基。
1.4统计学分析
应用SPSS 13.0统计软件进行分析。测量数据以均值±标准差表示,计量资料采用t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1趋化因子受体6基因敲除抑制斑块形成
HE染色结果表明,对照组可见小鼠主动脉根部形成大面积斑块,占管腔面积为[(16.1±2.0)%],实验组亦可见斑块形成,但斑块面积[(8.3±1.9)%]显著少于对照组(图1),差异有统计学意义(P<0.05)。
2.2趋化因子受体6基因敲除抑制斑块内脂质沉积
油红O染色发现:对照组可见小鼠主动脉根部形成大面积斑块,内含大量红染脂质,占斑块面积的(28.5±3.4)%;实验组亦可见斑块形成,但斑块内红染脂质(14.4±2.1)%显著少于对照组(图2A),差异有统计学意义(P<0.05)。主动脉大体仍然可以发现:对照组斑块中的红染面积[(13.6±3.2)%]显著大于实验组[(4.9±2.8)%](图2B),差异有统计学意义(P<0.05)。
2.3趋化因子受体6基因敲除抑制斑块内巨噬细胞聚集
单核—巨噬细胞表面特异性标志抗原抗体染色结果:对照组可见小鼠主动脉根部单核—巨噬细胞[(35.7±4.5)%]表达强阳性,实验组主动脉根部单核—巨噬细胞[(18.9±2.8)%]显著减少(图3),差异有统计学意义(P<0.05)。
2.4趋化因子受体6 siRNA 抑制巨噬细胞增殖迁移
噻唑蓝比色实验结果显示,CCR6 siRNA干预6 h后,实验组与对照组相比[(129.4±12.2)vs (113.8±9.4)] 和 CCR6 siRNA干 预 12 h [(147.2±13.5) vs(126.7±15.3)] ,差异均有统计学意义(P<0.05)。细胞迁移实验结果显示,CCR6 siRNA干预24 h后,实验组与对照组相比能够显著抑制巨噬细胞的迁移(183.4±19.3 vs 122.8±8.7),差异有统计学意义(P<0.05)。
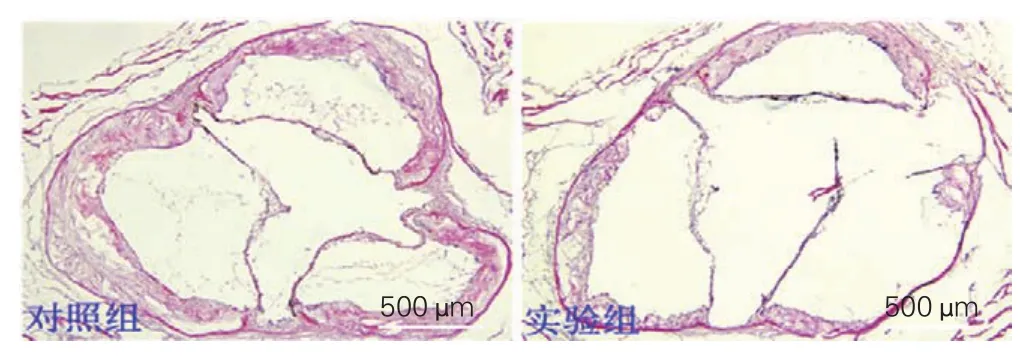
图1 两组小鼠(n=20)主动脉根部苏木素伊红染色结果

图2 两组小鼠(n=20)油红O染色结果
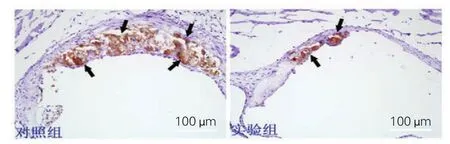
图3 两组小鼠(n=20)主动脉根部单核—巨噬细胞免疫组化染色结果
2.5趋化因子受体6基因敲除抑制单核细胞趋化蛋白1表达
MCP-1免疫组化研究结果表明,实验组小鼠主动脉根部MCP-1[(16.3±2.2)%]表达显著低于对照组[(23.1±5.6)%](图4),差异有统计学意义(P<0.05)。

图4 趋化因子受体6促进单核细胞趋化蛋白1表达
3 讨论
趋化因子(chemokines)是由小分子分泌蛋白组成的一个大的细胞因子超家族, 能趋化细胞作定向移动,在各种生物学反应中发挥着重要作用。趋化因子受体是异三聚体G蛋白耦联受体,有7个跨膜区。根据受体结合的趋化因子种类的不同将受体分为4类:CR、CCR(CCR12CCR9) 、CXCR(CXCR12CXCR5)及CX3CR。
CCR6是巨噬细胞炎症蛋白3α(MIP-3α/ CCL20)的受体,CCR6表达于多种白细胞亚型,包括树突状细胞、B细胞、TH17细胞、NK细胞、中性粒细胞等[4,5]。Ruth等[6]的研究表明,CCL20-CCR6在体外实验中能导致单核细胞的趋化;而Le Borgne等[7]的研究进一步表明,CCL20-CCR6能够在体内导致皮炎小鼠单核细胞的聚集。经静脉注射CCL20同样引起单核巨噬细胞的聚集。对于静止的单核巨噬细胞和中性粒细胞来说,CCR6的表达是低水平的,但是在动脉粥样硬化相关细胞因子的刺激下CCR6的表达水平会迅速升高。最近研究甚至表明,CCR6在具有促炎作用的M1型和抗炎作用M2型两种巨噬细胞上表达水平相当。与健康动脉相比,无论是人的还是小鼠的动脉粥样硬化的冠状动脉和颈动脉中,CCR6和CCL20的表达均明显升高[8,9]。
本研究中,我们利用CCR6-/-敲基因小鼠第一次证明CCR6直接参与了动脉粥样硬化的发生发展。本研究完成CCR6-/-ApoE-/-双敲小鼠模型的构建,利用HE染色证明,与对照组相比,实验组小鼠斑块面积明显减少,这说明CCR6的存在能够促进斑块的增长。对主动脉根部及主动脉大体进行油红O染色,与对照组相比,实验组小鼠斑块内脂质沉积明显减少,表明CCR6的存在直接或间接参与了脂质的转运。
为了进一步研究CCR6影响斑块形成及发展的机制,我们对斑块内的巨噬细胞进行了免疫组化染色,发现与对照组相比,实验组小鼠斑块内巨噬细胞含量明显减少,这证明了CCR6在斑块内能够促进巨噬细胞的迁移。为了进一步明确CCR6对巨噬细胞增殖迁移的促进作用,我们在体外应用CCR6的siRNA阻断CCR6的表达,结果表明阻断CCR6后巨噬细胞增殖迁移活性均受到显著影响。最后我们在体内和体外检测了MCP-1的表达,结果显示阻断CCR6后MCP-1表达显著减少,在体内体外均证明了这一结论。有研究表明,CCR6与其配体CCL20的结合能够干扰血糖代谢并促进糖尿病的发病,而CCR6阻断后能够明显抑制糖尿病的进展。此外作为趋化因子,CCR6参与多种细胞因子的代谢,所以其与内分泌存在关系,在以后的实验中我们将进一步在这一领域做出研究。
动脉粥样硬化已经成为严重威胁人类健康的疾病[10,11],上述所有结果共同表明,CCR6在动脉粥样硬化的形成和发展过程中发挥了举足轻重的作用。这一发现将为动脉粥样硬化性疾病的防治提供新的依据。
[1] Ghattas A, Griffiths HR, Devitt A, et al. Monocytes in coronary artery disease and atherosclerosis: Where are we now? J Am Coll Cardiol, 2013, 62: 1541-1551.
[2] Lu X, Kakkar V. Inflammasome and atherogenesis. Curr Pharm Des, 2014,20: 108-124.
[3] Barth T, Schmidt D, Botteron C, et al. An early reduction in Treg cells correlates with enhanced local inflammation in cutaneous leishmaniasis in CCR6-deficient mice. PLoS One, 2012, 7: e44499.
[4] Walker JM. The bicinchoninic acid (BCA) assay for protein quantitation. Methods Mol Biol, 1994, 32: 5-8.
[5] Twentyman PR, Luscombe M. A study of some variables in a tetrazolium dye (MTT) based assay for cell growth and chemosensitivity. Br J Cancer, 1987, 56: 279-285.
[6] Ruth JH, Shahrara S, Park CC, et al. Role of macrophage inflammatory protein-3alpha and its ligand CCR6 in rheumatoid arthritis. Lab Invest, 2003, 83: 579-588.
[7] Le Borgne M, Etchart N, Goubier A, et al. Dendritic cells rapidly recruited into epithelial tissues via CCR6/CCL20 are responsible for CD8+ T cell crosspriming in vivo. Immunity, 2006, 24: 191-201.
[8] Yilmaz A, Lipfert B, Cicha I, et al. Accumulation of immune cells and high expression of chemokines/chemokine receptors in the upstream shoulder of atherosclerotic carotid plaques. Exp Mol Pathol, 2007, 82: 245-255.
[9] Calvayrac O, Rodriguez-Calvo R, Alonso J, et al. CCL20 is increased in hypercholesterolemic subjects and is upregulated by LDL in vascular smooth muscle cells: role of NF-kB. Arterioscler Thromb Vasc Biol, 2011, 31: 2733-2741.
[10] 华先平, 杨勇, 娄国平, 等. 瑞舒伐他汀对颈动脉粥样硬化患者颈动脉内中膜厚度及血清炎症因子的影响. 中国循环杂志, 2011, 26: 198-201.
[11] 柯元南. 动脉粥样硬化的抗栓和抗凝治疗. 中国循环杂志, 2007, 22: 476-478.
Effect of Chemokine Receptor 6 Knock-out on Atherosclerosis Plaque Formation in ApoE-/-Mice
ZHANG Xiao-juan, REN Man-yi, CAO Xiao-qing, ZHANG Chu-sheng, LIU Tong-bao.
Department of Cardiology, Shandong Provincial Chest Hospital, Jinan (250014), Shandong, China
Objective: To explore the effect of chemokine receptor 6 (CCR6) on atherosclerosis plaque formation in ApoE-/-mice.
Atherosclerosis; Chemokine receptor 6; Macrophage; Monocyte chemoattractant protein-1
2013-11-20)
(编辑:漆利萍)
250014 山东省济南市,山东大学医学院 山东省胸科医院 心内科
张小娟 副主任医师 硕士 主要从事冠心病临床研究 Email: zxj13791050365@163.com 通讯作者:刘同宝 Email: liutongbao@medmail.com.cn
R541
A
1000-3614(2014)04-0300-04
10.3969/j.issn.1000-3614.2014.04.016
