通过左心室心外膜导线行心脏再同步治疗六例分析
2014-03-02戴研陈柯萍华伟陈若菡张竞涛张澍
戴研,陈柯萍,华伟,陈若菡,张竞涛,张澍
通过左心室心外膜导线行心脏再同步治疗六例分析
戴研,陈柯萍,华伟,陈若菡,张竞涛,张澍
目的:回顾性分析对于经冠状静脉窦放置左心室导线失败的心力衰竭(心衰)患者,通过左心室心外膜导线行心脏再同步治疗(CRT)的安全性和疗效。
心力衰竭;再同步化治疗;心外膜;外科手术
临床研究提示,心力衰竭(心衰)患者中约30%合并心脏传导异常,表现为QRS波增宽,或是左束支传导阻滞[1],而引起心室收缩不同步,导致心衰的恶化及死亡率增加[2]。近年来,越来越多的证据显示,对于左心室射血分数≤35%且QRS宽度≥120 ms,特别是左束支传导阻滞患者,心脏再同步治疗(CRT)能够改善预后,降低死亡率[3]。
通过冠状静脉窦放置左心室导线是CRT植入中最困难的部分,随着器械的进步,其成功率能够达到90%以上,但仍有不到10%的患者因心脏扩大、冠状静脉窦变形,而导致经静脉放置导线失败[4];另外,因膈神经刺激造成左心室导线无法到达最佳部位,或者左心室导线术中及术后脱位,也是临床上行CRT时经常遇到的问题[4]。在这些情况下,考虑经胸部小切口或者胸腔镜放置左心室心外膜导线,是成功行CRT的另一种选择[5,6]。本研究回顾分析了我院近年心内科与心外科联合,杂交放置左心室心外膜导线与右心心内膜导线,行CRT患者6例,为临床医生提供参考。
1 资料与方法
病例选择:选取2010-11至2013-01因慢性心衰住院行CRT,经心内科手术不成功而通过内、外科杂交行CRT的患者6例,男性4例,女性2例,年龄26~68(45±15)岁;其中5例为窦性心律,1例为持续性心房颤动(房颤)。入选患者均符合:①经药物最优化治疗至少3个月,纽约心功能分级(NYHA)为II~IV级;②左心室射血分数≤35%;③QRS波增宽:完全性左束支传导阻滞伴QRS时限>120 ms;或非左束支传导阻滞,QRS时限>150 ms。
手术经过: 6例患者经静脉行CRT未成功后,经与心外科会诊后,择期再次行内、外科杂交行CRT。手术过程如下:全麻下,取右侧30°~40°卧位;经第5肋间左前外侧切口切开皮肤4~5 cm,逐层分离至胸腔内,切开心包,在左心室选择适当部位缝合左心室导线,测试阈值满意后关闭心包,放置引流管;经皮下隧道将左心室导线引致左锁骨下。左锁骨下切开皮肤,逐层分离至筋膜层,穿刺左锁骨下静脉,经左锁骨下静脉置入右心房、右心室导线,测试阈值满意后,制作皮下囊袋,将右心房、右心室及左心室导线与脉冲发生器相接,将脉冲发生器埋于囊袋中。逐层缝合皮下组织及皮肤,返回病房。
研究方法:对所有病例进行临床情况分析,包括病因、术前心功能状况、心电图和超声心动图结果、手术记录及术后情况;出院后定期随访,第1次随访为3个月,以后每半年随访1次,观察患者心功能、心电图以及超声心动图变化,以观察杂交行CRT的安全性及有效性。
2 结果
患者基线资料:本组6例患者均为扩张性心肌病,经优化药物治疗后,心功能II~III级,左心室射血分数18%~29%,平均(22±4)%;术前QRS波≥120 ms;除病例5为持续性房颤,其余均为窦性心律。所有患者均符合CRT标准,入院后拟行CRT。表1
手术结果:6例患者经静脉行CRT失败,一周内择期行经胸左心室心外膜导线+经静脉心内膜右心导线,杂交行CRT和(或)CRT联合植入式心脏复律除颤器(CRT-D)。6例患者手术成功,左心室导线阈值(1.0±0.3)V/0.4 ms,植入位置见表2。手术后平均住院10.5天,无死亡。
经静脉行CRT不成功原因:放置左心室导管时,4例因导管未找到冠状窦开口,致冠状窦插管失败;1例因冠状窦开口异常,1例因静脉入路异常(永存左上腔静脉),而导致经静脉行CRT失败(失败原因详见表1)。
术后并发症:2例患者7天拆线后出院,其余4例患者分别因术后发热、血象高,或肝肾功能受损,而延长住院时间至10~14天,其中病例5在出院前,通过CRT-D体内除颤,房颤转复为窦性心律。6例患者均好转后出院。表2
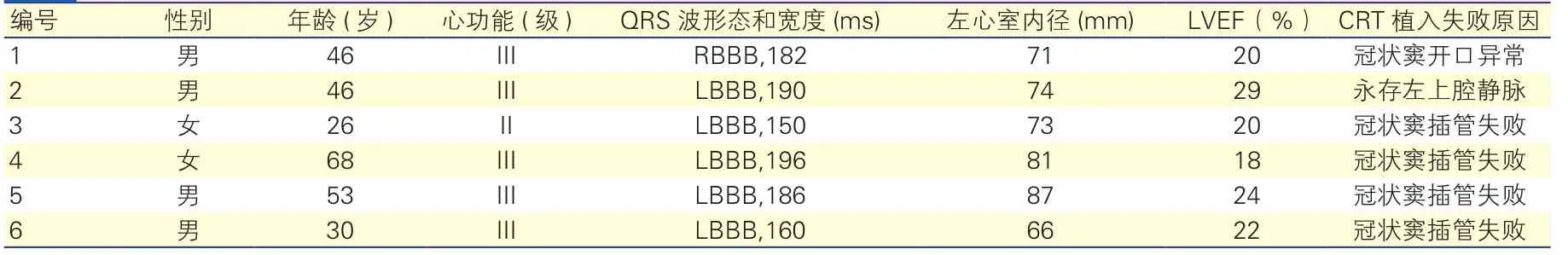
表1 6例患者基线临床特征及静脉植入心脏再同步治疗失败原因

表2 6例患者手术情况、并发症与住院时间
随访:①6例患者中,除例6术后QRS波较术前略增宽外,其他5例患者术后QRS波均有不同程度缩短(表3)。经随访3~18个月(平均10.5个月),6例患者均存活,例6因心衰恶化在CRT植入后6个月行心脏移植手术。②在出院后第1次随访时,6例患者双心室起搏百分比均超过95%。从NYHA来看,4例患者(例1、2、4、5)心功能改善了1级(即由III级为II级),2例患者(例3及例6)心功能无改善;复查超声心动图显示,3例(例1、2和5)患者左心室射血分数提高(10%以上),其中1例患者(例4)左心室射血分数增加(超过5%),2例患者(例3、6)左心室射血分数值无变化;2例患者(例2、5)左心室舒张末内径有所减小,3例患者(例1、4、6)左心室大小无明显变化,1例(例3)左心室舒张末内径有所增加(表3)。③6例患者中,有3例患者随访超过1年(例1、2和5),其中例1、例2患者心功能恢复为I级,例5心功能为II级;左心室射血分数值分别较术前提高24%(例1),18%(例2)和11%(例5)。
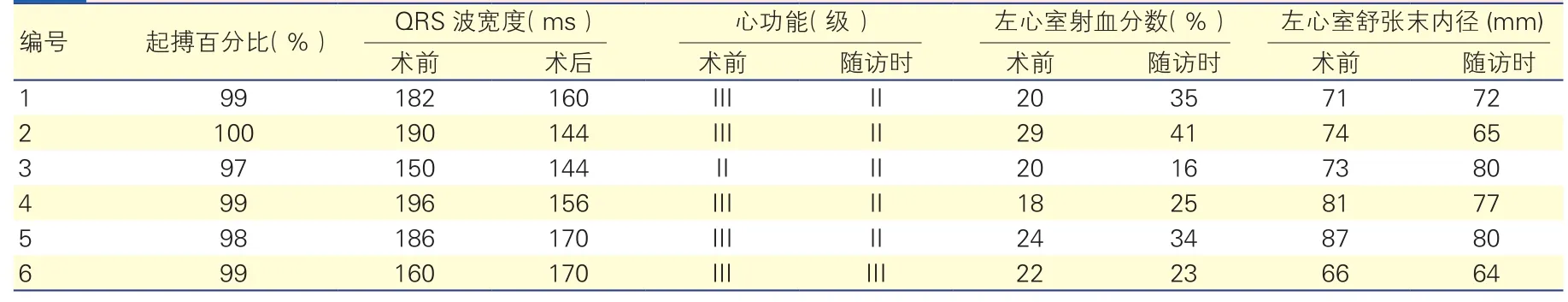
表3 6例患者术后QRS波变化以及第1次随访时心功能和超声心动图改变
3 讨论
随着循证医学的进展,CRT治疗慢性心衰的适应证越来越为广泛;而QRS波的宽度和形态在选择患者时具有非常重要的意义,很大程度决定了CRT的疗效。本研究中,6例患者病因均为扩张性心肌病,且QRS波均≥120 ms,其中5例为左束支传导阻滞,符合CRT植入的I类和IIa类适应证[3]。CRT植入中,左心室导线的放置是保证CRT疗效的关键,目前首选经冠状静脉窦将导线放置在左心室静脉分支而达到再同步的目的。早期经静脉放置左心室导线失败率较高,有报道超过20%;近些年随着CRT适应证的拓宽、技术的成熟,失败率降至8%~10%[4,7]。放置导线失败的常见原因包括解剖因素异常(例如上腔静脉闭塞、冠状静脉窦开口异常、右心房高度扩大、静脉狭窄和永存左上腔静脉等)和左心室导线相关问题(例如导线脱位,阈值过高和膈神经刺激)[4],本组6例患者经静脉植入左心室导线失败的原因全部为解剖因素异常,且4例均因冠状静脉窦插管失败所导致。
直视下心外科放置左心室导线是静脉植入失败时行CRT的选择之一,除此之外左心室心内膜起搏也是可供考虑的方案[4]。心外科放置左心室导线通常可采用经胸小切口的方法[6,8],此外还有通过胸腔镜或其他机器辅助的方法[5,9],手术成功率及围术期的预后相似[8]。目前关于外科手术放置左心室导线的研究很少,总体而言与经静脉方法相比,因患者需要全麻以及创伤较大,因此围术期并发症发生率较高[8],主要为感染和肾功能损伤;同时住院天数延长[10]。本研究中,6例患者在经冠状静脉窦植入左心室导线失败后,择期通过外科方法,先经胸小切口切开心包,放置左心室导线,术中阈值满意(均≤1.5 V/0.4 ms),且无膈神经刺激;随后再经静脉放置右心心内膜导线,通过皮下隧道,将导线与脉冲发生器相接,手术均成功,无术中并发症。术后并发症主要为肝功能异常和肾功能受损,无其他严重并发症及死亡,术后平均10.5天出院。由此可见,在静脉植入失败时,内外科杂交行CRT为安全有效的替代方法。还有学者建议,CRT植入手术应直接在杂交室进行,在经静脉放置左心室导线失败时立即可通过外科方法植入左心室导线,以减少住院时间,降低感染并发症,从而减少费用,获得最大的经济--效益比[11];但因缺乏大样本研究,目前尚无定论。
大规模临床研究已经证实CRT能够改善心衰患者的症状,提高生活质量,逆转左心室重构,增加左心室射血分数值,同时降低死亡率[3,12,13],但结果均来自经静脉行CRT的研究;近年有研究发现,外科方法放置左心室导线与经冠状静脉窦植入相比尽管围术期并发症略高,长期随访两组患者受益相似[6,8]。本组6例慢性心衰患者杂交行CRT后,经3~18个月随访,4例患者(占67%)心功能改善I级以上,这4例患者超声心动图左心室射血分数升高超过5%,其中2例患者伴有左心室舒张末内径缩小;且随着手术时间的延长,对心功能改善和增加左心室射血分数的作用持续存在,至1年随访时,左心室射血分数值较术前增加10%以上。由此可见,左心室心外膜起搏进行再同步治疗同样能够改善心衰患者的预后,与文献报道相符。
尽管CRT越来越多的应用于心衰患者,并大大改善了心衰患者的预后,然而仍有超过30%符合适应证的患者在CRT植入后没有得到获益(即CRT无反应)。本组6例患者中,从临床和超声两方面评价,2例患者(占33%)发生了“CRT无反应”:1例在术后3个月及6个月随访时,心功能无改善,超声心动图显示左心室射血分数及舒张末内径等参数均无好转;还有1例在行CRT6个月后因心衰恶化而行心脏移植。目前缺乏对于外科放置左心室导线行CRT的大样本研究,因此CRT治疗的无反应率以及预测因素尚不明确。有学者认为,因通过外科放置左心室导线不受血管条件影响,可将导线放置在“最佳”部位(多数为左心室侧壁/后侧壁),由此可能有益于提高CRT的“反应性”[8],但仍需要临床研究证实。分析本组发生无反应的2例患者时发现,其中1例患者左心室导线放置靠近心尖部,且术后QRS波宽度无缩短,术后6个月因心衰恶化而行心脏移植。大规模临床研究证实,经静脉行CRT时,左心室导线位置与患者的预后有关,左心室导线放置在靠近心尖部较非心尖部相比,心衰恶化和死亡的风险明显增加[14],因此本例患者术后发生“无反应”可能与导线位置有一定关系,应该在今后的临床工作中予以重视。
研究结果提示,虽然经静脉放置左心室导线是目前最为常用的行CRT的途径,但在因解剖异常而导致手术失败时,经胸小切口放置左心室心外膜导线是一种安全有效的替代方法;且通过杂交行CRT可以改善心衰患者的预后。本研究的不足之处在于样本量过小,为观察性研究,且未设立对照组与经静脉行CRT进行比较,因此对于通过杂交行CRT的长期疗效及其与常规经静脉方法对患者预后的影响,还需要大样本的对照研究证实。
[1] Farwell D, Patel NR, Hall A, et al. How many people with heart failure are appropriate for biventricular resynchronization? Eur Heart J, 2000, 21: 1246-1250.
[2] Bleeker GB, Schalij MJ, Molhoek SG, et al. Relationship between QRS duration and left ventricular dyssynchrony in patients with end-stage heart failure. J Cardiovasc Electrophysiol, 2004, 15: 544-549.
[3] Epstein AE, DiMarco JP, Ellenbogen KA, et al. 2012 ACCF/AHA/HRS Focused Update of the 2008 Guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol, 2013 , 61: e6-75.
[4] Daubert JC, Saxon L, Adamson PB, et al. 2012 EHRA/HRS expert consensus statement on cardiac resynchronization therapy in heart failure: implant and follow-up recommendations and management. Europace , 2012, 14: 1236-1286.
[5] Zhang HB, Meng X, Han J, et al. Minimally invasive video-assisted epicardial lead cardiac resynchronization therapy for the dilated cardiomyopathy heart failure cases. Innovations, 2010, 5: 345-348.
[6] Miller AM, Kramer DB, Lewis EF, et al. Event-Free Survival Following CRT with Surgically Implanted LV Leads Versus Standard Transvenous Approach. Pacing and Clin Electrophysiol, 2011, 34: 490-500.
[7] Abraham WT, Fisher WG, Smith AL, et al. Cardiac resynchronization in chronic heart failure. N Engl J Med, 2002, 346: 1845-1853.
[8] Ailawadi G, LaPar DJ, Swenson BR, et al. Surgically placed left ventricular leads provide similar outcomes to percutaneous leads in patients with failed coronary sinus lead placement. Heart Rhythm , 2010, 7: 619-625.
[9] DeRose JJ, Ashton RC, Belsley S, et al. Robotically assisted left ventricular epicardial lead implantation for biventricular pacing. J Am Coll Cardiol, 2003, 41: 1414-1419.
[10] Atoui R, Essebag V, Wu V, et al. Biventricular pacing for endstage heart failure : early experience in surgical vs. transvenous left ventricular lead placement. Interact Cardiovasc Thorac Surg , 2008, 7: 839-844.
[11] Quigley RL. A hybrid approach to cardiac resynchronization theray. Ann Thorac Cardiovasc Surg , 2011, 17: 273-276.
[12] Carvert M, Freemantle N, Cleland JG. Cardiac resynchronization therapy in heart failure. Ann Intern Med, 2005, 142: 305-307.
[13] Cleland JG, Daubert JC, Erdmann E, et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med, 2005, 352: 1539-1549.
[14] Singh JP, Klein HU, Huang DT, et al. Left ventricular lead position and clinical outcome in the multicenter automatic defibrillator implantation trial-cardiac resynchronization therapy (MADIT-CRT) trial. Circulation , 2011, 123: 1156-1159.
Analysis of Cardiac Resynchronization Therapy via Left Ventricular Epicardial Lead Insertion in 6 Patients
DAI Yan, CHEN Ke-ping, HUA Wei, CHEN Ruo-han, ZHANG Jing-tao, ZHANG Shu.
Department of Cardiology, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China Corresponding Author: CHEN Ke-ping, Email: chenkeping@263.net
Objective: To analyze the safety and eff i cacy of cardiac resynchronization therapy (CRT) via left ventricular (LV) epicardial lead implantation in chronic heart failure (CHF) patients who failed to coronary sinus lead insertion method.Method: We retrospectively studied 6 CHF patients who failed to coronary sinus lead insertion and received CRT implantation by hydride approach of epicardial LV minithoracotomy in our hospital from 2010-11 to 2013-01. We analyzed the pathogenesis, cardiac condition before, during and after the operation, examined ECG and echocardiography. The patients were fi rst followed-up at 3-6 months, and then every 6 months to observe the relevant changes.Results: All 6 patients received elective minithoracotomy for LV lead implantation within 1 week of the failed procedure, the pacing threshold was (1.0±0.3) V/0.4ms, the average in-hospital time was 10.5 days, there were no complication and death. During 3-18 (10.5) months follow-up period, 4 patients’ cardiac function improved for at least I degree, echocardiography showed that LVEF increased for at least 5% and 2 of them had decreased left ventricular end diastolic diameter. All patients survived, 1 received heart transplantation at 6 months after CRT implantation due to CHF worsening.Conclusion: CRT implantation by hydride approach of epicardial LV minithoracotomy is a safe and feasible alternation in patients who failed to coronary sinus lead insertion method, it may improve the cardiac function in CHF patients.
Heart failure; Cardiac resynchronization therapy; Epicardial lead; Surgery (Chinese Circulation Journal, 2014,29:44.)
2013-07-30)
(编辑:梅平)
100037 北京市,中国医学科学院 北京协和医学院 心血管病研究所 阜外心血管病医院 心律失常诊治中心
戴研 副主任医师 博士 主要从事起搏电生理专业的临床及科研工作 Email:daiy7516@sina.com 通讯作者:陈柯萍 Email:chenkeping@263.net
R541
A
1000-3614(2014)01-0044-04
10.3969/j.issn.1000-3614.2014.01.012
方法:选取2010-11至2013-01因慢性心衰住院行CRT,经心内科手术不成功而通过内、外科杂交行CRT的患者6例。对所有病例进行临床情况分析,包括病因、术前心功能状况、心电图和超声心电图结果、手术记录及术后情况;出院后定期随访,第1次随访为3~6个月,以后每半年随访1次,观察患者心功能、心电图以及超声心动图变化。
结果:6例患者经静脉行CRT失败后,1周内择期杂交行CRT/CRT联合植入式心脏复律除颤器(CRT-D),手术成功,左心室导线阈值( 1.0 ± 0.3)V/0.4 ms,无术中并发症;手术后平均住院10.5天,无严重并发症及死亡。随访3~18个月(平均10.5个月),其中4例患者心功能分级改善至少I级,且超声心动图显示左心室射血分数(LVEF)值增加至少5%,其中2例伴左心室舒张末内径缩小。6例患者均存活,1例因心衰恶化在CRT植入后6个月行心脏移植术。
结论:因解剖因素异常而导致经静脉行CRT失败时,经胸小切口放置左心室心外膜导线是一种安全有效的替代方法;且通过杂交行CRT可以改善心衰患者的预后。
