PI3K-Akt-eNOS信号通路在三磷酸腺苷后处理减轻兔心肌缺血再灌注损伤中的作用
2014-03-02高妮妮王芳廉哲勋
高妮妮,王芳,廉哲勋
基础与实验研究
PI3K-Akt-eNOS信号通路在三磷酸腺苷后处理减轻兔心肌缺血再灌注损伤中的作用
高妮妮,王芳,廉哲勋
目的:探讨磷酯酰肌醇-3激酶/蛋白激酶B/内皮型一氧化氮合酶(PI3K-Akt-eNOS)信号通路在三磷酸腺苷(ATP)后处理减轻兔心肌缺血再灌注损伤中的作用。
三磷酸腺苷;心肌缺血再灌注损伤;磷酯酰肌醇-3激酶/蛋白激酶B/内皮型一氧化氮合酶
(Chinese Circulation Journal, 2014,29:59.)
心肌梗死是冠心病死亡的主要原因。随着溶栓、急诊介入治疗、冠状动脉(冠脉)旁路移植术等血管再灌注疗法的应用,及时恢复缺血组织的供血可有效挽救濒死心肌[1]。但是,在成功恢复心脏血流的同时,随之而来的缺血再灌注损伤(IRI)会导致心肌代谢功能障碍,并且进一步加重结构破坏,造成二次损伤,甚至出现心律失常、梗死面积扩大。因此寻求再灌注时保护心肌的新靶点及药物至关重要。近年来,随着缺血再灌注损伤分子机制的研究不断深入,再灌注损伤挽救激酶在缺血再灌注损伤中的保护作用已逐渐明确。有研究表明,挽救激酶通路中的磷酯酰肌醇-3激酶/蛋白激酶B/内皮型一氧化氮合酶(PI3K-Akt-eNOS)信号通路介导了缺血后处理减轻心肌缺血再灌注损伤的作用[2]。我们前期实验表明,三磷酸腺苷(ATP)后处理可通过PI3KAkt信号通路减轻兔心肌缺血再灌注损伤[3],但其具体机制尚未明确。本实验通过复制兔急性心肌缺血再灌注损伤模型,于再灌注初期给予ATP及再灌注前分别给予PI3K阻断剂、线粒体ATP依赖性钾通道(mitoKATP)阻断剂,探讨PI3K-Akt-eNOS信号通路在ATP后处理减轻兔心肌缺血再灌注损伤中的作用,并推测其下游分子机制。
1 材料与方法
实验材料:本研究起始于2013-02至2013-04。健康新西兰大白兔48只,体重2.0~2.5 kg,由山东农业科学院提供[许可证号:SCXK(鲁)20100005]。磷酯酰肌醇-3激酶抑制剂(Wortmannin)、线粒体ATP依赖性钾通道抑制剂5-羟葵酸(5-HD)购于美国Sigma公司;ATP二钠注射液购于天津药业焦作有限公司,批号11101241;兔抗p-eNOS(ser1177),Bcl-2抗体,Bax抗体均购于北京博奥森生物技术有限公司;Tunel试剂盒购于德国Roche公司;苏木素伊红(HE)染液购于石家庄德萨商贸。
兔心肌缺血再灌注模型的建立及成功的标准:新西兰大白兔称重,25 %乌拉坦(5 mg/kg)腹腔注射,麻醉后仰卧位固定在实验台上,连接生理记录仪,全程记录标准肢体导联心电图。沿胸骨左缘剪断第3、4肋骨,无气胸开胸,暴露心脏,提起心包并剪开,在左心耳下确定冠脉左前降支位置,于左心室中上1/3水平用双股4-0号丝线钩绕该血管,以单股线结扎造成缺血(另一股线再灌注后用),结扎时用细小硬质胶管垫于血管与结扎线之间,结扎成功后,关闭胸腔,待40 min后重新打开,剪开结扎线,再灌注心肌180 min。 模型建立成功的标准:① 结扎后心电图Ⅱ导联ST-T段明显抬高,再灌注后抬高的ST-T段下降1/2以上;② 结扎后左心室前壁由红色明显变暗,再灌注成功时恢复为红色。
实验动物分组、再灌注方案:将48只健康新西兰大白兔随机分为4组,每组12只。① 缺血再灌注组(对照组): 结扎冠脉左前降支40 min,再灌注l80 min;②ATP后处理组: 结扎冠脉左前降支40 min,于再灌注开始时自耳缘静脉给予ATP(3 mg/kg),共持续30 min,持续再灌注180 min;③Wortmannin+ATP 后处理组(Wortmannin+ATP组):结扎冠脉左前降支40 min,再灌注开始前5 min静脉注射Wortmannin(0.6 mg/kg),再灌注开始时静脉给予ATP(3 mg/kg),共持续30 min,持续再灌注180 min;④ 5-HD+ATP后处理组(5-HD+ATP组):结扎冠脉左前降支40 min,再灌注开始前5 min静脉注射5-HD(5 mg/kg),再灌注开始时静脉给予ATP(3 mg/kg),共持续30 min,持续再灌注180 min。 每组12只实验兔中6只用于HE染色观察心肌病理组织变化,6只用于留取心肌组织进行细胞凋亡因子的检测和磷酸化蛋白(p-eNOS)的测定。
检测指标:灌注结束后,取适量缺血区左心室前壁全层心肌组织,4%多聚甲醛固定,常规脱水,透明,石蜡包埋,连续切片数张,供HE染色、TUNEL法检测心肌细胞凋亡指数、Bcl-2、Bax和p-eNOS测定。
形态学观察:将上述石蜡切片行HE染色,光镜下观察心肌细胞的病理改变。
TUNEL法心肌细胞凋亡的表达:采用TUNEL试剂盒检测各组标本心肌细胞的凋亡。按照试剂盒说明书操作。标记前用脱氧核糖核酸(DNA)酶处理切片做阳性对照,用标记液代替TdT酶反应液做阴性对照。每张切片随机选取10个视野 ,计数凋亡细胞个数和所有细胞个数,以凋亡细胞个数/所有细胞个数的百分比作为心肌细胞凋亡指数,反映各组心肌细胞凋亡的情况。
免疫组织化学检测心肌凋亡相关因子Bcl-2、Bax和p-eNOS蛋白的表达:应用与上述TUNEL法相同的组织蜡块切片行Bcl-2、Bax和p-eNOS蛋白免疫组织化学检测。一抗:1:200 PBS缓冲液稀释的Bcl-2、Bax抗体和p-eNOS抗体。具体步骤按SP试剂盒说明书操作,辣根过氧化物酶(DAB)显色,中性树脂封片。阳性表达细胞被染成棕黄色,Bax蛋白主要存在于胞浆内,部分在胞核,Bcl-2蛋白为核膜和胞浆表达,p-eNOS阳性细胞胞浆呈棕褐色。每张切片随机选取5个视野,统计阳性细胞数量和着色强度,取平均值,并采用公式:免疫组化评分(IHS)=A×B进行数据换算,A为阳性细胞数分级:0~1%=0,1~10%=1,10~50%=2,50~80%=3,80~100%=4;B为阳性细胞显色强度分级:0=阴性,1=弱阳性,2=阳性,3=强阳性。
统计学方法:采用SPSS 17.0统计软件,各项观察指标以表示,多组间比较采用单因素方差分析,组间两两比较应用q检验,以P<0.05为差异有统计学意义。
2 结果
各组光镜心肌组织学的改变:对照组(图1a)、Wortmannin+ATP组(图1c)、5-HD+ATP组(图1d)心肌细胞体积增大,细胞间质肿胀严重,细胞界限不清,横纹消失。ATP后处理组(图1b)心肌细胞核浓缩、变小减轻,心肌细胞及细胞间质轻度水肿,细胞界限相对清楚,心肌细胞排列相对规则。图1

图1 各组光镜心肌组组织学改变(箭头所指为心肌间质水肿)
各组心肌细胞凋亡指数比较 :对照组(图2a)、Wortmannin+ ATP组(图2c)、5-HD+ATP组(图2d),均可见较多TUNEL阳性凋亡细胞;ATP后处理组(图2b)心肌凋亡细胞明显减少。(图2)。ATP后处理组心肌细胞凋亡指数(12.17±3.49)%低于对照组(24.00±4.00)%、Wortmannin+ ATP组(24.33±5.16)%和 5-HD+ATP组(25.33 ±4.97)%,差异有统计学意义(P<0.01);对照组、Wortmannin+ ATP组、5-HD+ATP组三组间比较差异无统计学意义(P>0.05)。

图2 TUME法检测各组凋亡心肌细胞(箭头所指为凋亡细胞)
各组心肌组织凋亡相关因子Bcl-2和Bax表达及Bcl-2/Bax比值的比较:免疫组化分析显示,ATP后处理组与对照组、Wortmannin+ATP组和5-HD+ATP组相比,抗凋亡因子Bcl-2表达及Bcl-2/Bax比值升高,促凋亡因子Bax表达减低,差异均有统计学意义(P<0.01);对照组、Wortmannin+ ATP组、5-HD+ATP组3个组间比较,各项指标差异均无统计学意义(P>0.05)。表1
表1 免疫组化分析各组心肌组织凋亡相关因子及Bcl-2/Bax比值
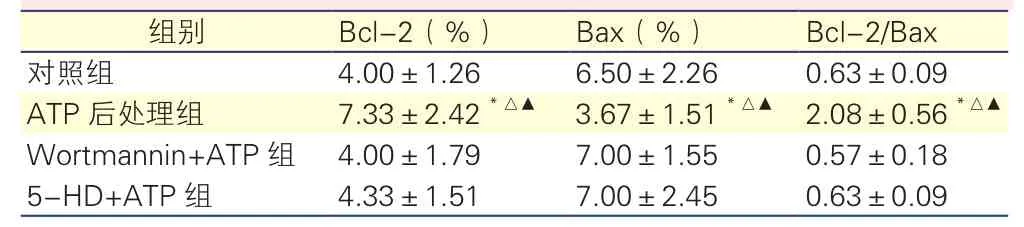
表1 免疫组化分析各组心肌组织凋亡相关因子及Bcl-2/Bax比值
注:与对照组比较*P<0.01 与 Wortmannin+ATP组比较△P<0.01 与5-HD+ATP组比较▲P<0.01。 余注见图1
组别 Bcl-2(%) Bax(%) Bcl-2/Bax对照组 4.00±1.26 6.50±2.26 0.63±0.09 ATP后处理组 7.33±2.42*△▲ 3.67±1.51*△▲ 2.08±0.56*△▲Wortmannin+ATP组 4.00±1.79 7.00±1.55 0.57±0.18 5-HD+ATP组 4.33±1.51 7.00±2.45 0.63±0.09
各组心肌组织p-eNOS蛋白的表达:免疫组化分析显示,心肌组织p-eNOS蛋白的阳性表达ATP后处理组 [(8.33±0.52)%](图3b)和5-HD+ATP组[(8.67±1.63)%] (图3d) 较对照组[(4.67±1.03)%] (图3a)和Wortmannin+ATP组[(4.17±0.98)%] (图3c)升高,差异有统计学意义(P<0.01);Wortmannin+ATP组与对照组、ATP后处理组与5-HD+ATP组比较差异无统计学意义(P>0.05)。图3

图3 免疫组化显示各组心肌细胞磷酸化蛋白表达( 箭头所指为阳性细胞)
3 讨论
再灌注损伤挽救激酶通路是目前研究较多的信号通路,包括磷脂酰肌醇-3激酶/蛋白激酶B(PI3K-Akt)和细胞外信号调节激酶(ERK1/2),在缺血再灌注时发心肌保护作用。其心肌保护机制包括三方面:阻止线粒体通透性转换孔(mPTP)开放;促进肌浆网对Ca2+的摄取;恢复抗细胞凋亡途径[4]。细胞凋亡减少可保护缺血再灌注损伤心肌[5]。PI3KAkt-eNOS信号通路已被证明是再灌注损伤挽救激酶信号传导通路的组成之一[6]。活化的Akt主要通过磷酸化eNOS促进内源性NO生成,激活核糖体蛋白S6激酶(p70S6K),磷酸化糖原合成激酶-3β(GSK-3β)等,最终增加钾离子通道开放进而保护缺血再灌注损伤心肌[7]。研究表明,大鼠eNOS基因的过度表达可在心肌缺血再灌注后起心脏保护作用[8,9],敲除eNOS基因的小鼠异氟烷再灌注损伤保护作用消失[10]。本实验在心肌再灌注即刻给予ATP后处理,eNOS磷酸化水平明显增加同时缺血再灌注损伤减轻,证明eNOS在缺血再灌注损伤中发挥保护作用。
1992年Gross等[11]首先提出ATP敏感性钾通道( KATP)与缺血预处理(IP)有关,依据是格列本脲(glibenclamide,非选择性KATP通道阻断剂)可以阻断IP的心脏保护作用。已知心肌细胞中存在两种KATP通道,即线粒体KATP通道和心肌细胞膜KATP通道(sarcKATP)。Mykytenko等[12]通过分别给予线粒体及胞膜KATP阻断剂发现,线粒体KATP通道而并非sarcKATP开放在缺血后处理的心肌保护作用中发挥作用。本实验中给予线粒体KATP通道阻断剂5-HD后,ATP的心肌保护作用同时被阻断。后处理的信号转导途径中eNOS与线粒体KATP通道间的相关性尚未明确。但细胞水平的研究发现NO可激活线粒体KATP通道,推测线粒体KATP通道可能是eNOS 的下游途径,eNOS 通过直接增加线粒体KATP通道的开放而最终导致心脏保护作用[13]。
我们前期试验证实ATP可激活再灌注损伤挽救激酶通路,使Akt磷酸化增多,发挥心肌保护作用[2]。本实验中ATP后处理显著减轻缺血再灌注心肌水肿,减少心肌细胞凋亡,同时eNOS磷酸化表达增加,此作用可被PI3K阻断剂wortmannin阻断,提示ATP后处理可能通过激活PI3K-Akt信号通路,诱导增加磷酸化eNOS 蛋白表达而发挥心肌保护作用。此外,应用线粒体KATP通道阻断剂5-HD并未影响ATP磷酸化eNOS的作用,但消除了其心肌保护作用,从侧面反应了线粒体KATP通道可能是eNOS的下游途径。已知ATP在体内迅速代谢为腺苷,Yang等[14]研究证实腺苷可通过激活PI3K、ERK1/2及NOS缩小心肌梗死面积。因此本研究推测,ATP后处理可能通过代谢为腺苷,激活挽救激酶通路中的PI3K-Akt,而后使下游分子eNOS磷酸化,促进mitoKATP开放,从而产生心肌保护。本研究结果发现与对照组相比,ATP后处理组抗凋亡因子Bcl-2显著升高,促凋亡因子Bax减低,Bcl-2/Bax比值较对照组明显升高,这一作用可被Wortmannin及5-HD阻断。因此推测ATP通过激活PI3K-Akt-eNOS信号通路作用于线粒体KATP通道,最终可能通过抑制细胞凋亡发挥心肌保护作用。
综上所述,ATP通过激活PI3K-Akt-eNOS信号通路,促进内源性NO生成,然后激活线粒体KATP通道,减少兔心肌缺血再灌注导致心肌细胞的凋亡,减轻缺血再灌注损伤。由于ATP在体内可迅速代谢为腺苷起作用,具有廉价、起效快、安全性高等特点,且药物后处理又弥补了缺血预处理无法预测心肌梗死发生时间等缺点,因此在应用于急性心肌梗死方面可能更加实用。本实验探讨了ATP后处理对兔缺血再灌注损伤的心肌保护作用,为防治心肌缺血再灌注后损伤提供了理论依据。本研究PI3K-AkteNOS 信号通路中仅测定eNOS磷酸化蛋白表达,如能测定该通路各相关因子及应用eNOS拮抗剂干预,观察心肌细胞凋亡情况,结论将更具说服力。
[1]张鹏程,柯永胜.心肌缺血再灌注损伤进展.国际老年医学杂志,2010,5:210-214.
[2]Li XD, Yang YJ, Geng YJ, et a1. Phosphorylation of endothelial NOS contributes to simvastatin protection against myocardial no-reflow and infarction in reperfused swine hearts: partially via the PKA signaling pathway.Acta Pharmacol Sin, 2012, 33: 879-887.
[3]王芳,廉哲勋,李妮妮,等.三磷酸腺苷后处理对兔心肌缺血再灌注损伤保护作用的研究.中华老年心脑血管病杂志, 2012, 12:1308-1311.
[4]赵亚玲, 敖虎山. 心肌缺血再灌注损伤的研究进展. 中国循环杂志, 2011, 26: 396-398.
[5]赵艳艳,李运伟,王全河,等. 心肌细胞内Livin蛋白过表达对大鼠心肌缺血再灌注中细胞凋亡的影响.中国循环杂志,2010,25:309-312.
[6]Tsang A, Hausenloy DJ, Mocanu MM, et al. Postconditioning:a form of “modified reperfusion”protects the myocardium by activating the phosphatidylinositol - 3-kinase-akt pathway. Circ Res, 2004, 95: 230-232.
[7]Sumi S, Kobayashi H, Yasuda S, et al. Postconditioning effect of granulocyte colony-stimulating factor is mediated through activation of risk pathway and opening of the mitochondrial KATP channel. Am J Physiol Heart Circ Physiol, 2010, 299: H1174-H1182.
[8]Jones SP,Greer JJM,Kakkar AK, et a1. Endothelial nitric oxide synthase overexpression attenuates myocardial reperfusion injury. Am J Physiol Heart Circ Physiol,2004,286: H276-282.
[9]Brunner F, Maier R,Andrew P, et a1.Attenuation of myocardial ischemia/reperfusion injury in mice with myocyte-specific overexpression of endothelial nitric oxide synthase.Cardiovasc Res,2003,57: 55-62.
[10]Ge ZD, Pravdic D, Bienengraeber M, et al. Isoflurane postconditioning protects against reperfusion injury by preventing mitochondrial permeability transition by an endothelial nitric oxide synthasedependent mechanism. Anesthesiology, 2010 , 112: 73-85.
[11]Gross GJ,Auchampach JA.Blockade of ATP-sensitive potassium channels prevents myocardial preconditioning in dogs. Circ Res,1992,70: 223-233.
[12]Mykytenko J, Reeves JG, Kin H, et al. Persistent beneficial effect of postconditioning against infarct size: role of mitochondrial K(ATP) channels during reperfusion. Basic Res Cardiol, 2008, 103: 472-484.
[13]Sasaki N, Sato T, Ohler A,et al. Activation of mitochondrial ATP-dependent potassium channels by nitric oxide. Circulation, 2000, 101: 439-445.
[14]Yang XM, Krieg T, Cui L, et al. NECA and bradykinin at reperifusion reduce infarction in rabbit hearts by signaling through PI3K, ERK, and NO. J Mol Cell Cardiol, 2004, 36: 411-421.
ATP Post Conditioning of PI3K-Akt-eNOS Signaling Pathway Reducing the Myocardial Ischemia Reperfusion Injury in Experimental Rabbits
GAO Ni-ni, WANG Fang, LIAN Zhe-xun.
Department of Cardiology, The Aff i liated Hospital of Qingdao University Medical College, Qingdao (266003), Shandong, China
LIAN Zhe-xun, Email: lianzhexun@medmail.com.cn
Objective: To explore the effect of adenosine-5'-triphosphate (ATP) post conditioning of PI3-kinase-Akt-endothelial nitric oxide synthase (PI3K-Akt-eNOS) signaling pathway reducing the myocardial ischemia reperfusion injury (IRI) in experimental rabbits.Methods:The IRI model was established in New Zealand white male rabbits and the animals were divided into 4 groups. ① Control group, the rabbits with ischemia reperfusion (IR),② ATP group, IR rabbits received ATP post conditioning, ③ Wortmannin+ATP group, IR rabbits were treated with PI3-kinase inhibitor wortmannin and ATP postconditioning, ④5-HD+ATP group, IR rabbits were treated with mitochondria ATP-dependent K+channel (mitoKATP) pathway inhibitor 5-HD and ATP post conditioning. The myocardial pathological changes were observed by HE staining, the myocardial cell apoptosis was determined by TUNEL method, the protein expressions of Bcl-2, Bax, the ratio of Bcl-2/ Bax and p-eNOS were examined by immuno-histochemistry method.Results:Compared with Control group, the ATP group showed less smaller of myocardial cell nuclear and tissue edema, reduced apoptosis index and increased ratio of Bcl-2/Bax, all P<0.01. In both Wortmannin+ATP group and 5-HD+ATP group, the size of myocardial cell nuclear and the condition of tissue edema were similar to Control group, the myocardial cell apoptosis index and the ratio of Bcl-2/Bax were similar to Control group, P>0.05. Compared with Control group and Wortmannin+ATP group, the p-eNOS protein positive expression was significantly increased in ATP group, P<0.01 and it was similar to 5-HD+ATP group, P>0.05.Conclusion: ATP post conditioning may activate PI3K-Akt-eNOS signaling pathway, work on mitoKATP pathway, to reduce cell apoptosis and IRI in experimental rabbits.
Adenosine-5'-triphosphate; Myocardial ischemia reperfusion injury; PI3k/protein kinase B/endothelial nitric oxide synthase
2013-09-04)
(助理编辑:曹洪红)
266003山东省青岛市,青岛大学医学院附属医院心内科(高妮妮 、廉哲勋);266041青岛市第三人民医院心内科(王芳)
高妮妮硕士研究生主要研究方向为冠心病的介入性诊断及治疗Email:gaoniniok@163.com通讯作者: 廉哲勋
Email:lianzhexun@medmail.com.cn
R541
A
1000-3614(2014)01-0059-05
10.3969/j.issn.1000-3614.2014.01.016
方法:建立兔心肌缺血再灌注模型,随机将动物分为4组:即缺血再灌注组(对照组)、ATP后处理组、磷酯酰肌醇-3激酶抑制剂(Wortmannin)+ATP后处理组(Wortmannin+ATP组)、线粒体ATP依赖性钾通道抑制剂5-羟葵酸(5-HD)+ATP后处理组(5-HD+ATP组)。再灌注结束后,苏木素伊红染色法观察心肌病理组织变化、TUNEL法检测心肌细胞凋亡指数,免疫组化方法检测心肌Bcl-2、Bax蛋白表达、Bcl-2/Bax比值及磷酸化eNOS(p-eNOS)蛋白表达。
结果: ATP后处理组心肌细胞核变小及细胞间质水肿程度较对照组明显减轻,Wortmannin+ATP组和5-HD+ATP组心肌细胞核大小及细胞间质水肿程度与对照组相似;ATP后处理组与对照组比较,心肌细胞凋亡指数明显减低,抗凋亡因子Bcl-2表达及Bcl-2/Bax比值升高,差异均有统计学意义(P<0.01);Wortmannin+ATP组和5-HD+ATP组心肌细胞凋亡指数、Bcl-2/Bax比值与对照组比较差异无统计学意义(P>0.05);p-eNOS蛋白阳性表达ATP后处理组较对照组和Wortmannin+ATP组显著增高,差异有统计学意义(P<0.01),与5-HD+ATP组比较差异无统计学意义(P>0.05)。
结论: ATP后处理可能通过激活PI3K-Akt-eNOS信号通路最终作用于线粒体ATP依赖性钾通道,减少细胞凋亡,减轻兔缺血再灌注损伤。
