山羊肺泡巨噬细胞分离培养及脂多糖诱导形态学观察
2014-03-02惠文巧汤继顺侯宏艳
惠文巧,班 谦,汤继顺,侯宏艳,陈 胜
(1.安徽省农业科学院畜牧兽医研究所,合肥 230031;2.安徽大学生命科学学院,干细胞及转化医学研究中心)
山羊肺泡巨噬细胞分离培养及脂多糖诱导形态学观察
惠文巧1,班 谦2,汤继顺1,侯宏艳1,陈 胜1
(1.安徽省农业科学院畜牧兽医研究所,合肥 230031;2.安徽大学生命科学学院,干细胞及转化医学研究中心)
肺泡巨噬细胞是宿主天然免疫和特异性免疫的重要执行者。目前关于山羊肺泡巨噬细胞体外分离培养的方法尚未见报道。文章从健康无病变的羔羊肺脏灌洗液中分离肺泡巨噬细胞,并加50 μg/mL的脂多糖进行诱导刺激。结果显示:肺泡巨噬细胞分离纯度较高,不发生增殖,体外可维持30 d左右,经脂多糖诱导细胞出现聚集和增大现象。表明山羊肺泡巨噬细胞体外维持时间较长,脂多糖诱导实验初步证实其具备免疫学功能,为进一步利用山羊肺泡巨噬细胞进行免疫学机制研究和疾病治疗提供了依据。
山羊;肺泡巨噬细胞;分离培养;脂多糖
肺泡巨噬细胞作为单核-巨噬细胞成员之一,是由血液中单核细胞迁移到肺泡间隔后演变而来[1]。它是肺部最早接触病原微生物的免疫防御细胞之一,具有多种生物学功能,是宿主天然免疫和特异性免疫的重要执行者。在非特异性免疫中,肺泡巨噬细胞能够吞噬、清除自呼吸道侵入机体的外源微生物,同时还可介导炎性反应;在特异性免疫方面,主要发挥免疫调节功能[1-3]。作为肺脏抗病原感染的首道防线,肺泡巨噬细胞是研究机体自然感染和获得性免疫的良好模型。
目前,有关肺泡巨噬细胞分离培养方法的报道多见于小型哺乳动物,如小鼠[4-6]、大鼠[7]等,在大型家畜如绵
羊[8]、猪[9-11]、牛[12]、水牛[13]也有报道,而关于山羊肺泡巨噬细胞的分离培养尚未见报道。本研究通过分离山羊肺泡巨噬细胞,同时用脂多糖诱导观察其形态变化,为后期建立山羊肺炎支原体感染肺泡巨噬细胞模型及其免疫学机制研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 实验羊为2月龄健康羔羊,购自合肥市肥东县富旺镇某养殖户。
1.1.2 试剂 特级胎牛血清(FBS)、DMEM、0.25%胰酶、青链霉素、PBS均为GIBCO公司产品。培养液配制为10%完全培养液:DMEM/F12培养液44 mL+胎牛血清5 mL+双抗(1万单位)1 mL;冻存液:70%DMEM/F12培养液+20%胎牛血清+10%二甲基亚砜。
1.1.3 仪器设备 CO2培养箱(ThermoScientific,美国),生物安全柜(AB2-4S1,ESCO,新加坡),荧光显微镜(BX53,OLMPUS,日本)。
1.2 方法
1.2.1 山羊肺泡巨噬细胞分离 处死实验羔羊,置于无菌解剖台上,剖开胸腔,经肉眼观察肺脏健康无病变后,结扎气管,取出带气管的完整肺脏,用含有青链霉素的PBS清洗肺脏表面,清除血块等污物;同时用50 mL注射器通过气管注入PBS至肺部,轻轻拍打并按摩肺脏表面5 min,同上重复灌洗2次,轻轻拍打肺脏后静置2 min,收集100 mL灌洗液,用单层无菌100目不锈钢细胞筛过滤,收集灌洗液后15 000 r/min离心5 min,留沉淀。再用含有双抗的PBS清洗,10 000 r/min离心5 min,留沉淀,即得肺泡巨噬细胞。
1.2.2 细胞计数 取1 mL细胞悬液与1 mLpH值7.4的PBS溶液混匀,1 min后在血细胞计数板上进行计数,计算山羊肺泡巨噬细胞数量。
1.2.3 原代细胞培养 加入10%胎牛血清的DMEM培养液(加培养液前将培养液在37℃、5%CO2培养箱中预热10~15 min),将获得的肺泡巨噬细胞稀释至整细胞浓度至4×105个/mL,按2 mL/孔接种于6孔培养板,同时将细胞浓度调整为1×106个/mL,置于50 mL培养瓶内,于37℃、5%CO2培养箱中培养8 h。8 h后,从培养箱取出培养瓶和培养板,弃旧培养液,以去掉少数未贴壁的细胞,加入PBS清洗2次,更换10%完全培养液,2 mL/孔,置于37℃、5%CO2培养箱继续培养,24 h后更换培养液,以后每72小时换液一次。
1.2.4 脂多糖刺激肺泡巨噬细胞形态学观察 实验加入LPS终浓度为50 μg/mL,37℃条件下诱导培养6 h,弃旧培养液后加入PBS洗去未贴壁细胞,用倒置显微镜观察巨噬细胞细胞形态变化及生长状况,并进行细胞计数。
2 结果
2.1 山羊肺泡巨噬细胞培养特性
由图1可见,分离到的山羊肺泡巨噬细胞纯度较高,均呈圆形、椭圆形状,有的伸出伪足(图1-A),未见到梭状等其他上皮细胞形态,高倍镜下其形态学尤为明显,看到典型的突起状(图1-B)。整个培养过程中,未出现细胞增殖现象,且细胞在体外培养30 d内均未出现大规模死亡现象。
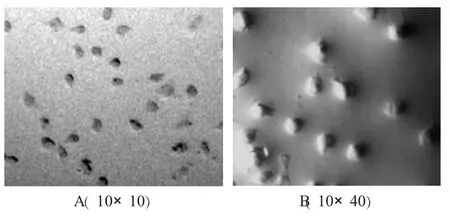
图1 山羊肺泡巨噬细胞培养特性
2.2 脂多糖LPS诱导山羊肺泡巨噬细胞形态学观察
脂多糖LPS诱导山羊肺泡巨噬细胞形态学观察见图2。同正常组相比(图2-B),LPS诱导6 h后,山羊肺泡巨噬细胞生长模式发生了明显改变,出现聚集和增大现象(图2-A),部分细胞增大尤为明显,且细胞数量有所减少。

图2 LPS诱导6 h后山羊肺泡巨噬细胞形态学观察
3 讨论
3.1 肺泡巨噬细胞分离培养
研究表明,人类和动物气管肺泡灌洗液中,肺泡巨噬细胞计数最多,可占全部细胞总数的80%[14]。因此,动物实验获取肺泡巨噬细胞的关键在于肺泡灌洗液的收集。
关于肺泡巨噬细胞的分离,诸多文献均采用从气管冲入灌洗液PBS至肺脏,进而收集灌洗液这一方法[8-10],但具体操作方法和步骤也不尽相同,主要体现在灌洗液的温度、剂量、清凉程度等,最终导致收集到的含有肺泡巨噬细胞灌洗液的纯度和含量出现差异。本实验提取肺泡巨噬细胞的方法关键在于以下几点:①本实验采用的是常温下的PBS灌洗,更接近于动物体温,从而有利于细胞分离和获得;②本实验获取的肺泡灌洗液清亮,不含血丝及其他胶原粘性组织,这在一定程度上保证了巨噬细胞的纯度。获得的肺泡巨噬细胞经形态学观察,具有体内巨噬细胞的典型特征,且纯度较高,不发生增殖,体外生长可维持30d左右。这可能与以上具体操作方法有关。
3.2 脂多糖诱导形态学观察
脂多糖是革兰氏阴性菌细胞壁外膜的主要成分,是细菌最主要的致病毒素,通过与肺泡巨噬细胞表面的TLR4结合启动炎症信号级联反应,释放各类炎症因子,从而导致细胞受损[15]。本实验获得的肺泡巨噬细胞经脂多糖刺激后,出现大量的巨噬细胞聚集和增大现象,表明巨噬细胞能够发挥其功能,具有一定的活性。另外,本研究还发现,经脂多糖诱导后,巨噬细胞生长模式发生明显改变,细胞生长速度下降,细胞数量减少,这与卿城[15]的报道一致。这可能是因为在脂多糖的刺激下,细胞表面释放各类炎性因子,从而导致细胞受损,其具体作用机制还有待进一步分析。
综上,本研究获得的肺泡巨噬细胞纯度高、活性好,可为后续建立山羊肺炎支原体感染肺泡巨噬细胞模型及其免疫学机制研究奠定基础。
[1]FelsAO,Cohn ZA.Thealveolar macrophage[J].J Appl Physiol,1986,60:353-369.
[2]LambrechtBN.Alveolar macrophage in the driver’s seat[J].Immunity, 2006,24:366-368.
[3]Balhara J,Gounni A S.The alveolar macrophages in asthma:a doubleedged sword[J].Mucosal Immunology,2012,5(6):605-609.
[4]邹丹,全宏勋,胡群员.小鼠肺泡巨噬细胞的提取、纯化及活性检测[J].中国公共卫生,2003,19(9):1087-1088.
[5]ZhangX,Goncalves R,Mosser DM.The isolation and characterization of murine macrophages[EB/OL].http:www.ncbi.nlm.nik.gov/pubmed/ 19016445.CurrentProtocolsinImmunology,2008:14.1.1-14.1.14.
[6]Sato-Nishiwaki M,Aida Y,Abe S,et al.Reduced number and morphofunctional change of alveolar macrophages in MafB gene-targeted mice[J].Plos One,2013,8(9):e73963.
[7]Zhao Z J,Zhang J,Wei J,et al.Lower expression of inducible nitric oxide synthase and higher expression of arginase in rat alveolar macrophages are linked to their susceptibility to toxoplasma gondii infection[J].Plos One,2013,8(5):e63650.
[8]盛金良,陈创夫,郑永峰,等.绵羊肺泡巨噬细胞的分离培养和形态学观察[J].石河子大学学报:自然科学版,2007,25(1):51-54.
[9]杨克礼,田永祥,梁望旺,等.猪肺泡巨噬细胞的分离与原代培养[J].国外畜牧学—猪与禽,2011,31(4):52-53.
[10]王贵平,刘福林,刘建,等.从屠宰猪肺中分离培养猪肺泡巨噬细胞[J].养猪,2013,2:123-124.
[11]CaoJ,Grauwet K,Vermeulen B,et al.Suppression ofNKcell-mediated cytotoxicity against PRRSV-infected porcine alveolar macrophages in vitro[J].Veterinarymicrobiology,2013,164(3):261-269.
[12]徐广贤,赵德明,周向梅,等.牛结核分枝杆菌Mce4E蛋白对牛肺泡巨噬细胞iNOs、TNF-α、IL-6和IL-12表达的影响[J].中国农业大学学报,2007,12(1):1-6.
[13]韩忠燕,黄海愉,沈前程,等.水牛肺泡巨噬细胞的分离、培养及鉴定[J].广西农业科学,2010,41(7):719-722.
[14]Pribul P K,Harker J,Wang B,et al.Alveolar macrophages are a major determinant of earlyresponses toviral lunginfection but do not influence subsequent disease development[J].J Virol,2008,82(9):4441-4448.
[15]卿城.miR-21在脂多糖诱导的肺泡巨噬细胞中的动态表达及其与TNF-α的相关性分析[D].南昌:南昌大学,2013.
S858.27
A
2095-3887(2014)05-0046-03
10.3969/j.issn.2095-3887.2014.05.014
2014-07-07
安徽省农业科学院博士启动基金项目;安徽省农业科学院院长杰出青年基金项目(14B0403)
惠文巧(1986-),女,博士。
陈胜(1974-),男,副研究员,硕士,主要从事肉羊遗传育种与繁殖技术研究。
