反刍动物瘤胃甲烷生成机制及调控措施研究进展
2014-03-01乔升民乔君毅谭支良
乔升民,乔君毅,谭支良
(1.山西省阳泉市平定县畜牧业发展中心,平定 045200;2.中国科学院研究生院,北京 100049;3.中国科学院亚热带农业生态研究所,长沙 410125)
反刍动物瘤胃甲烷生成机制及调控措施研究进展
乔升民1,乔君毅2,3,谭支良3
(1.山西省阳泉市平定县畜牧业发展中心,平定 045200;2.中国科学院研究生院,北京 100049;3.中国科学院亚热带农业生态研究所,长沙 410125)
甲烷不仅是一种重要的温室效应气体,而且在反刍动物瘤胃内甲烷的生成是饲粮能量损失的主要原因。因此,抑制甲烷的生成对提高反刍动物能量利用率和环境保护均具有重要意义。文章对反刍动物瘤胃中甲烷产生的生物学意义、生成机制和调控措施进行了综述。
甲烷;反刍动物;甲烷生成机制;抑制剂;生物学意义
甲烷是一种重要的温室效应气体,对全球气候变暖起着不可忽略的作用。据报道,全球反刍动物每年产生600万t甲烷,占甲烷排放总量的28%[1]。此外,在反刍动物代谢过程中,瘤胃内甲烷的生成是饲料能量损失的主要原因,占到2%~12%。因此,有效抑制反刍动物甲烷排放量不仅能缓解温室效应,而且还可提高饲料利用率。
1 瘤胃中甲烷生成的生物学意义
反刍动物能够通过瘤胃中的微生物发酵利用纤维素、半纤维素等结构性碳水化合物和果胶,生成机体所需的各种营养物质,在此过程中产生大量的CO2、H2、甲酸、乙酸和甲醇。甲烷菌能够分别利用这些物质生成甲烷。其中,甲烷菌利用CO2和H2生成甲烷时,主要是通过种间氢传递将其合成甲烷,降低瘤胃内的氢分压,提高纤维分解菌的活性。此外,甲烷菌的存在对原虫(主要是纤毛虫)的生存也是有益的,瘤胃原虫表面和内部存在着大量的甲烷菌,原虫和甲烷菌之间也发生着种间氢传递,在原虫的细胞膜内壁结合着许多种脱氢酶,催化各自的底物脱氢,生成NADH。同时,在原虫的细胞内有一个亚细胞结构:氢化酶体,氧化NADH释放H2。如果瘤胃内H2积累过多会影响原虫的生长活性,而甲烷菌能利用氢气生成甲烷,降低瘤胃中的氢分压,有利原虫的生长。当甲烷菌与原虫共同培养时,原虫的发酵及其ATP的生成都大大加速,能量的利用率提高。
2 瘤胃中甲烷的生成机制
2.1 瘤胃中甲烷菌的种类
甲烷菌是一类能将无机化合物或有机化合物厌氧发酵转化成甲烷的古细菌,存在于湖泊、沼泽、海洋沉积物及反刍动物的瘤胃等自然生态系统中。目前从反刍动物瘤胃中分离出来的甲烷菌主要有甲烷杆菌属(Methanobacterium)、甲烷短杆菌属(Methanobrevibacter)、甲烷微菌属(Methanomicrobium)和甲烷八叠球菌属(Methanosarcine)[2-5]。随着生物技术的发展和应用,瘤胃内越来越多的甲烷菌属将被发现。
2.2 生成机制
研究发现,在反刍动物的瘤胃内,甲烷菌能够利用
CO2、甲酸、乙酸和甲醇作为底物生成甲烷,但是这些物质在瘤胃中生成甲烷的机制并不十分明确。根据瘤胃中存在的甲烷菌种类以及它们利用的底物,可能存在4种合成甲烷的机制,分别是CO2还原路径、乙酸异化路径、甲酸氧化路径和甲醇不成比例的分化路径。
2.2.1 CO2还原路径 CO2在一系列酶和辅酶的作用下传递C基团相继生成中间体甲酰甲烷呋喃、甲酰四氢甲烷蝶呤、甲川四氢甲烷蝶呤、亚甲基四氢甲烷蝶呤、甲基四氢甲烷蝶呤、甲基辅酶M,最后生成甲烷(见图1)。参与的辅酶主要有:F420、F430、辅酶B和辅酶M。其中,辅酶F420是甲烷菌细胞质中的电子载体,辅酶B是甲基辅酶M还原生成甲烷的电子供体,F430因子是甲基辅酶M还原酶(MCR)特有的辅基。
2.2.2 甲酸氧化路径 甲酸氧化路径总体上分为两步:第一步,甲酸在甲酸脱氢酶的作用下转化成CO2和H2;第二步,生成的CO2进入到CO2还原路径产生甲烷。
2.2.3 乙酸异化路径 乙酸在乙酸激酶和磷酸转移酶的作用下首先生成乙酰辅酶A,然后乙酰辅酶A通过CO脱氢酶/去碳基甲酰化酶复合物的催化,甲基和羧基分别生成甲基四氢甲烷喋呤和CO,最终四氢甲烷喋呤在辅酶M甲基转移酶和甲基辅酶M甲基还原酶的催化作用下生成甲烷(见图2)。在生成甲烷的过程中参与的辅酶主要包括辅酶A、辅酶M和辅酶B。

图2 乙酸异化路径
2.2.4 甲醇不成比例的分化路径 在瘤胃中,饲粮中的果胶甲酯在果胶甲酯酶的催化作用下分解成甲醇,甲醇在甲醇/辅酶甲基转移酶系统的作用下,生成甲基辅酶M。一部分甲基辅酶在一系列酶的作用下氧化生成CO2,另一部分还原生成甲烷(见图3)。
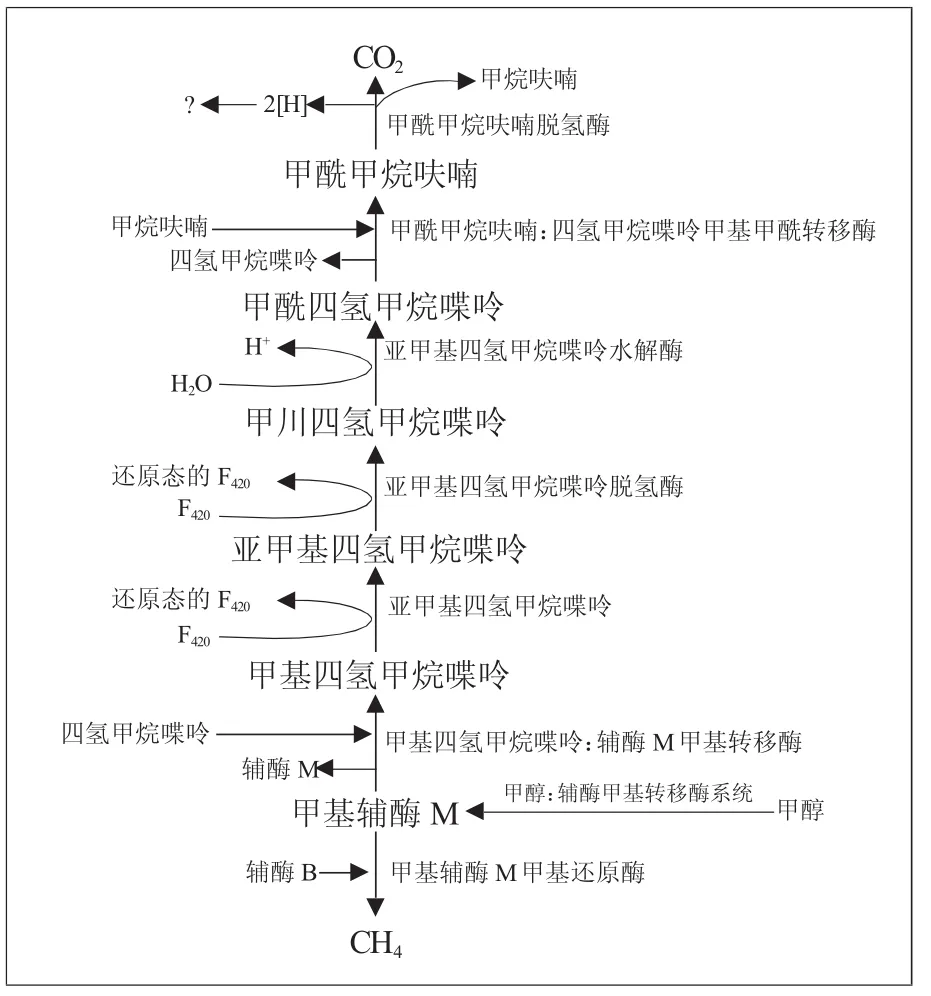
图3 甲醇不成比例的分化路径
3 反刍动物瘤胃甲烷生成的调控
适当减少反刍动物甲烷的生成和排放,具有经济和环境双重效益。目前,营养学家研究的重点主要是通过在饲粮中添加添加剂对瘤胃甲烷菌生成甲烷的过程进行调控,这种调控主要通过3种模式:一种是直接抑制甲烷菌的生长,降低甲烷菌的活性或减少甲烷菌的数量;另一种是通过减少生成甲烷的底物或通过替代性氢气受体争夺氢气而减少甲烷生成量;第三种是直接抑制参
与甲烷合成过程关键酶的活力。
3.1 抗生素
抗生素作为饲料添加剂能影响瘤胃甲烷的生成,但是效果并不一致。目前,已经清楚离子载体类抗生素可抑制甲烷的生成。离子载体主要包括莫能菌素、盐霉素和拉沙里菌素等,它们主要通过3种方式减少甲烷的排放:①通过影响瘤胃微生物(主要指纤维降解菌)细胞膜的通透性减少微生物的数量或者改变微生物代谢活动来减少生成甲烷底物的数量;②减少原虫的数目,直接减少生成甲烷底物的数量和间接减少了甲烷菌的数目;③改变瘤胃发酵模式,提高饲料的利用率来相对减少甲烷的生成。Fuller等[6]在体外试验中,把莫能菌素和拉沙里菌素添加到以谷物为主的培养基中,可以使甲烷的排放量减少到53%,但这个结果与Callawa等[7]报道的并不一致。Scott等[8]在奶牛日粮中添加一定数量的莫能菌素,但甲烷的排放总量并没有减少。出现这种情况可能有3种原因:一是添加莫能菌素的数量不足,不能够改变瘤胃微生物的代谢活动;二是饲喂的时间比较短,微生物区系没有发生改变;三是动物的日粮组成不同。但是也有研究报道,在饲粮中添加抗生素虽然可以提高饲料的利用率、减少甲烷的排放量,但降低了动物的采食量。因此,有人提出了添加抗生素抑制甲烷的生成主要是降低了动物的采食量[9]。
3.2 细菌素
细菌素是由细菌产生的肽类或蛋白质复合物,是细菌在特定生长环境中与其他生物竞争的武器,其在调控瘤胃微生态中起到有益的作用。Kalmakoff等[10]研究表明,细菌素可比引入菌株的方法更有效地调控瘤胃微生态。Callaway等[11]研究认为,在体外试验中,乳酸链球菌素是莫能菌素的良好替代品,能改变瘤胃发酵模式,产生更多的丙酸,同时使甲烷的释放量减少36%。但是,体内试验的结果和体外试验结果并不一致,许多研究证实了在牛饲粮中添加乳酸链球菌素并没有改变乙酸与丙酸的比例,可能是因为:在动物体内,一方面,部分乳酸链球菌素被降解;另一方面,目标甲烷菌对乳酸链球菌素产生了抵抗力。Lee等[12]研究发现,来自牛链球菌HC5(Streptococcus bovis HC5)的细菌素Bovicin HC5在体外可显著降低甲烷的生成,持续处理可使培养物丧失产生甲烷的能力。细菌素的优点是安全,并可通过基因操作引入到其他微生物中起到调控作用,缺点是容易被消化降解而失效。
3.3 驱虫
在反刍动物的瘤胃内,有一部分甲烷菌寄生在原虫的表面或者内部,并且与这些原虫形成了内源共生系统。大量的研究表明,这些甲烷菌生成的甲烷数量可占到甲烷总排放量的9%~25%,而Hegarty指出了瘤胃中高达37%的甲烷数量与纤毛虫有关[13]。因此,驱虫可间接减少甲烷菌的数量或者降低甲烷菌的活力,进而减少反刍动物甲烷的排放。Dohme等[14]在体外连续培养试验中发现,去除原虫可以显著降低甲烷的产量,但是甲烷菌的数量不变,表明去除原虫引起的甲烷产量的减少可能与甲烷菌活力的变化有关。但是,也有试验发现,驱虫并不能减少甲烷的生成。Machmüller等[15]通过绵羊体内试验发现,驱虫可以减少甲烷菌的数目,但不能减少甲烷的生产量。因此,驱虫减少甲烷的生成主要通过降低甲烷菌活力以及改变瘤胃中的甲烷菌组成等进行。
3.4 脂类添加剂
反刍动物饲粮中添加脂类物质可以影响甲烷的生成。目前,研究最多的是植物油,根据脂肪酸含量的差异,把植物油分为富含饱和中链脂肪酸和富含不饱和长链脂肪酸两大类。
3.4.1 饱和中链脂肪酸 富含饱和中链脂肪酸抑制甲烷的生成主要是通过抑制原虫和甲烷菌生长双重作用的结果。Machmüller等[16]利用体外产气技术研究了椰子油和全压榨的油料种子如油菜籽、向日葵籽和亚麻籽对甲烷产生的影响,结果表明,椰子油、向日葵籽和亚麻籽不但能降低发酵液中的原虫数目,而且显著降低了甲烷的生成。但是,也有资料表明,这些脂肪酸抑制甲烷并不是只依赖于原虫,而是直接抑制了甲烷菌的生长,Dohme等[14]和Machmüller等[15]分别在体外试验和体内试验中研究了瘤胃纤毛虫在椰子油抑制甲烷生成中的作用,体外试验结果表明,椰子油在含有原虫和去原虫的瘤胃液中均降低了甲烷的生成,体内试验也证实了椰子油对甲烷生成的抑制效果并不依赖于原虫,有可能是直接抑制了甲烷菌。黄小丹等[17]研究了椰子油在不同日粮条件下对甲烷生成的影响,指出添加椰子油显著降低了瘤胃中甲烷菌的数目,甲烷的排放量明显减少,并且甲烷排放量的降低与甲烷菌数目的减少趋势趋同。Soliva等[18]在体外试验中添加不同比例的月桂酸和肉豆蔻酸,结果表明,随着月桂酸比例的增加,甲烷的生成和古生菌(主要指甲烷菌)的数目逐渐减少;肉豆蔻酸虽然不能单独抑制甲烷的排放量,但是能够增强月桂酸抑制甲烷生成的能力。
3.4.2 不饱和长链脂肪酸 通常认为长链多不饱和脂肪酸抑制甲烷的生成主要通过3个途径:一是作为氢的受体,改变了氢还原二氧化碳的代谢通路;二是它对瘤胃微生物有直接的毒害作用,减少了底物的数量;三是改变了瘤胃的发酵模式,降低了乙酸和丙酸的比例。但是,
最近的研究表明,通过生物氢化过程利用代谢氢的数量很少,大约1%。因此,这些脂肪酸对甲烷生成的抑制主要通过后面两个途径。Mao等[19]研究了大豆油对湖州羔羊瘤胃发酵及产气量的影响,结果表明,添加大豆油可以使动物的甲烷排放量减少13.9%,甲烷菌数目显著降低,原虫数目略有降低。张春梅等[20]在体外发酵试验中添加亚麻油不但显著抑制甲烷的生成,而且可以使瘤胃发酵模式向丙酸类型转变。
3.5 添加有机酸
添加有机酸减少甲烷的生成,主要是通过改变碳水化合物在发酵过程中电子的释放途径,从而改变了瘤胃的发酵模式,减少底物的生成。目前,常用的有机酸主要有苹果酸、琥珀酸和富马酸(延胡索酸)等。Li等[21]利用体外发酵技术研究了在含有亚麻油的底物中添加苹果酸和延胡索酸对甲烷生成的影响,结果表明,添加有机酸后不但甲烷的生成显著降低,而且cis9、trans11-共轭亚油酸(CLA)的浓度明显增加。Kolver等[22]在以粗料为底物的连续发酵系统中添加3.5 g/L的富马酸后,甲烷的生成数量降低了38%。在体内试验研究中发现,只有富马酸的添加量达到10%时,才能有效降低甲烷的生成。但是,高添加量将影响到瘤胃的pH值,进一步影响到纤维分解酶的活性,降低了饲料的利用率。为了克服有机酸的这一缺点,Wood等[23]提出了添加包被富马酸来抑制甲烷的生成,并且体外试验已经证实,这种方法不但对瘤胃中的pH值没有影响,而且增加了瘤胃中丙酸的含量,减少了甲烷生成,减少量为19%。
3.6 植物提取物
3.6.1 丹宁 长期以来,丹宁一直被认为是饲料中的抗营养因子,随着研究的深入,研究人员发现丹宁具有通过对动物的抑菌、抗菌途径来抑制甲烷生成等作用。Hess等[24]和Carulla等[25]使用在黑荆树提取出来的丹宁来研究对羔羊甲烷生成的影响,结果发现,添加丹宁不影响动物的采食量、明显抑制甲烷的排放量,并且饲喂丹宁组的羔羊瘤胃中比对照组有更多数量的原虫。这个结果表明,丹宁对甲烷生成的抑制作用可能与原虫并无密切的关系。Tiemann等[26]使用两种含有丹宁的植物来代替部分牧草饲喂羔羊,发现处理组生成的甲烷明显比对照组少。但是,同时发现饲喂丹宁植物降低了饲粮中有机物质和纤维的消化。可以看出,目前,对丹宁抑制甲烷生成的机制尚不统一,主要有两个原因:一是不同植物所含丹宁的种类不同;二是由于饲粮的种类以及添加量的不同。
3.6.2 皂甙 大量的研究证实,在饲粮中添加皂甙或饲喂含有皂甙的物质,可以抑制反刍动物瘤胃甲烷的生成。Hu等[27]在以玉米和草饼为底物的体外发酵试验中,添加不同水平的茶皂素,发现茶皂素不但显著抑制了甲烷的生成、降低了原虫的数目而且对有机物的降解率和瘤胃发酵模式并无影响。Guo等[28]在体外试验中,研究了在瘤胃混菌以及单种类甲烷菌条件下茶皂素对甲烷生成、微生物区系组成以及甲基辅酶M还原酶的影响,结果表明,只有在混菌条件下,茶皂素显著地抑制了甲烷的生成、降低了原虫的数目以及甲基辅酶M还原酶的基因表达量,但是甲烷菌的数量并没有减少。因此,皂甙抑制甲烷的生成机制主要通过以下两种方式:一是通过减少原虫的数目,降低了生成甲烷底物的数量;二是直接抑制了参与甲烷合成过程中相关酶的活力。
3.6.3 挥发油 挥发油又称精油,是存在于植物体内的一类具有芳香气味的物质,有抗菌、抗氧化和提高免疫力等功能。以前挥发油主要应用于单胃动物饲料添加剂中。目前的研究发现,在反刍动物饲料中添加挥发油可以抑制瘤胃甲烷的生成。Benchaar等[29]通过反刍动物体外试验发现大蒜油的甲醇提取物是一种甲烷生成的有效抑制剂,可以减少64%的甲烷生产量,并且对反刍动物消化率无影响;丁香的乙醇、甲醇提取物以及茴香的甲醇提取物也具有抑制甲烷产生的功能。Hart等[30]进一步证实了在体外试验中添加大蒜油,显著抑制了甲烷的生成。Miller等[31]提出了大蒜素(油)抑制甲烷的机制主要是大蒜油抑制了甲烷菌β-羟基-β-甲基戊二酸单酰辅酶A(HMG-CoA)还原酶的活性,这种酶的抑制会导致甲烷菌细胞膜的破坏并最终减少了甲烷菌的数量。
3.7 溴氯甲烷
甲基辅酶M甲基还原酶参与了反刍动物甲烷生成的所有路径,而溴氯甲烷是它的专一抑制剂,能够抑制其活力。Tomkins等[32]指出了在饲粮中添加溴氯甲烷能够显著抑制反刍动物甲烷的生成,并且对动物的体增重和饲料转化率没有影响。但是由于它在动物体内具有残留,因此,目前在许多国家都被禁止使用。虽然溴氯甲烷不能被使用,但是它给研究人员提供了一个思路,直接抑制参与甲烷合成过程的关键酶,不但可以抑制甲烷的生成,而且对饲料的转化率以及动物的增长无副作用。
4 结语
反刍动物瘤胃内甲烷的生成是一个复杂的过程,同时又是一个不可避免的过程,目前,调控甲烷生成过程的各种措施,或多或少对动物的生产性能或饲料的利用率产生不利的影响。因此,结合甲烷在反刍动物瘤胃中生成的路径,找出一个合理的调控措施,是动物研究人员长期的研究目标。
[1]Beauchemin K A,Kreuzer M,McAllister T A,et al.Nutritional management for enteric methane abatement:a review[J].Australian Journal of Experimental Agriculture,2008,48:21-27.
[2]Jarvis G N,Strompl C,Burgess D M,et al.Isolation and identification of ruminal methanogens fromgrazingcattle[J].Current Microbiol,2000,40: 327-332.
[3]Rea S,Bowman J P,Popovski S,et al.Methanobrevibacter millerae sp.nov. and Methanobrevibacter olleyae sp.nov.,methanogens fromthe ovine and bovine rumen that can utilize formate for growth[J].International Journal ofSystermatic and EvolutionaryMicrobiology,2007,57:450-456.
[4]Janssen P J,Kirs M.Structure ofthe archaeal communityofthe rumen[J]. Applied and Environmental Microbiology,2008,74:3619-3625.
[5]Denman S E,Tomkins N W,McSweeney C S.Quantitation and diversity analysis of ruminal methanogenic populations in response to the antimethanogenic compound bromochloromethane[J].FEMSMicrobiologyEcology,2007,62:313-322.
[6]Fuller J R,Johnson D E.Monensin and lasalocid effects on fermentation in vitro[J].Journal ofAnimal Science,1981,53:1574-1580.
[7]CallawayTR,CarneiroDMA,Russell J B.The effect ofnisin and monensinonruminalfermentationinvitro[J].CurrentMicrobiology,1997,35: 90-96.
[8]Scott WH,Edward J D.Greenhouse gas,animal performance,and bacterial population structure responses todietarymonensin fed todairycows[J].Journal ofEnvironmental Quality,2010,39:106-114.
[9]O’KellyJ C,Spiers W W.Effect of momensin on methane and heat productions of steers fed lucerne hay[J].Australian Journal of Agricultural Reseach,1992,43:1789-1795.
[10]Kalmakoff M L,Barden F,Teather R M.Are ruminal bacteria armed with bacteriocins[J].Journal ofDairyScience,1996,79:2297-2306.
[11]Callaway T R,Martin S A,Wampler J L,et al.Malate content of forage varieties commonlyfed tocattle[J].Journal of DairyScience,1997,80:1651-1655.
[12]Lee SS,Hsu J T,Mantovani H C,et al.The effect ofbovicin HC5,a bacteriocin fromStreptococcus bovis HC5,on ruminal methane production in vitro[J].FEMSMicrobiologyLetters,2002,217:51-55.
[13]Hegarty R S.Reducing rumen methane emissons through elimination of rumenprotozoa[J].AustralianJournalofAgriculturalReseach,1999,50:1321-1327.
[14]Dohme F,Estermann B L,Pfister P,et al.The role of the rumen ciliate protozoa for methane suppression caused by coconut oil[J].Letters in Applied Microbiology,1999,29:187-192.
[15]Machmüller A,Sooliva C R,Kreuzer M.Effect of Coconut oil and defaunationtreatmentonmethanogenesisinsheep[J].ReproductionNutrition Development,2003,43:41-55.
[16]Machmüller A,Ossowski D A,Wanner M,et al.Potential of various fatty feedstoreducemethanereleasefromrumen fermentation in vitro[J].Animal Feed Science and Technology,1998,71:117-130.
[17]黄小丹.椰子油对不同日粮条件下绵羊瘤胃微生物及甲烷产量的影响[D].兰州:甘肃农业大学,2008.
[18]Soliva C R,Hindrichsen I K,Meile L.Effects of mixtures of lauric and myristicacidonrumenmethanogensandmethanogenesisinvitro[J].Letters in Applied Microbiology,2003,37:35-39.
[19]Mao H L,Wan J K,Zhou Y Y,et al.Effects of addition of tea saponins and soybean oil on methane production,fermentation and microbial population in the rumen ofgrowinglambs[J].Livestock Science,2010,129: 56-62.
[20]张春梅,施传信,易贤武,等.添加亚麻酸及植物油对体外瘤胃发酵和甲烷生成的影响[J].华中农业大学学报,2010,29(2):193-198.
[21]Li XZ,LongR J,Yan CG,et al.Rumen microbial responses in fermentation characteristics and production ofCLAand methane tolinoleic acid inassociatedwithmalateorfumarate[J].AnimalFeedScienceandTechnology,2010,155:132-139.
[22]Kolver E S,Aspin P W,Jarvis G N,et al.Fumarate reduces methane production frompasture fermented in continuous culture[J].Proceedings ofthe NewZealand SocietyofAnimal Production,2004,64:155-159.
[23]Wood T A,Wallace R J,Rowe A,et al.Encapsulated fumaric acid as a feed ingredient todecrease ruminal methane emissions[J].Animal Feed Science and Technology,2009,152:62-71.
[24]Hess H D,Tiemann T T,Noto F,et al.Strategic use of tannins as means to limit methane emission from ruminant livestock[J].International Congress Series,2006,1293:164-167.
[25]Carulla J E,Kreuzer M,Machmüller A,et al.Supplementation ofAcacia mearnsiitanninsdecreasesmethanogenesisandurinarynitrogeninforagefed sheep[J].Australian Journal ofAgricultural Reseach,2005,56:961-970.
[26]Tiemann T T,Lascano C E,Wettstein H R,et al.Effect of the tropical tannin-rich shrub legumes Calliandra calothyrsus and Flemingia macrophylla on methane emission and nitrogen and energy balance in growing lambs[J].Animal,2008,2:790-799.
[27]Hu WL,Liu J X,Ye J A,et al.Effect oftea saponin on rumen fermentation in vitro[J].Animal Feed Science and Technology,2005,120:333-339.
[28]Guo Y Q,Liu J X,Liu Y.Effect of tea saponin on methanogenesis,microbial communitystructure and expression of mcrA gene,in cultures of rumen micro-organisms[J].Applied Microbiology,2008,47:421-426.
[29]Benchaar C,Calsamiglia S,Chaves A V,et al.A reviewof plant-derived essential oils in ruminant nutrition and production[J].Animal Feed Science Technology,2008,145:209-228.
[30]Hart KJ,Yanez-RuizDR,Duvalet SM,et al.Plant extracts tomanipulaterumen fermentation[J].AnimalFeed Scienceand Technology,2007,147:1-28.
[31]Miller T L,Wolin MJ.Inhibition of growth of methane-producing bacteria of the ruminant forestomach by hydroxymethylglutaryl-SCoA reductase inhibitors[J].Journal ofDairyScience,2001,84:1445-1448.
[32]Tomkins N W,Colegate S M,Hunter R A.A bromochloromethane for mulation reduces enteric methanogenesis in cattle fed grain-based diets[J].Animal Production Science,2009,49:1053-1058.
An Overview on Methane Biochemistry Mechanism and Regulation in Ruminants
QiaoSheng-min1,QiaoJun-yi2,3,Tan Zhi-liang3
(1.PingdingAnimal HusbandryDevelopment Center,Yangquan 045200,Shanxi,China;2.Graduate UniversityofChinese AcademyofSciences,Beijing100049,China;3.Institute ofSubtropical Agriculture,Chinese AcademyofSciences,Changsha 410125,China)
Methane is not onlyan important greenhouse gas,but alsoa main factor ofdiet energyloss in ruminants.Therefore,reducingits production is veryhelpful toimprove the energyefficiencyand protect environment.This paper provides an overviewon biological method,possible biochemistrymechanismand the main methane inhibitors.
methane;ruminant;methanogenesis mechanism;inhibitor;biological method
S851.2
A
2095-3887(2014)01-0044-05
10.3969/j.issn.2095-3887.2014.01.014
2013-10-21
乔升民(1958-),男,兽医师。
乔君毅(1982-),男,博士研究生,主要从事反刍动物生态营养研究。
