响应面法优化Ca2+激活牦牛血中凝血酶原工艺研究
2014-03-01张盛贵牛黎莉甘肃农业大学食品科学与工程学院甘肃兰州730070甘肃省华池县质量技术监督局甘肃庆阳745600
张 阳,张 珍,*,张盛贵,牛黎莉,杜 雨,周 芸(.甘肃农业大学食品科学与工程学院,甘肃兰州730070;.甘肃省华池县质量技术监督局,甘肃庆阳745600)
响应面法优化Ca2+激活牦牛血中凝血酶原工艺研究
张 阳1,张 珍1,*,张盛贵1,牛黎莉1,杜 雨1,周 芸2
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃省华池县质量技术监督局,甘肃庆阳745600)
以牦牛血液为原料,采用柠檬酸钡吸附法制取凝血酶原。选取激活温度,Ca2+终浓度,激活时间三个因素,在单因素实验基础上进行Box-Behnken中心组合实验,研究了Ca2+激活牦牛血中凝血酶原的工艺条件,实验结果表明:激活温度27℃、Ca2+终浓度0.01mol/L、激活时间1.95h,在此条件下凝血酶的比活力最优为63.3972U/mg。
Ca2+激活,凝血酶原,牦牛,柠檬酸钡吸附,响应面实验
凝血酶(Thrombin Ec 3.4.21.5)是血液凝固系统中起重要作用的丝氨酸蛋白水解酶,是凝血酶原经凝血酶原激活物激活而成的,具有较高的专一性,它能够促使血液中的纤维蛋白原转化为纤维蛋白,同时促使血小板聚集,加速血液凝固,从而达到迅速止血的目的。凝血酶的活性前体物质是凝血酶原,其本身没有活性,不能将纤维蛋白原转化为纤维蛋白,只有将其激活成凝血酶才有应用价值,生理条件下,凝血酶原由凝血因子V、Xa、Ca2+和磷脂共同激活生成凝血酶[1]。实际应用中激活的方式有多种:a.用促凝血酶和氯化钙激活凝血酶原,促凝血酶可由兔脑、人体组织或人体重组器官以及牛脑中获得[2];b.用蛇毒激活[3];c.单独使用Ca2+激活[4-5]。
目前,国内主要从动物血浆中提取凝血酶[6-8],但尚未有从牦牛血中提取凝血酶的报道。我国是牦牛主产国,占世界牦牛总数的92%以上,其主要分布于青海、西藏、四川、甘肃、新疆、云南等六省区的高寒草原区[9]。牦牛血中含有丰富的营养成分和一些药用价值很高的酶类,其中就有凝血酶。对牦牛血液的利用,除有报道的从牦牛血液中提取免疫球蛋白IgG[10]、SOD[11]和少量食用外,大量血液遭到丢弃,造成了极大的资源浪费和环境污染。因此,从牦牛血中提取凝血酶,既可以充分利用牦牛血资源,提高牦牛血的附加值,又可以减少因污血排放造成的环境污染,具有重大社会意义。鉴于此,本实验以柠檬酸钡吸附法制取凝血酶原,采用Ca2+激活牦牛血中凝血酶原,通过实验,探索激活牦牛血中凝血酶原的最优工艺,以期为屠宰行业大量污染环境的牦牛血资源能得到充分利用提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜牦牛血 取自甘肃夏河;凝血酶标准品、纤维蛋白原标准品、牛血清白蛋白标准品 中国药品生物制品检定所;透析袋 美国进口;考马斯亮蓝G-250、乙醇、磷酸、盐酸、Tris、乙二胺四乙酸(EDTA)、氯化钠、氯化钙、氯化钡、柠檬酸钠及其他试剂 均为分析纯。
高速冷冻离心机(H-1850R) 长沙湘仪离心机仪器有限公司;紫外分光光度计(UV722S) 北京普析通用仪器有限责公司;分析天枰(FA2004) 上海越平科学仪器有限公司;数显恒温水浴锅(HH-S24)
上海一恒科学仪器有限公司;数字酸度计(PHS-3C) 成都世纪方舟科技有限公司;磁力搅拌器(CJJ78-1) 金坛市大地自动化仪器厂。
1.2 实验方法
1.2.1 蛋白质含量测定 蛋白质含量测定采用Bradford法[12]。
1.2.2 凝血酶活力测定 凝血酶活性测定采用中国药典介绍的方法[13]。
1.2.3 柠檬酸钡吸附法提取凝血酶原 原理:柠檬酸钠抗凝获得的血浆中加入BaCl2产生柠檬酸钡沉淀,凝血酶原等依赖于维生素K的凝血因子被吸附在柠檬酸钡上,随之沉淀分离出来,沉淀用EDTA解吸,弃去沉淀,上清液经Tris-HCl透析后即得凝血酶原。
操作步骤:新鲜牦牛血,加入1/10原血液体积浓度为3.8%的柠檬酸钠作为抗凝剂,-20℃下冷冻3d,4℃解冻后,于3500r/min离心10min,得血浆[14]。取血浆50mL,边搅拌边缓慢加入6mL 1mol/L的BaCl2溶液,磁力搅拌1h后4000r/min转速下离心15min,收集柠檬酸钡沉淀,将沉淀溶于等血浆体积pH8.0 0.2mol/L的EDTA溶液中,搅拌1h,4000r/min离心15min弃去不溶物,上清液用0.05mol/L pH7.2的Tris-HCl缓冲液透析,不断更换透析液,至无Ba2+为止[15],得凝血酶原液。
1.2.4 凝血酶原的激活 凝血酶原液中加入CaCl2溶液,使其达一定浓度,在一定温度下激活一段时间,得凝血酶。
1.2.5 凝血酶原激活工艺单因素实验设计
1.2.5.1 激活温度对凝血酶活力的影响 在Ca2+终浓度0.01mol/L,激活时间2h时,讨论激活温度对凝血酶活力的影响。温度设定为5、15、25、35、45℃,重复三次。
1.2.5.2 Ca2+终浓度对凝血酶活力的影响 在最适激活温度,激活时间2h时,讨论Ca2+终浓度对凝血酶活力的影响。Ca2+终浓度设定为0.005、0.01、0.015、0.020、0.025mol/L,重复三次。
1.2.5.3 激活时间对凝血酶活力的影响 在最适Ca2+终浓度,最适激活温度时,讨论激活时间对凝血酶活力的影响。时间设定为1、2、3、4、5h,重复三次。
1.2.6 响应面实验设计 在单因素实验基础上,以激活温度(℃)、Ca2+终浓度(mol/L)和激活时间(h)为自变量(Xi),凝血酶比活力为响应值(Y),运用Box-Behnken模型设计三因素三水平二次回归方程,拟合自变量与凝血酶比活力之间的函数关系。实验因素水平见表1。
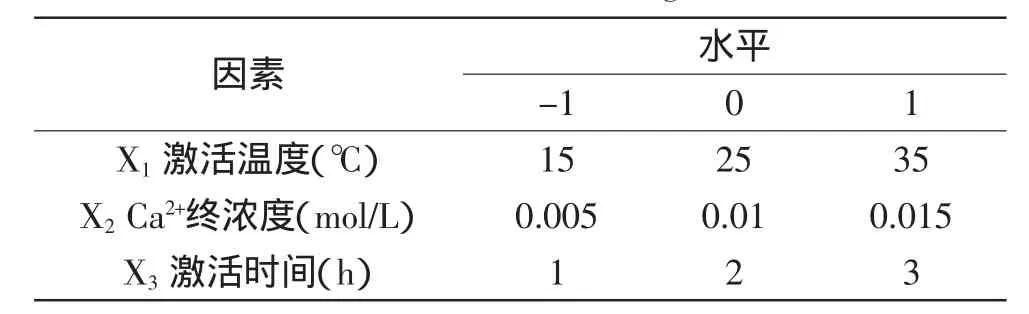
表1 响应面设计因素水平Table 1 Independent variables and their corresponding levels in Box-Behnken design
2 结果与分析
2.1 单因素对凝血酶活力的影响
2.1.1 激活温度对凝血酶活力的影响 由图1可知,凝血酶活力随激活温度的升高呈先增大后减小的趋势。激活温度25℃时,凝血酶的活力达到最大,并与其他水平有显著性差异(p<0.05)。当激活温度小于25℃,凝血酶的活力较低,这是由于凝血酶的活性中心结构受温度的影响[16],在温度较低时,凝血酶的活性中心没有被完全激活,使得凝血酶的活力较低。当激活温度大于25℃,随着激活温度的升高,凝血酶的活性逐渐降低,这是由于高温破坏了其活性中心结构而导致部分酶活性丧失。因此,选择25℃为最佳激活温度。
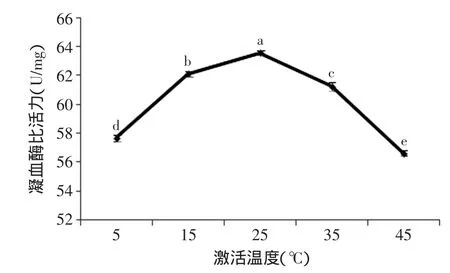
图1 激活温度对凝血酶活力的影响Fig.1 Effect of activating temperature on the activity of thrombin
2.1.2 激活时间对凝血酶活力的影响 由图2可知,凝血酶活力随激活时间的增加呈先增大后减小的趋势。激活时间2h时,凝血酶活力达到最大,并与其他水平有显著性差异(p<0.05)。当激活时间小于2h,凝血酶活力较低,这可能是由于凝血酶没有被完全激活。当激活时间大于2h,随着激活时间的不断延长,凝血酶的活力逐渐降低,这可能与环境因素有关,说明牦牛凝血酶不稳定,放置时间越长其酶活损失越多。因此,选择2h为最佳激活时间。
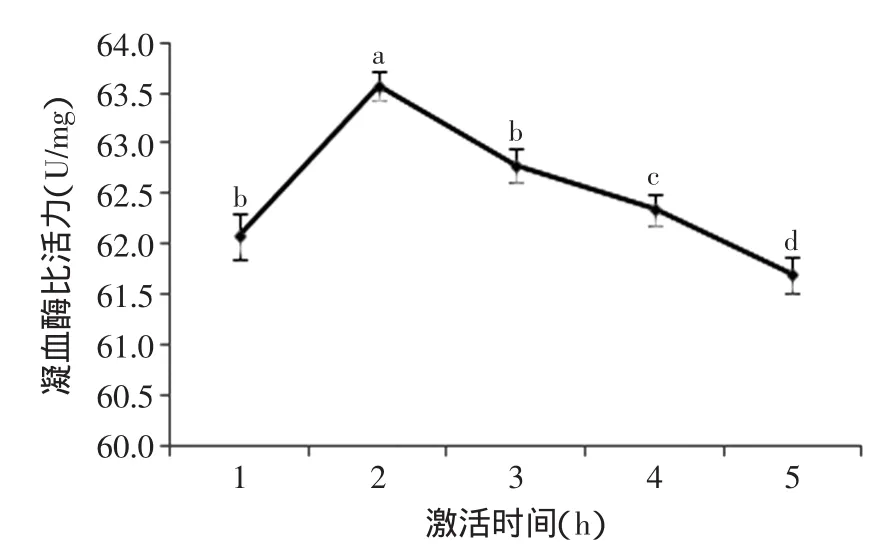
图2 激活时间对凝血酶活力的影响Fig.2 Effect of activating time on the activity of thrombin
2.1.3 Ca2+终浓度对凝血酶活力的影响 由图3可知,凝血酶活力随Ca2+终浓度的增加呈先增大后减小的趋势。Ca2+终浓度为0.01mol/L时,凝血酶的活力达到最大,并与其他水平有显著性差异(p<0.05)。当Ca2+终浓度小于0.01mol/L,凝血酶的活力较低,这是由于Ca2+是凝血酶的辅基[16],在Ca2+终浓度小于0.01mol/L时,凝血酶的活性中心不能被Ca2+完全激活,从而使得凝血酶的活力较低。当Ca2+终浓度大于0.01mol/L,随着Ca2+终浓度的不断增大,凝血酶的活力逐渐降低,这是由于过多的Ca2+破坏了凝血酶的空间结构,从而使得部分凝血酶活性丧失。因此,选择0.01mol/L为最佳Ca2+终浓度。
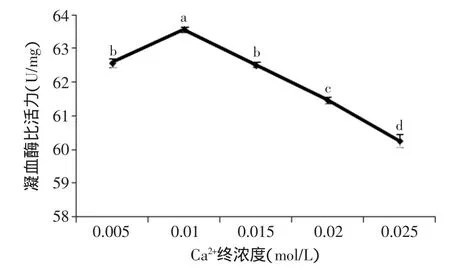
图3 Ca2+终浓度对凝血酶活力的影响Fig.3 Effect of final concentration of Ca2+on the activity of thrombin
2.2 响应面实验结果及模型的建立
在单因素实验的基础上,利用响应面法确定牦牛凝血酶原最佳激活工艺,实验结果见表2。利用Design Expert软件对表2实验数据进行回归分析,得二次多元回归模型:Y=63.48+1.04X1-0.22X2+0.27X3+ 0.33X1X2-1.51X1X3+0.77X2X3-3.01X12-1.36X22-0.59X32。
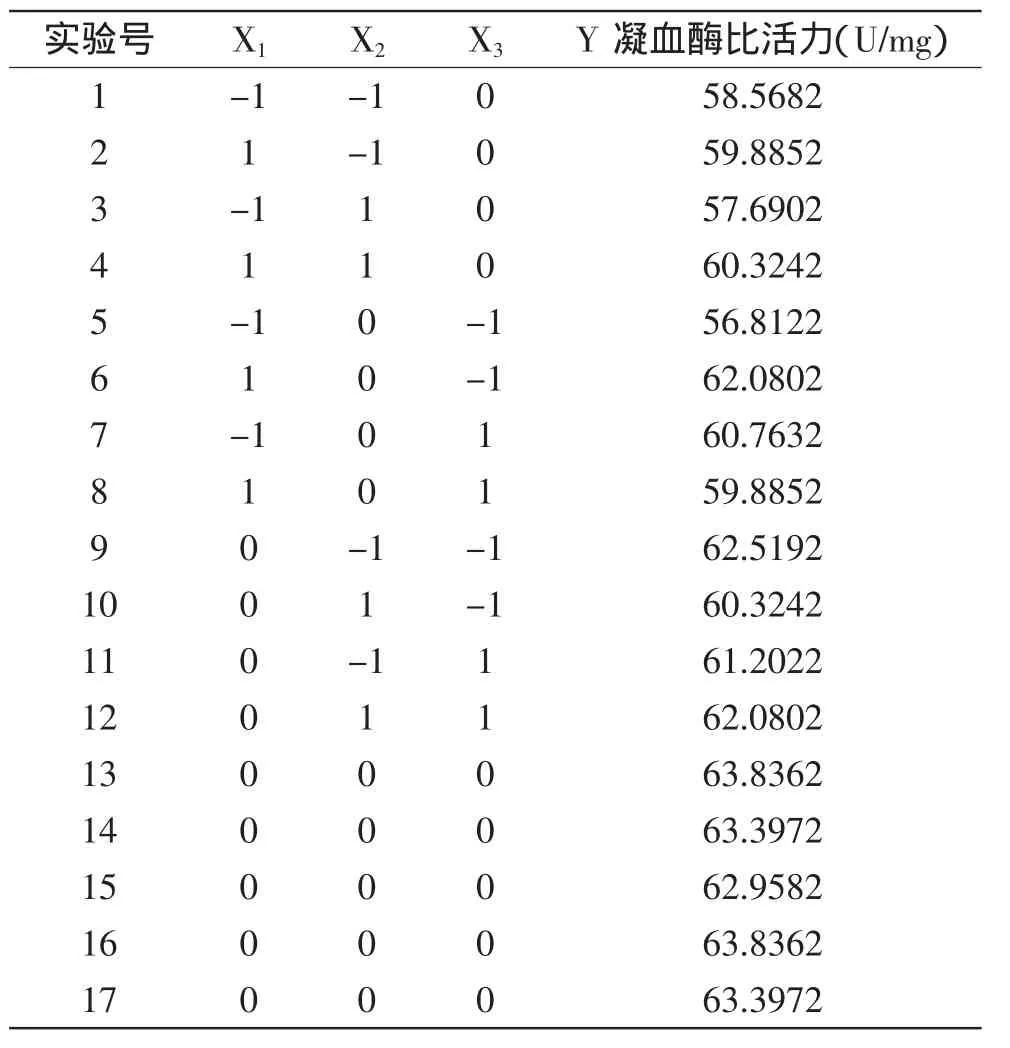
表2 响应面实验设计及结果Table 2 The result and condition of response surface experiment

表3 回归模型方差分析表Table 3 Variance analysis of regression model
由回归模型方差分析(表3)可以看出:模型p<0.0001,模型极显著;失拟项p=0.5413>0.05,失拟项不显著;决定系数(R2)为0.9881,校正系数(R2Adj)为0.9728,该模型能解释97.28%响应值的变化,因而该模型拟合程度较好,可以用此模型来分析和预测Ca2+激活牦牛凝血酶原的工艺结果。在总的作用因素中,回归方程一次项X1、二次项X12、X22及交互项X1X3、X2X3对激活牦牛凝血酶原的影响均达极显著水平。各因素对其的影响顺序依次为激活温度>激活时间>Ca2+终浓度。
2.3 响应面分析
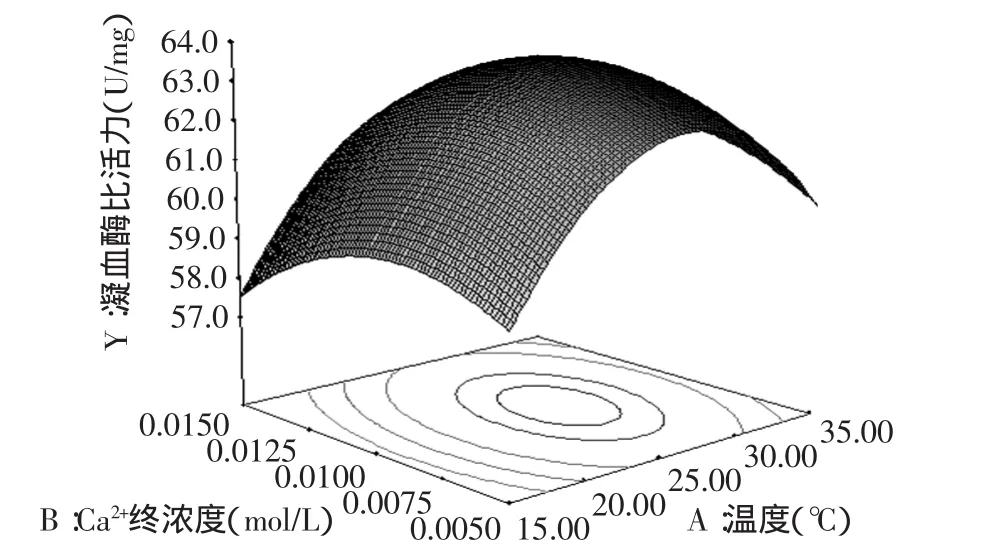
图4 Ca2+离子终浓度(B)与激活温度(A)响应面图Fig.4 Effect of final concentration of Ca2+(B)and activating temperature(A)on viscosity response surface
图4 显示了当激活时间为中心水平1.95h时,Ca2+离子终浓度和激活温度对凝血酶活力的交互作用。当离子浓度不变时,随着激活温度的升高,凝血酶的活力呈现先增大后减小的趋势;当固定激活温度不变时,凝血酶的活力随着Ca2+离子终浓度的增大也呈现出先增大后减小的趋势;Ca2+终浓度和激活温度在0.075~0.0125mol/L、23~28℃之间时,凝血酶活力有最大值。
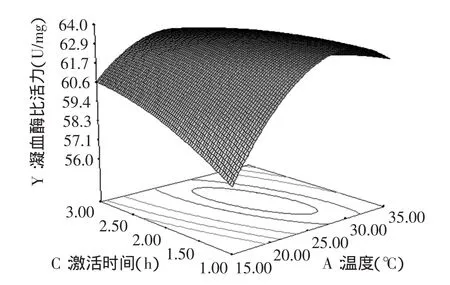
图5 激活时间(C)与激活温度(A)响应面图Fig.5 Effect of activating time(C)and activating temperature(A)on viscosity response surface
图5 显示了当Ca2+离子终浓度为中心水平0.01mol/L时,激活时间和激活温度对凝血酶活力的交互作用。当激活时间一定时,随着激活温度的升高,凝血酶的活力呈现出先增大后缓慢减小的趋势;当固定激活温度不变时,凝血酶的活力随着激活时间的延长呈现出先增大后趋于平缓的趋势;激活时间和激活温度在1.5~2.5h、25~30℃之间时,凝血酶活力有最大值。

图6 激活时间(C)与Ca2+离子终浓度(B)响应面图Fig.6 Effect of activating time(C)and final concentration of Ca2+(B)on viscosity response surface
图6 显示了当激活温度为中心水平27℃时,激活时间和Ca2+离子终浓度对凝血酶活力的交互作用。当激活时间不变时,随着Ca2+离子终浓度的增大,凝血酶的活力呈现出先增大后减小的趋势;当固定Ca2+离子终浓度不变时,凝血酶的活力随着激活时间的延长也呈现出先增大后减小的趋势;激活时间和Ca2+离子终浓度在1.5~2.5h、0.007~0.012mol/L之间时,凝血酶活力有最大值。
2.4 响应面工艺的验证
本实验优化得出激活牦牛凝血酶原的最佳工艺条件为:激活温度26.82℃、Ca2+离子终浓度0.01mol/L、激活时间1.95h,凝血酶活力的理论值为63.5811U/mg,考虑到实际操作的可行性,将凝血酶原的激活工艺优化为激活温度27℃、Ca2+离子终浓度0.01mol/L、激活时间1.95h。按上述条件进行验证实验,测定凝血酶的活力为63.3972U/mg,酶活与预测值之间的相对误差为0.3%。证明应用响应面法优化的牦牛凝血酶原的激活工艺模型可行。
3 结论
通过Box-Behnken实验设计,优化Ca2+离子激活牦牛血中凝血酶原的最佳工艺条件为:激活温度27℃、Ca2+离子终浓度0.01mol/L、激活时间1.95h。在上述条件下,凝血酶活力的实验值为63.3972U/mg,酶活与预测值之间的相对误差为0.3%,各因素对凝血酶活力的影响依次为:激活温度>激活时间>Ca2+终浓度。通过对回归模型进行方差分析和交互作用分析,得知该回归模型极显著,对实验拟合较好。因此,采用响应面法分析优化得到的参数具有一定的实用价值。
[1]Carminita Frost,Ryno Naude,Willem Oelofsen,et al. Purification and characterization of ostrich prothrombin[J].The International Journal of Biochemistry&Cell Biology,2000(32):1151-1159.
[2]Girolami A,Scarparo P,Bonamigo E,et al.Homozygous FVII deficiencies with different reactivity towards tissue thromboplastins of different origin[J].Hematology,2012,17(6):350-354.
[3]Lovgren A.Recombinant snake venom prothrombin activators [J].Bioengineered,2013,4(3):153-157.
[4]幸春艳,陈英珠,吴萌,等.Ca2+离子激活凝血酶原作用初步研究[J].河北省科学院学报,2001,18(3):172.
[5]刘湘新,何湘容,刘进辉,等.凝血酶的制备工艺研究及其活性测定[J].中兽医医药杂志,2005(4):32-34.
[6]南学梅,董文宾.猪血制品的研制与开发[J].天然产物研究与开发,2010(B8):288-292.
[7]杨明俊,吴婧,李志忠,等.羊血浆中凝血酶的提取工艺及稳定性研究[J].中国食品工业,2010(3):53.
[8]朱天新,袁彩君,任晚琼.牛血凝血酶的制备工艺[J].中国生化药物杂志,2007(3):185-188.
[9]郭宪,阎萍.中国牦牛遗传资源现状分析[J].中国畜禽种业,2008(1):60-62.
[10]金晶,张珍,张丽,等.低温无水乙醇沉淀法提取牦牛血免疫球蛋白的工艺条件研究[J].甘肃农业大学学报,2010,45(4):51-54.
[11]赵文宝,张珍,郭建华,等.牦牛血中超氧化物歧化酶提取工艺研究[J].甘肃农业大学学报,2010,45(1):147-150.
[12]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2002:42-46.
[13]中华人民共和国卫生部药典委员会.中华人民共和国药典[M].等二部.北京:中国医药科技出版社,2010:1149.
[14]周文静,吕嘉枥.猪血中提取纯化凝血酶方法改进[J].食品研究与开发,2005,26(2):93-95.
[15]李敏康,钱冬明,任宏媛,等.猪血浆中多种功能蛋白的连续提取[J].农业工程学报,2007,23(6):242-245.
[16]谢万如,左勇.凝血酶活力影响因素的初步研究[J].四川理工学院学报,2004,17(3):147-150.
Study on optimization of Ca2+on activation of prothrombin process conditions in yak blood by response surface method
ZHANG Yang1,ZHANG Zhen1,*,ZHANG Sheng-gui1,NIU Li-li1,DU Yu1,ZHOU Yun2
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.The Quality&Technical Supervision Bureau Of Huachi,Qingyang 745600,China)
Yak blood as the research object,the prothrombin was prepared by adsorption method with barium citrate.The study optimized preparation conditions of Ca2+activating the prothrombin in yak blood by single factor experiment(the activating temperature,final concentration of Ca2+and activating time)and Box-Behnken experiment.The results showed that the optimal thrombin specific activity was 63.3972U/mg at the following conditions:activating temperature 27℃,final concentration of Ca2+0.01mol/L,activating time 1.95h.
activating by Ca2+;prothrombin;yak;adsorption with barium citrate;response surface experiments
TS201.1
B
1002-0306(2014)14-0293-04
10.13386/j.issn1002-0306.2014.14.056
2013-10-23 *通讯联系人
张阳(1987-),男,硕士研究生,研究方向:营养与食品卫生学。
国家科技部支撑计划项目(2007BAD52B07);甘肃省科技厅自然基金(1107RGZA123)。
