脱色和干燥方式对普鲁兰多糖品质的影响
2014-03-01高璇璇郑志达宋亚琼郝华璇汪建明乔长晟食品营养与安全教育部重点实验室天津科技大学食品工程与生物技术学院天津00457工业发酵微生物教育部重点实验室天津科技大学生物工程学院天津00457天津北洋百川生物技术有限公司天津00457
高璇璇,郑志达,孟 迪,宋亚琼,郝华璇,汪建明,乔长晟,,*(.食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津00457;.工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津00457;.天津北洋百川生物技术有限公司,天津00457)
脱色和干燥方式对普鲁兰多糖品质的影响
高璇璇1,郑志达2,孟 迪2,宋亚琼2,郝华璇3,汪建明1,乔长晟2,3,*
(1.食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457;2.工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津300457;3.天津北洋百川生物技术有限公司,天津300457)
研究了脱色和干燥方式对普鲁兰多糖品质的影响。从四种型号的活性炭中选出效果最好的ZY-24×48-B型活性炭,在单因素的基础上,采用正交实验优化活性炭脱色工艺。结果表明最佳的脱色条件:活性炭添加量1.0%(w/v)、pH5.0,时间40min,温度40℃,此时脱色率为94.98%,多糖得率为91.24%。之后通过研究微波干燥、喷雾干燥及冷冻干燥三种工艺对普鲁兰多糖样品的纯度、微观表征、溶解度及色泽的影响,确定最佳的工业化生产的干燥方式。结果表明,喷雾干燥所得到样品纯度可达91.07%,色泽较白,溶解度较好;冷冻干燥所得样品溶解度最好,L值(95±0.21)最高,但干燥时间长且成本高;微波干燥得到样品出现褐变,L值(89±0.68)最低。综合考虑产品品质及能耗成本等因素,喷雾干燥最适合普鲁兰多糖的工业化生产。
普鲁兰多糖,脱色,干燥方式,品质
普鲁兰多糖是由出芽短梗霉(Aureobasidium pullulans)在发酵过程中利用糖代谢产生的一种胞外水溶性多糖。其分子是由麦芽三糖通过α-1,6-糖苷键连接而成的直链多糖[1-2],α-1,4-糖苷键和α-1,6-糖苷键的比例为2∶1。干燥的普鲁兰多糖为白色非结晶性粉末,易溶于冷水和热水中,不产生胶凝作用,溶液粘稠稳定,呈中性。普鲁兰多糖具有极佳的成膜性、阻氧性、粘结性和可塑性等独特的理化和生物学性质,无毒无害,对人体无副作用,是一种有极大开发价值和前景的多功能新型生物制品[3]。近年来,有关普鲁兰多糖的研究主要是集中在了提取、纯化、生物活性等方面,而对其提取物的干燥方法的研究较少[4]。焦莎莎[5]、吕蕾等[6]对普鲁兰多糖的提取工艺进行了研究,刘谋泉[7]、连正淦等[8]对普鲁兰多糖的成膜性进行研究。普鲁兰多糖的干燥方式的研究较少,王雪松[9]和牛登飞[10]在研究中分别使用冷冻干燥和喷雾干燥进行普鲁兰多糖的干燥处理,并没有对普鲁兰多糖进行较为系统的干燥方式的对比研究。在本实验中,以未脱色的普鲁兰多糖溶液为研究对象,首先从四种不同型号的活性炭中选择出脱色效果最好的活性炭,之后对脱色条件进行确定。然后通过微波干燥、喷雾干燥和冷冻干燥3种工艺,用高效液相色谱测定普鲁兰多糖的含量,结合普鲁兰多糖的表观性状及复水性,通过对比实验分析了脱色条件和干燥方法对普鲁兰多糖品质的影响。

表1 活性炭规格Table 1 Activated carbon type
1 材料与方法
1.1 材料与仪器
菌株 出芽短梗霉(Aureobasidium pullulans),天津北洋百川生物技术有限公司保存菌株,CGMCC.7055;普鲁兰多糖发酵液 由出芽短梗霉(Aureobasidium pullulans)发酵培养3d[11],停止发酵后于80℃下保温60min[10],进行灭菌和钝化酶处理,待用;硅藻土
TUFA070G#型,天津市海鑫精细化工;粉末状活性炭 ZY-8×30型、ZY-24×48-A型、ZY-24×48-B型,福建省芝星炭业股份有限公司;粉末状活性炭 XGST-AC型,德兴市新岗山活性炭有限公司;普鲁兰多糖酶 天津诺维信生物医药公司。
板框过滤机 海宁市联众过滤设备科技有限公司;SY-MU2050型切向流超滤系统 上海世远生物设备工程有限公司;高效液相色谱仪Agilent technologies 1200 series 配有视差折光检测器,Agilent;UV-1200型紫外分光光度计;MG823LA3-NR型(800W)美的微波炉;SP-1500型喷雾干燥机 上海顺仪实验设备有限公司;LGJ-12S型冷冻干燥设备 北京松原华新科技发展有限公司;SU-1510型扫描电镜 日本日立公司;UltraScan Pro型高精度分光测色仪 美国HunterLab公司。
1.2 实验方法
1.2.1 普鲁兰多糖提取工艺 发酵液预处理→板框过滤除菌→活性炭脱色→超滤除杂→浓缩→干燥。
板框过滤除菌:发酵液稀释至浓度30g/L,硅藻土添加量1.0%(w/v),滤布的孔径为600目。
超滤除杂:超滤膜的截留分子量为10ku,普鲁兰多糖溶液温度50℃,压力0.14MPa,普鲁兰多糖浓度30g/L,加水洗脱4次。
浓缩:水浴旋蒸浓缩至浓度为60g/L,水浴温度为80℃。
1.2.2 活性炭脱色实验
1.2.2.1 不同型号活性炭脱色实验 取4个三角瓶,均装100mL普鲁兰多糖溶液(30g/L),pH调至6.0,分别添加4种活性炭(表1所示)1.0%(w/v),然后于40℃热处理30min,再进行过滤,收集滤液。于654nm处测定吸光度值并计算脱色率和多糖得率。
1.2.2.2 活性炭添加量的选择 普鲁兰多糖溶液浓度为30g/L,脱色时间30min,脱色温度40℃,pH6,添加量分别以0.4%、0.6%、0.8%、1.0%、1.2%、1.4%(w/v)进行实验,以脱色率和多糖得率为指标,确定最佳活性炭添加量。
1.2.2.3 pH的选择 按照上面实验的最优活性炭添加量,普鲁兰多糖溶液浓度为30g/L,脱色时间30min,脱色温度40℃,pH分别以3、4、5、6、7、8进行实验,以脱色率和多糖得率为指标,确定最佳pH。
1.2.2.4 脱色时间的选择 按照上面实验的最优活性炭添加量及pH,普鲁兰多糖溶液浓度为30g/L,脱色温度40℃,脱色时间分别以20、30、40、50、60、90、120min进行实验,以脱色率和多糖得率为指标,确定最佳脱色时间。
1.2.2.5 脱色温度的选择 按照上面实验的最优活性炭添加量、pH及脱色时间,普鲁兰多糖溶液浓度为30g/L,脱色温度分别以室温25、40、50、60、70、80℃进行实验,以脱色率和多糖得率为指标,确定最佳脱色温度。
1.2.2.6 正交实验设计 为确定最佳的活性炭脱色条件,根据单因素实验结果确定活性炭用量、pH、脱色时间、脱色温度为4个主要因素的合适水平。以脱色率(Y)为指标,设计L9(34)型正交实验。正交实验因素水平见表2。

表2 正交实验设计各因素及水平Table 2 Levels of factors used in the orthogonal experimental design
1.2.3 普鲁兰多糖溶液不同干燥工艺
1.2.3.1 微波干燥条件 将浓缩后的普鲁兰多糖溶液平铺于聚四氟乙烯滤布上,厚度<0.3cm,置于微波箱内,功率为400W,温度为45~50℃,干燥时间为1.5min。粉碎,过筛(100目)[12]。
1.2.3.2 喷雾干燥条件 取浓缩后的普鲁兰多糖溶液,进风温度为180℃,出风温度为85℃,进料速度为25mL/min,雾化驱动,压力为0.4mPa[10]。
1.2.3.3 真空冷冻干燥条件 取浓缩后的普鲁兰多糖溶液平铺于平板中,厚度约为0.5cm,放于低温冰箱中预冻,直至溶液完全结冰。然后将平板置于真空冷冻干燥设备中干燥,真空冷冻干燥冷阱温度为-50℃,真空度为-0.09MPa,干燥时间为12h[13]。粉碎,过筛(100目)。
1.3 分析测定方法
1.3.1 脱色率的测定 将去除菌丝体的上清液用紫外可见分光光度计在654nm处测定其吸光值(OD值),OD值和色素含量成正比[14]。
脱色率(%)=(A0-A)/A0×100 式(1)
式中,A0:脱色前普鲁兰多糖溶液的色素含量;A:脱色后普鲁兰多糖溶液的色素含量。
1.3.2 普鲁兰多糖得率及纯度的测定 采用高效液相色谱法进行普鲁兰多糖含量的测定。样品制备:称取样品0.2000g于100mL容量瓶中,用流动相溶解,加入普鲁兰酶100μL定容,于58.5℃、150r/min酶解6h,然后85℃灭酶,用0.45μm的微孔滤膜过滤[15]。色谱柱:Luna 5u NH2100A 4.6mm×250mm;流动相:乙腈∶水=70∶30;流速为1.0mL/min;柱温:25℃;进样体积为20μL;标准曲线所用麦芽三糖标准品均购自Sigma公司。
普鲁兰多糖得率(%)=m0/m×100 式(2)
式中,m0:脱色后溶液中普鲁兰多糖的含量;m:脱色前溶液中普鲁兰多糖的含量。
普鲁兰多糖纯度(%)=m1/m×100 式(3)
式中,m1:干燥样品中普鲁兰多糖的质量;m:称取干燥后普鲁兰多糖样品的质量。
1.3.3 扫描电镜微观表征 取经过微波干燥、喷雾干燥、真空冷冻干燥的普鲁兰多糖固体粉末,采用SU-1510型扫描电镜于20kV条件下放大1000倍观察并采集图谱。
1.3.4 溶解度 称取经过微波干燥、喷雾干燥、真空冷冻干燥后的普鲁兰多糖固体粉末样品2g(精确至0.0001g)于100mL烧杯中,添加50mL的蒸馏水,放置磁力搅拌器上搅拌10min,用滤纸过滤(事先将滤纸置于105℃烘箱内干燥至恒重)。再用50mL的水分3次洗涤烧杯及滤纸,将附有滤渣的定量滤纸放入105℃烘箱内干燥2h,移入干燥器中冷却,30min后称量。再放入烘箱内烘1h,称量,直至恒重。
溶解度(%)=[m-(m1-m2)/m]×100 式(4)
式中,m:称取恒重的普鲁兰多糖的质量;m1:滤渣及滤纸的质量;m2:滤纸的质量。
1.3.5 色泽的测定 采用UltraScan Pro高精度分光测色仪测定普鲁兰多糖的L*、a*、b*值。其中,L*越大表示产品的透明度(L*=0为黑色,L*=100为白色);a*(正值)表示红色程度,(负值)表示绿色程度;b*(正值)表示黄色程度,(负值)表示蓝色程度[16]。L*越大表示颜色越白,a*、b*越大表示褐变和黄色程度越大。
2 结果与分析
2.1 脱色实验结果与分析
2.1.1 不同型号活性炭对脱色效果的影响 由图1可知,四种不同规格的活性炭脱色实验中,脱色效果最好的为D(ZY-24×48-B)型活性炭,其脱色率为91.33%,普鲁兰多糖得率为90.15%。这可能与活性炭本身性质有关,D(ZY-24×48-B)型活性炭的亚甲基蓝吸附值为16.0mL/0.1g,A法焦糖脱色率为120%,在四种活性炭中均处于最大值。由此可见,亚甲基蓝吸附值和A法焦糖脱色率的值越高,脱色效果越好。

图1 不同型号活性炭对脱色率和普鲁兰多糖得率的影响Fig.1 Influence of different activated carbon on decoloration and yield of pullulan polysaccharides
2.1.2 活性炭添加量对脱色效果的影响 如图2所示,随着活性炭用量的增大,脱色率不断增大,用量到1.0%(w/v)时脱色率达到最大值93.03%,继续增大用量,脱色率反而有所降低,而糖得率随着用量的增加呈下降趋势,用量到1.4%(w/v)时达到最小值87.95%。
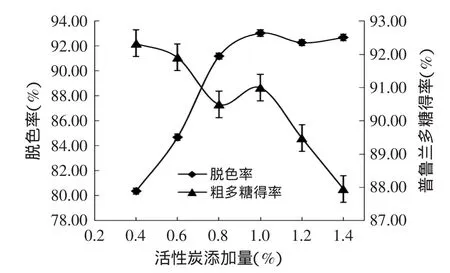
图2 活性炭添加量对脱色率及普鲁兰多糖得率的影响Fig.2 Influence of the amount of activated carbon on decoloration and yield of pullulan polysaccharides
2.1.3 pH对脱色效果的影响 如图3所示,随着pH的升高,脱色率和糖得率均呈现出先增大后降低的趋势,当pH为5时,脱色率达到最大值94.75%,糖得率为92.64%,pH继续升高时,脱色率和糖得率均呈下降趋势。

图3 pH对脱色率及普鲁兰多糖的率的影响Fig.3 Influence of pH on decoloration and yield of pullulan polysaccharides
2.1.4 脱色时间对脱色效果的影响 如图4所示,随着时间的延长,脱色率呈现出先增大后降低的趋势,当脱色时间为40min时,脱色率达到最大值94.15%,糖得率为90.77%,而多糖得率随时间的延长主要呈下降趋势,说明脱色时间越长,多糖得率就会越低。

图4 脱色时间对脱色率及普鲁兰多糖的率的影响Fig.4 Influence of time on decoloration and yield of pullulan polysaccharides
2.1.5 脱色温度对脱色效果的影响 如图5所示,随着温度的升高,脱色率和糖得率均呈现出先增大后降低的趋势,当温度为50℃时,脱色率达到最大值93.03%。多糖得率最高为91.54%,此时脱色温度为40℃,与50℃时多糖得率(91%)相差不大。选择最佳的脱色温度为50℃。
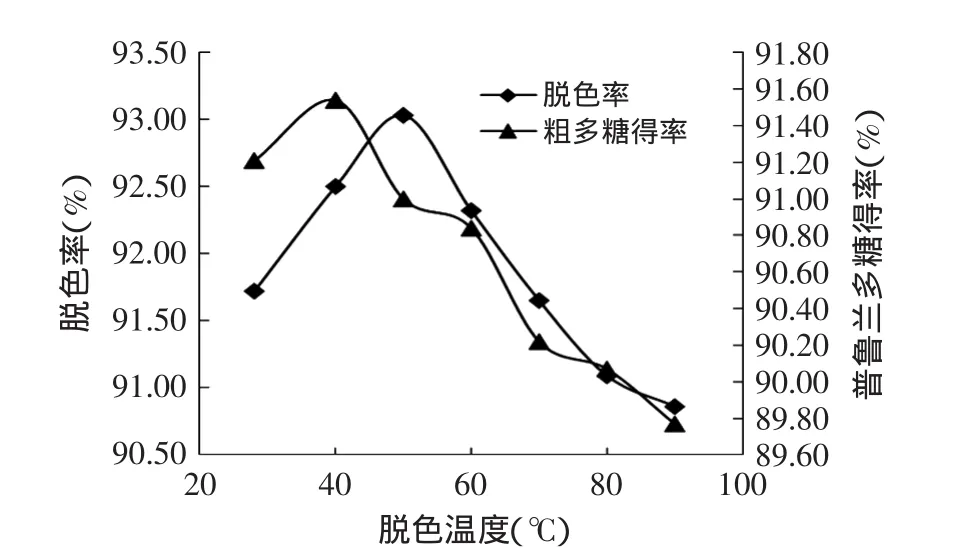
图5 脱色温度对脱色率及普鲁兰多糖的率的影响Fig.5 Influence of temperature on decoloration and yield of pullulan polysaccharides
2.1.6 活性炭脱色正交实验结果 由表3可以看出,影响活性炭脱色的因素由大到小为A>D>B>C,即影响活性炭脱色效果依次为活性炭添加量、温度、pH、时间。且从极差数值来看优化条件为A2B2C2D2,即活性炭添加量为1.0%(w/v)、pH为5,处理时间40min,处理温度为40℃。经验证实验在此条件下脱色率为94.98%,多糖得率为91.24%。
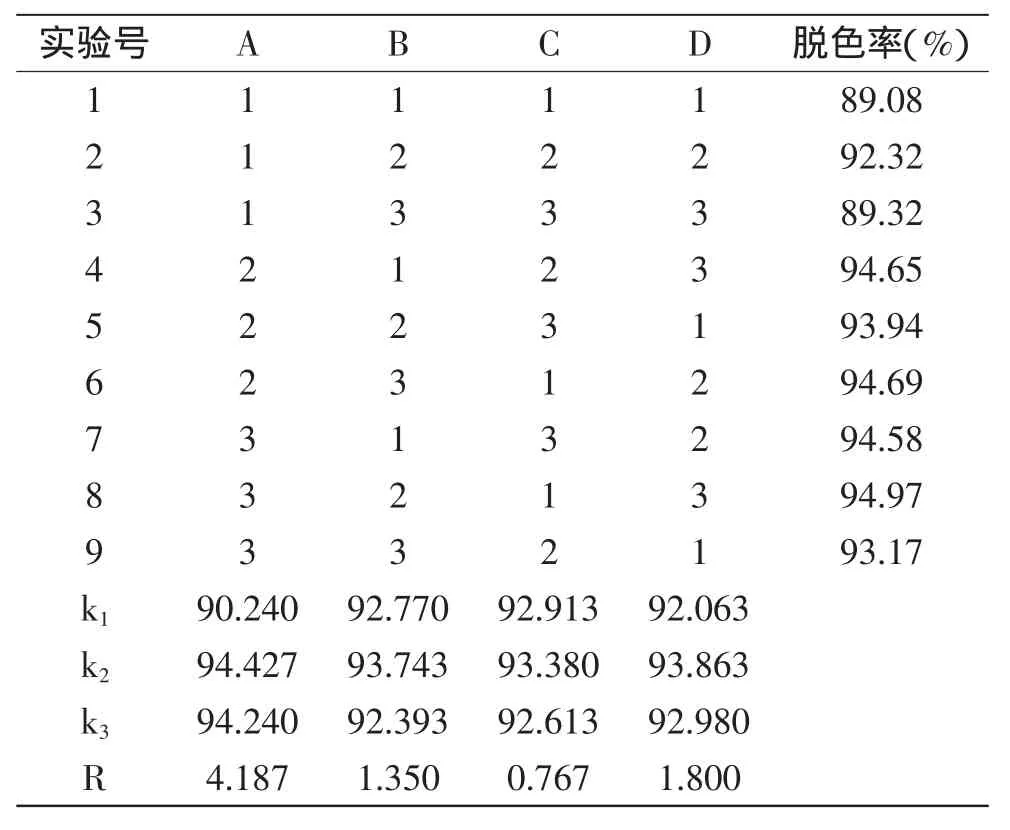
表3 活性炭脱色正交分析表Table 3 Activated carbon orthogonal analysis test
2.2 干燥方式对普鲁兰多糖品质的影响
2.2.1 不同干燥方式对普鲁兰多糖含量的影响 图6为普鲁兰多糖溶液在不同干燥方式下所得固体样品中的普鲁兰多糖纯度测定结果。由图6可知,在本文所说的实验条件下,普鲁兰多糖稳定性较好,相比较三种干燥方式,微波干燥所得到的的固体样中普鲁兰多糖纯度最高为92.26%,喷雾干燥所得固体样品纯度最低为91.07%。由此看出,在三种干燥方式所得到的普鲁兰多糖固体样品,微波干燥能够去除很大部分水分,从而得到纯度较高的产品,其次是冷冻干燥,最后为喷雾干燥。

图6 干燥方法对样品中普鲁兰多糖纯度的影响Fig.6 Influence of drying methods on purity of pullulan polysaccharides
2.2.2 不同干燥方式对普鲁兰多糖固体粉末微观表征的影响 图7为普鲁兰多糖溶液在不同干燥方式下所得到的的固体普鲁兰多糖(经100目过筛)的微观形貌特征。由图7看出,微波干燥的样品的颗粒表面出现较多孔洞,孔洞大而稀松;喷雾干燥的样品粒度小,大多呈现出干瘪的圆球体状,表面较光滑,少数呈现出较为圆球体状;冷冻干燥的样品颗粒呈现出小而密的孔洞。分析原因如下:微波加热是通过微波辐射到干燥的物料并穿透到物料内部时,诱使水等极性分子随之同步旋转,使物料瞬时产生摩擦,发出热量,从而导致物料表面和内部同时升温,且内部温度高于物料表面,使大量的水分子从物料中逸出而被蒸发掉,水分的急速蒸发后在组织结构中出现了较多细小通道,由于干燥中脱水速度快,致使组织畸变[17];喷雾干燥是将干燥室中的稀料经雾化后,在与热空气的接触中,水分迅速气化,达到瞬间干燥。由于干燥过程中水分要迅速的从物料中的溢出气化,故经喷雾干燥后直接形成小颗粒粉末状;冷冻干燥是将含水物质,先冻结成固态,而后使其中的水分从固态升华成气态,以除去水分而保存物质的方法。与其他干燥方式相比,冷冻干燥法基本上在0℃以下进行,干燥所得的产品不存在质地变硬的问题,可形成类似海绵状疏松多孔架构,加水后溶解迅速而完全,几乎立即恢复原来的性状。

图7 不同干燥方式下普鲁兰多糖的扫描电镜图Fig.7 The SEM photos of pullulan polysaccharides treated by different drying methods
2.2.3 不同干燥方式对普鲁兰多糖固体粉末溶解度的影响 由图8可知,微波干燥、喷雾干燥和冷冻干燥所得到的的普鲁兰多糖固体粉末,冷冻干燥得到的样品溶解时更容易且速度最快,其次为喷雾干燥,微波干燥得到的样品溶解较难,且速度最慢。分析原因如下:冷冻干燥所得到的的样品疏松孔隙较多,更容易吸水复溶,喷雾干燥的样品不需要经过粉碎,粉末颗粒极小,故比表面积大,吸水速度也较快,而经过微波干燥的样品,虽然空隙也较大但是质地较硬,样品溶解度较差。

图8 三种干燥方式所得普鲁兰多糖的溶解度Fig.8 Solubility of pullulan polysaccharides by three drying methods
2.2.4 不同干燥方式对普鲁兰多糖固体粉末色泽的影响 表4中L值表示透明度,a值表示红绿色度(正代表红色程度,负代表绿色程度),b值表示黄蓝色度(正代表黄色程度,负代表蓝色程度)。运用SPSS19.0分析统计软件对表中数据进行方差分析可知,L值、a值、b值之间差异极显著(p<0.01),且L值极显著高于a值和b值,微波干燥、喷雾干燥和冷冻干燥三种干燥方式之间差异不显著(p>0.05)。由数据可以看出,冷冻干燥的产品L值最大,a值和b值最小,表现出样品色泽为白色,红绿色度和黄蓝色度最低,主要是因为冷冻干燥时物料未受高温影响,产品不发生褐变反应。喷雾干燥制备的产品L值次之,a值和b值较冷冻干燥的样高,产品表现出较白的颜色,略显出黄色,这是因为喷雾干燥过程有褐变发生,但由于干燥处理的时间短,褐变程度较小。微波干燥的产品L值最小,a值和b值较大,产品表现出较明显的淡黄色,这说明微波干燥过程中发生褐变反应较为严重,这与微波干燥温度时间较长有关。
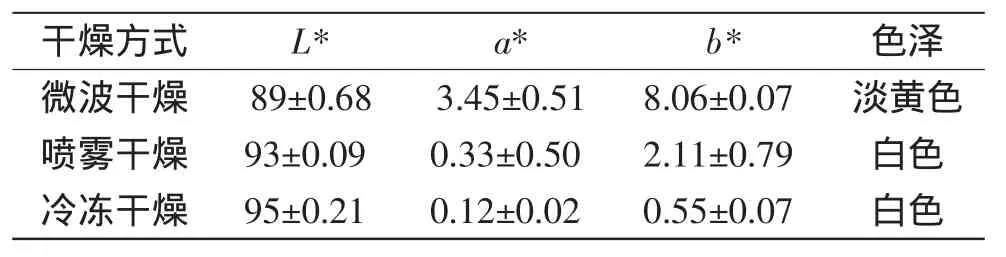
表4 干燥方式对普鲁兰多糖固体粉末色泽的影响Table 4 Influence of drying methods on colour of pullulan polysaccharides
3 结论
3.1 经过活性炭脱色实验,选择D(ZY-24×48-B)型活性炭,脱色条件为活性炭添加量为1.0%(w/v)、pH为5,时间40min,处理温度为40℃,此时脱色率为94.98%,多糖得率为91.24%。
3.2 综合考虑普鲁兰多糖固体纯度、溶解度及色泽,从微波干燥、喷雾干燥和真空冷冻干燥中选择最佳的干燥方式为真空冷冻干燥,其次为喷雾干燥。若进行工业化生产需考虑成本,则可首选喷雾干燥的方式。
[l]Thomas J Polloek.Isolation of new aureobasidium strains that produce high-moleeular-weight pullulan with reduced pigmentation[J].Applied and Environmental Microbiology,1992,58(3):877-888.
[2]Leathers TD.Biotechnological production and applications of pullulan[J].Appl Microbiol Biotechnol,2003,62(5):468-473.
[3]刘清泉.几种极具商业价值的新型微生物多糖的功能及应用[J].中国食品添加剂,2004(6):7-13.
[4]孙婷.不同干燥方法刺五加多糖含量的测定[J].中国食品学报,2006,6(4):137-140.
[5]焦莎莎,付湘晋,童群义.短梗霉多糖发酵液后处理工艺研究[J].食品与生物技术学报,2007,26(4):93-96.
[6]吕蕾.茁霉多糖分离纯化工艺研究[D].长春:吉林农业大学,2007.
[7]刘谋泉,孔美兰.普鲁兰多糖VC营养软糖的研制[J].食品研究与开发,2009,30(7):70-74.
[8]连正淦,童群义.普鲁兰多糖软胶囊胶皮配方优化研究[J].食品工业科技,2012,33(11):283-286.
[9]王雪松.出芽短梗霉原生质体激光诱变及普鲁兰的纯化和表征[D].长春:吉林大学,2003.
[10]牛登飞.发酵液中普鲁兰多糖提取工艺条件的研究[D].无锡:江南大学,2009.
[11]卢星达,汪建明,马晓蕾.响应面法优化普鲁兰多糖发酵培养基[J].中国食品添加剂,2012(S1):159-163.
[12]杨俊红,张恒春,邸倩倩,等.不同干燥方式对黄芪提取物品质的影响[J].干燥技术与设备,2007,5(5):225-229.
[13]白云鹏,夏文水.不同干燥方式对甲壳低聚糖品质的影响[J].食品与生物技术学报,2011,30(6):857-862.
[14]周德庆.微生物学教程[M].高等教育出版社,2002:223-224.
[15]Ram S Singh,Gaganpreet K Saini,John F Kennedy. Downstream processing and characterization of pullulan from a novel colour variant of Aureobasidium pullulans FB-1[J]. Carbohydrate Polymers,2009,78:89-94.
[16]Sueli Rodrigues,Fabiana A N,Femands.Dehydration of melons in a ternary system followed by air-drying[J].Journal of Food Engineering,2007,80(2):678-687.
[17]于静静,毕金峰,丁媛媛.不同干燥方式对红枣品质特性的影响[J].现代食品科技,2011,27(6):610-614.
Influence of decolorization and drying methods on the quality of pullulan polysaccharides
GAO Xuan-xuan1,ZHENG Zhi-da2,MENG Di2,SONG Ya-qiong2,HAO Hua-xuan3,WANG Jian-ming1,QIAO Chang-sheng2,3,*
(1.Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China;2.Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,Tianjin University of Science and Technology,Tianjin 300457,China;3.Tianjin Peiyang Biotrans Co.,Ltd.,Tianjin 300457,China)
The decoloration and the influence of drying methods on the quality of pullulan polysaccharides were mainly studied.First,the type of ZY-24×48-B was selected from four types of activated carbon.Based on the single factor result,orthogonal experiment was performed to select the best condition for decoloration of pullulan.The best technological process of decoloration was adding 1.0%(w/v)activated carbon to pullulan solution at 40℃,with pH at 5.0 and decoloring the solution for 40min.The decolorization rate was 94.98%,pullulan polysaccharide yield was 91.24%.Then the suitable drying methods of pullulan polysaccharides for industrialized production was determined which was depended on the effect ofmicrowave drying,spray drying and vacuum freeze drying on the quality of the purity of pullulan polysaccharides,tmicroscopic characterization,solubility and colour.The test indicated that the colour of spray dried product were better than that of microwave dried(L=89±0.68)but less than vacuum freeze dried(L=95±0.21).The purity of pullulan polysaccharides was 91.07%which was obtained by spray drying,and exhibited the better solubility and colour.The vacuum freeze dried product had the best solubility,but it had long time and high cost.Among the three drying methods,spray drying was the most suitable for the actual industrial production.
pullulan;decolor;drying methods;quality
TSX201.2+3
B
1002-0306(2014)14-0250-06
10.13386/j.issn1002-0306.2014.14.047
2013-10-09 *通讯联系人
高璇璇(1988-),女,硕士研究生,主要从事食品产品与技术开发。
