Syk调控单增李斯特菌感染中炎症复合体的活化*
2014-02-28刘倩倩刘运德冯香梅刘晓春邸宝华申艳娜
刘倩倩 刘运德 张 琼 李 雪 冯香梅 刘晓春 邸宝华 申艳娜
单增李斯特菌(Listeria monocytogenes,LM)是一 种人畜共患病的病原菌,可在免疫功能低下的个体中引起败血症等严重的感染性疾病[1]。机体主要利用固有免疫应答及细胞免疫应答的协同作用对其进行防御与清除[1-2]。炎症复合体(inflammasome)是主要表达于固有免疫细胞内的多蛋白复合物,可感知胞浆内病原微生物代谢产物及宿主危险信号[3-5],招募并活化半胱氨酸蛋白酶caspase-1,进而调控促炎性细胞因子白细胞介素(IL)-18、IL-1β的加工及活化。目前已发现NLRP1、NLRP3、AIM2、IPAF等4种炎症小体[6-8],其中NLRP3、AIM2、IPAF炎症复合体在LM感染过程中被活化[9]。近年来有研究报道白色念珠菌、烟曲霉菌等真菌可通过蛋白酪氨酸激酶syk介导的信号通路来激活NLRP3炎症复合体的活化[10-11]。本研究旨在探讨LM感染过程中炎症复合体的活化是否也通过蛋白酪氨酸激酶syk介导的信号通路调控。
1 材料与方法
1.1 材料 (1)实验动物。清洁级C57BL/6雌性小鼠20只,7~12周龄,购自北京军事医学科学院动物中心,许可证编号:SCXK-(军)2012-0004。(2)主要试剂。syk抑制剂BAY117082(BAY),P38MAPK抑制剂SB203580(SB),PI3K抑制剂wor⁃tamine(WO,Calbiochem)。巯基乙酸盐肉汤,胰酶大豆琼脂TSA,多聚甲醛,Polyclonal rabbit anti-mouse ASC抗体(Sig⁃ma-Aldrich),荧光二抗Alexa Fluro 594 donkey anti-rabbit IgG(invivogen),DAPI染液(Roche),磷酸化非受体型酪氨酸蛋白激酶(p-syk)抗体和非受体型酪氨酸蛋白激酶(t-syk)抗体,anti-rabbit HRP标记IgG二抗(Cell Signaling Technology),庆大霉素(和研纯化学株式会社),脑心浸液(BHI)和脱脂牛奶(Difco),胎牛血清FBS(Hyclone),IL-18酶联免疫吸附测定(ELISA)试剂盒(MBL)。(3)主要仪器。Nikon免疫荧光显微镜(Ni-U),Biotek酶标仪(ELx-800),PowerPac Universal电泳仪电源、MiniPROTEIN tetraCell垂直电泳槽、TRANS-BLOT SD转移电泳槽(美国Bio-Rad公司)。
1.2 方法
1.2.1 小鼠腹腔巨噬细胞的分离纯化 小鼠腹腔内注射3%巯基乙酸盐肉汤3 mL,4 d后用RPMI1640 5 mL收集小鼠腹腔渗出细胞。1 000 r/min,4℃,离心5 min,洗涤2次,然后用10%FBS的RPMI1640培养基调整细胞浓度,并接种于细胞培养板中,2 h后使用PBS洗去悬浮细胞,96%的贴壁细胞是巨噬细胞。
1.2.2 LM野生株EGD的增殖与保存 LM野生株EGD(日本京都大学医学研究科微生物感染症学所惠赠)BHI培养基中37℃过夜增菌。取1体积的过夜菌悬液加入到100体积的BHI培养基中震荡培养4~5 h,加入PBS离心洗涤3次,将沉淀悬浮于含有10%甘油的PBS后分装储存于-80℃冰箱。3 d后随机抽取3管LM,利用10倍倍比稀释法检测LM浓度,即菌液稀释后涂布于胰酶大豆琼脂(TSA)平板,37℃过夜培养后进行菌落计数。
1.2.3 ELISA检测 将小鼠腹腔渗出细胞以1×105个/孔接种于96孔培养板,分为阴性对照组(NI)、未处理组、BAY处理组、SB处理组、WO处理组,每组设置3个重复孔,对BAY处理组、SB处理组、WO处理组分别用抑制剂BAY、SB203580、wortamine预处理细胞1 h,除阴性对照组外,其余组按1×105cfu/孔的菌量加入LM感染30 min,再加入终浓度为10 mg/L的庆大霉素继续培养24 h,收集上清液,ELISA法检测IL-18。
1.2.4 免疫荧光检测 将小鼠腹腔渗出细胞以1×106个/孔接种于已放置细胞爬片的12孔板,BAY处理组用抑制剂BAY预处理细胞1 h后,除阴性对照组外其余各孔均加入1×106cfu LM感染细胞30 min,然后加入终浓度为10 mg/L庆大霉素继续培养24 h,PBS洗涤2次,4%多聚甲醛室温下固定15 min,加入抗ASC抗体室温孵育2 h后,PBS洗涤4次,加入带红色荧光的二抗孵育2 h,PBS洗涤4次,DAPI染细胞核5 min,PBS洗涤4次,将玻片取出封埋。荧光显微镜下观察200个细胞,计数细胞胞浆内ASC-speck(红色荧光高亮点)的形成个数,并计算出ASC-speck阳性细胞的百分比。
1.2.5 免疫印迹检测 将小鼠腹腔渗出细胞以2×106个/孔接种于12孔培养板,按5×105cfu/孔的菌量加入LM感染小鼠腹腔巨噬细胞5、15、30 min,细胞裂解液裂解细胞后提取蛋白,行SDS-PAGE,将蛋白转至PVDF膜后,脱脂牛奶室温下封闭2 h,用p-syk抗体或t-syk抗体4℃过夜孵育,TBST洗涤3次,每次10 min,标记HRP的IgG二抗室温下孵育1 h,TBST洗涤3次,每次10 min,暗室曝光。
1.3 统计学方法 采用SPSS 13.0软件进行统计分析,计量资料以±s表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果

Figure 1 Effects of different inhibitors on the level of IL-18 during LM infection图1 不同抑制剂处理对LM感染过程中IL-18的生成的影响(*P<0.05)
2.1 不同抑制剂对LM感染细胞产生IL-18水平的影响 见图1。ELISA结果显示BAY处理前后阴性对照组小鼠腹腔巨噬细胞IL-18蛋白表达水平无明显变化(t=0.127,P>0.05),而未处理组小鼠腹腔巨噬细胞感染LM后产生的IL-18表达水平较阴性对照组显著升高,BAY处理组小鼠腹腔巨噬细胞产生的IL-18蛋白水平则较未处理组下降(t=11.181,P<0.05);SB处理组、WO处理组、未处理组小鼠腹腔巨噬细胞产生的IL-18表达水平差异无统计学意义(F=2.958,P>0.05)。
2.2 BAY处理对LM感染巨噬细胞胞浆内ASC-speck形成个数的影响 BAY处理组ASC-speck阳性细胞的百分比(1.27±1.07)%较未处理组ASC-speck阳性细胞的百分比(45.81±6.03)%明显降低(t=41.109,P<0.01),见图2。
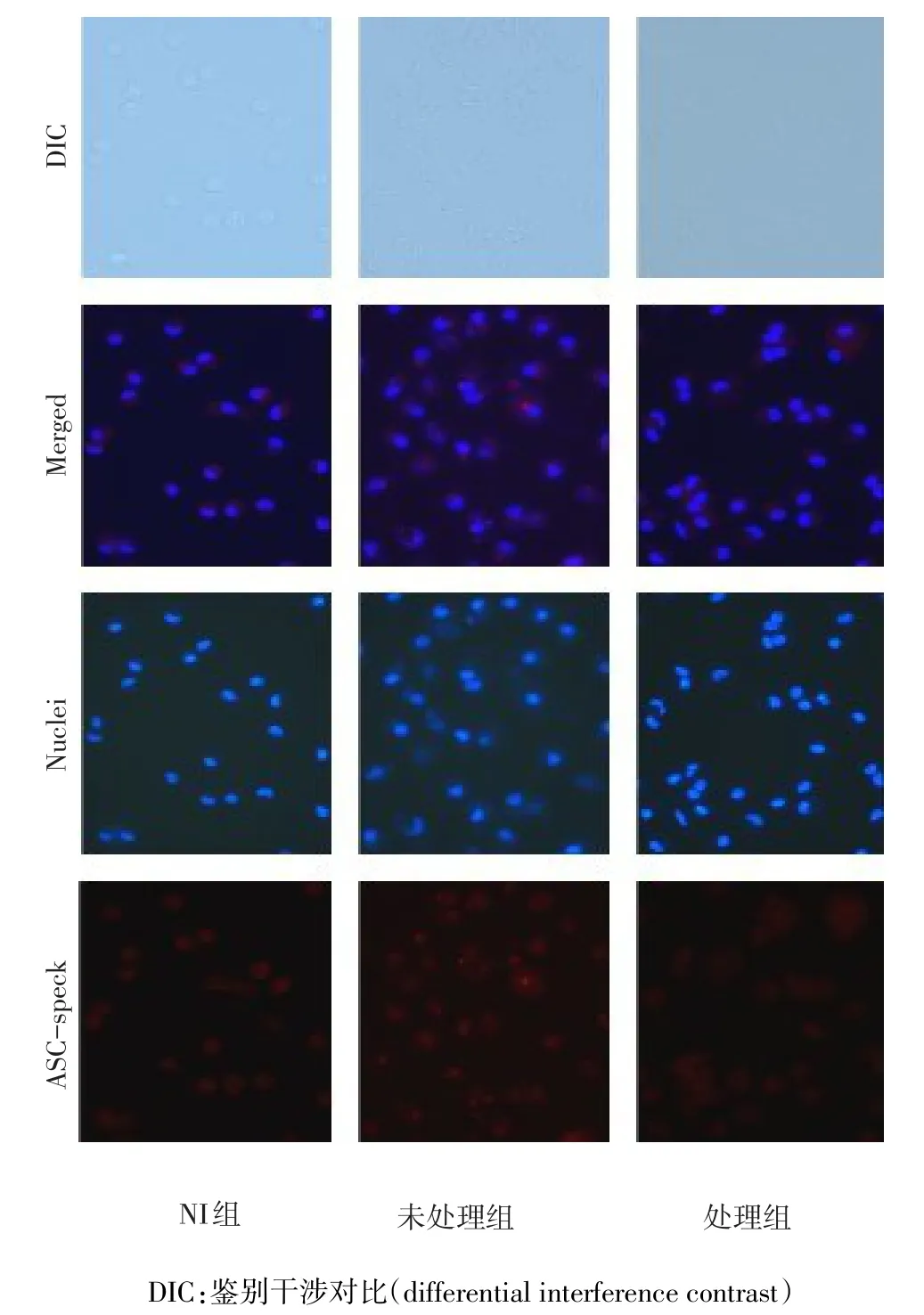
Figure 2 Comparison of the number of ASC-speck in macrophages pretreated with or without BAY after LM infection under immunofluorescence microscope(×40)图2 荧光镜下BAY处理前后LM感染巨噬细胞胞浆内ASC-speck的形成个数比较(×40)
2.3 LM感染不同时相点t-syk蛋白表达及p-syk水平 Western blot结果显示,与阴性对照组相比,LM感染后t-syk蛋白表达无明显差别,而p-syk水平在5、15、30 min时均有显著增高,见图3。

Figure 3 Expression levels of t-syk and p-syk in macrophages after LM infection at different time points图3 LM感染小鼠腹腔巨噬细胞t-syk表达和p-syk水平随时间的变化情况
3 讨论
LM作为感染人群的重要病原微生物,可侵害多种机体细胞,尤其是固有免疫细胞中的巨噬细胞,LM感染细胞后,进入胞吞体,再借助李斯特菌溶血素(listeriolysin O,LLO)逃逸至胞浆内生存并增殖[12]。而宿主细胞通过炎症复合体中的关键蛋白识别胞浆内病原微生物代谢产物,进而激活caspase-1,促使炎性细胞因子IL-1b、IL-18等的成熟与分泌,诱导细胞免疫应答,进而杀灭入侵机体的LM。在LM感染中可涉及3种炎症小体,包括NLRP3、AIM2、IPAF炎症复合体[9],但是炎症复合体形成的具体分子机制尚不明确。
新近研究表明真菌类如白色念珠菌(Candida albicans)、烟曲霉菌(Aspergillus fumigatus)等可通过syk信号通路介导NLRP3炎症复合体的活化,进而诱导机体免疫应答[10-11],本研究在此基础上利用非受体型酪氨酸蛋白激酶syk及P38MAPK,PI3K信号蛋白激酶抑制剂BAY、SB、WO分别预处理小鼠腹腔巨噬细胞后感染LM,结果显示仅BAY处理能显著降低巨噬细胞产生的IL-18水平,而SB和WO处理对IL-18表达没有影响,表明syk信号通路而非PI3K、P38MAPK信号通路参与调控LM感染过程中IL-18的加工与成熟。
炎症复合体是活化caspase-1所必需的分子平台,其活化后,通过接头蛋白ASC与胞内的procas⁃pase-1蛋白结合,对procaspase-1进行加工和激活,使宿主细胞产生依赖caspase-1活化的IL-18和IL-1β等细胞因子[8]。在LM感染过程中,LM是否是通过syk介导的信号通路调控炎症复合体的活化来实现IL-18的生成仍不明确。近年研究报道炎症复合体活化后可形成ASC-speck点状聚集[13],本研究显示,在BAY处理组,LM感染后小鼠巨噬细胞胞浆内ASC-speck阳性的细胞百分比较未处理组明显降低,表明syk是通过调控ASC-依赖的炎症复合体的活化调节IL-18的生成,并且syk在LM感染小鼠巨噬细胞的过程中对于炎症复合体的形成发挥重要作用。
为了进一步明确LM感染过程中syk的作用阶段及活化程度,本研究利用Western blot检测p-syk的水平,结果显示LM感染最早期syk的磷酸化水平即有明显升高,表明syk确实在LM感染过程中发挥作用,syk通过参与调控LM感染后炎症复合体的装配与活化,进而促进IL-18的表达。本研究结果与真菌类通过syk信号通路调节NLRP3炎症复合体活化的研究结果一致[10-11],说明syk不仅可以调控真菌类炎症复合体的活化,而且调控细菌LM感染过程中炎症复合体的活化。此外,在石棉、粉尘污染诱发的慢性肺炎[14],以及痛风性关节炎等过程中,NLRP3炎症复合体的活化起着关键作用[15],但其分子机制尚不清楚,本研究以及新近报道的真菌类研究将为这些炎症的发病机制,以及临床探索炎症及感染性疾病的新干预途径提供理论依据。
[1]Pamer EG.Immune responses to Listeria monocytogenes[J].Nat Rev Immunol,2004,4(10):812-823.
[2]Matzinger P.The danger model:a renewed sense of self[J].Science, 2002,296(5566):301-305.
[3]Zhang Q,Raoof M,Chen Y,et al.Circulating mitochondrial DAMPs cause inflammatory responses to injury[J].Nature,2010,464 (7285):104-107.
[4]Kanneganti TD,Lamkanfi M,Núñez G.Intracellular NOD-like re⁃ceptors in host defense and disease[J].Immunity,2007,27(4):549-559.
[5]Kawai T,Akira S.The roles of TLRs,RLRs and NLRs in pathogen recognition[J].Int Immunol,2009,21(4):317-337.
[6]Torres D,Barrier M,Bihl F,et al.Toll-like receptor 2 is required for optimal control of Listeria monocytogenes infection[J].Infect Im⁃ mun,2004,72(4):2131-2139.
[7]Kim YG,Park JH,Shaw MH,et al.The cytosolic sensors Nod1 and Nod2 are critical for bacterial recognition and host defense after ex⁃posure to Toll-like receptor ligands[J].Immunity,2008,28(2):246-257.
[8]Lamkanfi M,Dixit VM.Inflammasomes:guardians of cytosolic sanc⁃tity[J].Immunol Rev,2009,227(1):95-105.
[9]Wu J,Fernandes-Alnemri T,Alnemri ES.Involvement of the AIM2,NLRC4,and NLRP3 inflammasomes in caspase-1 activation by listeria monocytogenes[J].J Clin Immunol,2010,30(5):693-702. [10]Gross O,Poeck H,Bscheider M,et al.Syk kinase signaling couples to the Nlrp3 inflammasome for anti-fungal host defence[J].Nature, 2009,459(7245):433-436.
[11]Saïd-Sadier N,Padilla E,Langsley G,et al.Aspergillus fumigatus Stimulates the NLRP3 inflammasome through a pathway requiring ROS production and the syk tyrosine kinase[J].PLos One,2010,5 (4):e10008.
[12]Wallecha A,Laurence W,Pan ZK,et al.Listeria monocytogenes-de⁃rived Listeriolysin O has pathogen-associated molecular patternlike properties independent of its hemolytic ability[J].Clin Vaccine Immunol,2013,20(1):77-84.
[13]Huang MT,Taxman DJ,Holley-Guthrie EA,et al.Critical role of apoptotic speck protein containing a caspase recruitment domain (ASC)and NLRP3 in causing necrosis and ASC speck formation in⁃duced by porphyromonas gingivalisin human cells[J].J Immunol, 2009,182(4):2395-2404.
[14]Dostert C,Ptrilli V,Bruggen RV,et al.Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica[J].Sci⁃ence,2008,320(5876):674-677.
[15]Giamarellos-Bourboulis EJ,Mouktaroudi M,Bodar E,et al.Crystals of monosodium urate monohydrate enhance lipopolysaccharidein⁃duced release of interleukin 1 beta by mononuclear cells through a caspase 1-mediated process[J].Ann Rheum Dis,2009,68(2): 273-278.
