铂纳米线阵列电极对肼的电催化性能
2014-02-27王学华刘文琪刘莉君马凡杰王华龙
王学华,刘文琪,刘莉君,马凡杰,王华龙
武汉工程大学材料科学与工程学院,湖北 武汉430074
0 引 言
直接液体燃料电池是以液体为燃料的一种能量转换装置,因其具有高能量转换效率、燃料易于储存和运输、低温运行、组装简单等优点,受到了广泛的关注和研究,这类燃料电池多选择各类有机小分子(如甲醇、甲酸、乙醇)和含氢率高的化合物(如硼氢化物和肼等)作为燃料[1-3].近年来,直接甲醇燃料电池(DMFC)、直接甲酸燃料电池(DFAFC)是国内外学者研究最广泛的燃料电池,但DMFC的阳极催化剂活性低,甲醇氧化的中间产物(如CO)易使催化剂中毒,DFAFC比能量低等原因限制了它们的广泛应用[4-8].肼(N2H4)是一种理想的燃料,它的含氢量高达12.5%(质量分数),与甲醇相同,当N2H4发生电化学氧化时,只有氮气和水产生,不会排放温室效应气体CO2.研究表明,N2H4电化学氧化过程不会产生像DMFC那样使催化剂中毒的中间产物.直接肼燃料电池(DHFC)能量密度为5.42 W·h/g,理论能量转换效率为100 %,而且DHFC的理论电动势为1.62 V,高于DMFC的理论电压,其电极与电池反应过程如下:
阴极:O2+2H2O+4e-→4OH-
阳极:N2H4+OH-→N2+4H2O+4e-
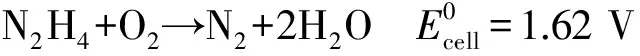
近年来,不同金属(Pt、Au、Pd等)纳米电极对肼的催化氧化已被广泛研究,且都表现出一定的催化性能[9-13],然而大多为负载型或修饰型电极,本文以通孔的氧化铝模板(AAO)为载体沉积铂(Pt)纳米线,制备了Pt纳米线阵列电极(Pt/AAO),研究 Pt/AAO纳米线阵列电极对肼的电催化氧化性能.
1 实验过程
1.1 Pt纳米线阵列电极的制备
在0.3 M草酸溶液中采用50 V恒压二次阳极氧化法制备AAO模板,经过饱和HgCl溶液去铝基底、磷酸扩孔后得到自支撑的AAO薄膜,将其镀金后备用,详细过程见文献[14].采用LK3200电化学工作站以三电极体系在-0.35 V(vs饱和甘汞电极)电位条件下直流电沉积Pt纳米线,从而制得Pt纳米线阵列电极.电解液成分:H2PtCl2·6H2O浓度为5×10-3mol/L,H3BO3质量浓度为30 g/L;沉积时间1 h.
1.2 电化学测试
分别以Pt/AAO、Pt柱电极作为工作电极,饱和甘汞电极为参比电极,石墨电极为对电极,形成三电极体系.测试前需要将Pt/AAO纳米线阵列电极在1 mol/L NaOH溶液中腐蚀几分钟后,再在0.1 mol/L H2SO4溶液中以循环伏安法扫描3次,对电极进行活化处理.分别用循环伏安法(C-V法)和计时电流法(I-T法)测试Pt/AAO、Pt柱电极对肼的催化氧化性能.每次实验前,均需去除溶解氧,实验中的试剂均为分析纯,且都采用二次蒸馏水配置.实验过程如图1所示.

图1 Pt纳米线阵列电极的制备过程
1.3 Pt纳米线阵列的表征
采用荷兰帕纳科公司生产的X'Pert PRO型X射线衍射仪(Cu靶,加速电压40 kV,加速电流20 mA,扫描速度8(°)/min)对沉积有Pt纳米线的AAO样品进行物相分析;将样品在1 mol/L NaOH溶液中腐蚀几分钟去除部分模板使其露出Pt纳米线,再采用场发射扫描电镜(Sirion 200,FEI)观察其形貌结构.
2 结果与讨论
2.1 Pt纳米线的结构表征
图2所示为未腐蚀的Pt /AAO样品表面和经质量分数为5% 的NaOH腐蚀去除部分模板后Pt纳米线的SEM形貌图.由图2(a)可看到,Pt纳米线填充了AAO模板上的纳米孔洞,线径与模板孔径大小一致,约为50 nm.图2(b)可看到,当表面的部分模板被腐蚀后,露出Pt纳米线,但由于失去了AAO模板的支撑,纳米线倒塌形成类似草垛的形状.

(a)未腐蚀前

(b) 质量分数5% NaOH腐蚀后
图3为Pt/AAO样品的XRD图谱,由图中可看出,2θ在25°附近的馒头峰为AAO模板的非晶衍射峰;2θ为38.8°、46.1°和66.8°时出现的衍射峰属于面心立方结构Pt(111)、(200)、(220)晶面的衍射峰,表明在直流电沉积能够成功地在AAO模板中沉积Pt纳米线,且结晶良好.同时可以看出,在所有的衍射峰中,Pt(111)的衍射峰强度最强,根据谢乐公式计算其所对应的晶粒尺寸为5.8 nm,其它衍射峰强度均较弱,表明所制备的Pt纳米线有沿Pt(111)晶面择优取向的趋势;衍射图谱中没有出现其它明显的杂质峰.

图3 Pt/AAO纳米线阵列的XRD图谱
2.2 Pt纳米线阵列电极的催化氧化活性
图4(a)所示是Pt纳米线阵列电极分别在N2H4浓度为0 mmol/L、10 mmol/L、20 mmol/L、50 mmol/L的KCl溶液(0.1M)中测试的C-V曲线.由图可知,当N2H4的浓度为0时,在-0.5 V、-0.2 V左右处出现了一个明显的氧化峰,是由于H2O的H—O键发生断裂,在电极表面发生析氢反应.随着N2H4浓度的增加,析氢反应同样存在,但是在0.35 V附近增加了一个氧化峰,且随着N2H4浓度的升高,在0.35 V附近的氧化电流密度逐渐增加,表明在该电位发生了Pt纳米线阵列电极对N2H4催化氧化反应,且当N2H4浓度增加到50 mmol/L时,电流密度可达到48 mA/cm2,说明Pt纳米阵列电极对N2H4有较强的电催化氧化活性.但此时氧化电位正移到0.7 V,氧化峰位右移的主要原因可能是由于肼浓度增加在电极表面造成了浓差极化,抬高了氧化反应电位.
图4(b)是Pt纳米阵列电极与Pt柱电极在N2H4浓度为50 mmol/L的0.1M KCl溶液中的C-V曲线对比图,由图可知,Pt纳米阵列电极有明显的析氢反应,而Pt平板电极则不太明显,正向扫描时Pt纳米线阵列电极对N2H4的催化氧化电流密度达到48 mA/cm2,而Pt柱电极为16 mA/cm2,仅相当于纳米线阵列电极的1/3.表明Pt纳米线阵列电极对N2H4具有更高的催化活性,主要是由于纳米线比表面积的增大导致其对N2H4的催化活性增强.
图4(b)是Pt纳米阵列电极与Pt柱电极在N2H4浓度为50 mmol/L的0.1M KCl溶液中的C-V曲线对比图,由图可知,Pt纳米阵列电极有明显的析氢反应,而Pt平板电极则不太明显,正向扫描时Pt纳米线阵列电极对N2H4的催化氧化电流密度达到48 mA/cm2,而Pt柱电极为16 mA/cm2,仅相当于纳米线阵列电极的1/3.表明Pt纳米线阵列电极对N2H4具有更高的催化活性,主要是由于纳米线比表面积的增大导致其对N2H4的催化活性增强.
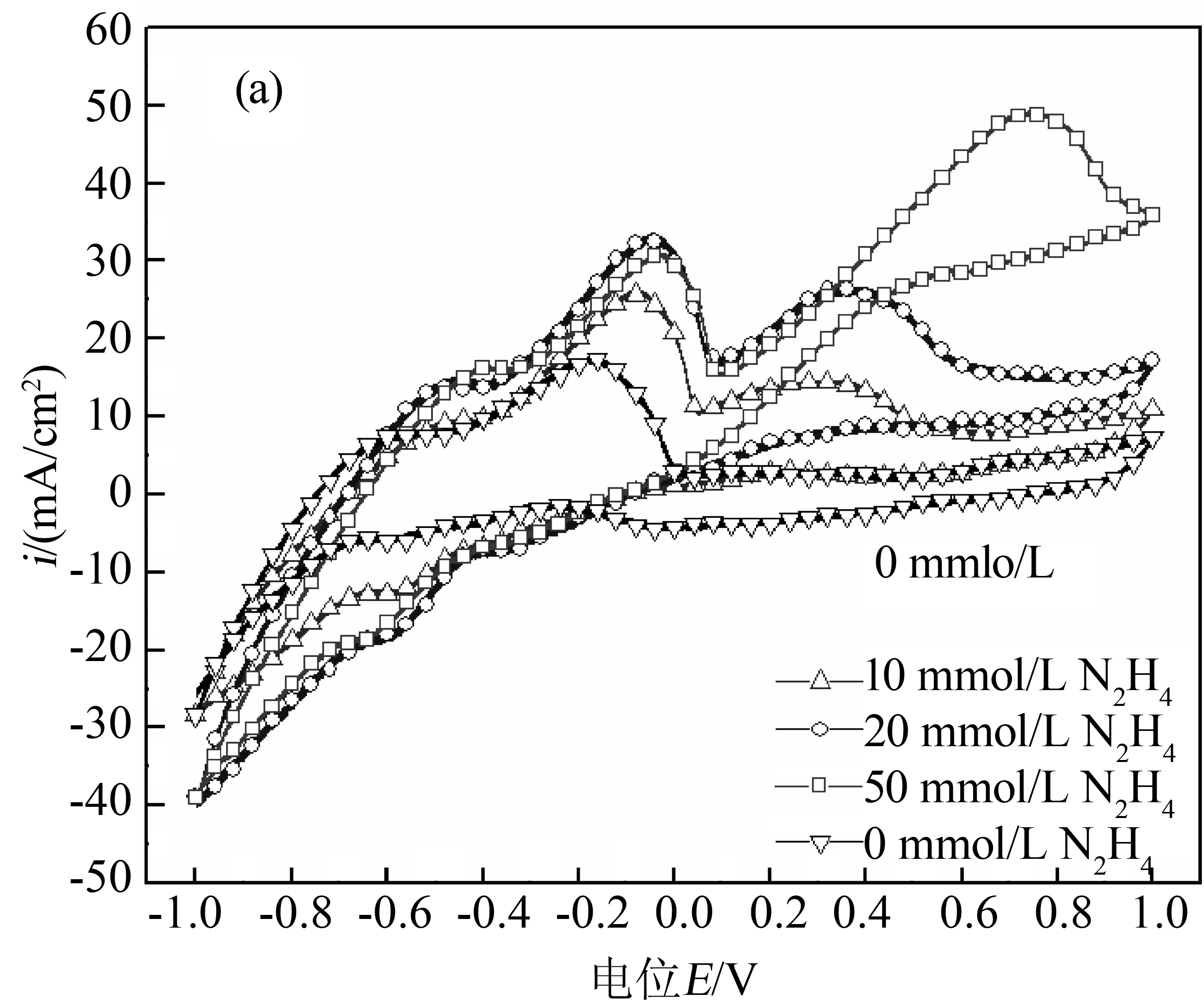
(a)在不同N2H4浓度时的C-V曲线

(b)N2H4浓度为50 mmol/L的C-V曲线
扫描速率的改变会引起C-V曲线中氧化电流密度的改变,同时氧化电位也会发生移动.图5(a)所示是Pt纳米线阵列电极在含50 mmol/L N2H4的0.1M KCl水溶液中以不同扫描速率测试得到的C-V曲线图,可以看出氧化电流密度随扫描速率的增大而增大,且氧化电位也随之正移,这是因为随着扫描速率的增大,溶液中肼来不及扩散到电极表面以及电极表面氧化物的还原滞后造成的.图5(b)为氧化峰值电流密度与v1/2的关系图,可以看出,ip值与v1/2呈正比线性关系,这与Randles和Sevcic公式(式1)相吻合,即氧化峰的电流密度与扫描速率的平方根成正比,表明N2H4浓度为50 mmol/L时其催化氧化反应是受扩散步骤控制的[15].
ip=269n3/2AD1/2v1/2C0
(1)
其中,n表示交换的电子数;A表示电极面积,cm2;D表示扩散系数,cm2/s;C0表示溶液的本体浓度,mol/mL.因此,肼的氧化不仅受溶液中肼扩散传质的影响,而且与肼本身的解离和氧化以及纳米线电极本身的氧化还原等有关.

(a)在不同扫描速率下的C-V曲线

(b)氧化峰值ip与v1/2的关系图
2.3 Pt纳米阵列电极的催化稳定性
为了分析Pt纳米线阵列电极在肼氧化过程中的稳定性,采用计时电流法分别分析了在氧化电位为0.35 V时,Pt纳米线阵列电极与Pt柱电极在N2H4浓度为50 mmol/L的KCl(0.1M)水溶液中的I-T曲线,如图6所示.由于反应中间产物的吸附,最初的电流下降很快,而随着反应时间的增加,电流密度逐渐达到平衡.当电流达到稳定状态时,Pt纳米线阵列电极的电流密度仍比Pt柱电极的高,说明Pt纳米阵列电极对肼具有更好的催化稳定性和耐受性.

图6 Pt纳米线阵列电极与Pt柱电极在N2H4浓度为50 mmol/L KCl水溶液中的I-T曲线
3 结 语
本文采用直流电沉积法在AAO模板中成功制备Pt纳米线阵列电极,并采用电化学方法研究了其对肼的电催化氧化特性,得到以下结论:
a.Pt纳米线能够成功填充AAO模板的纳米孔洞,纳米线直径50 nm,与孔径一致.
b.Pt纳米线阵列电极能够显著提高对肼的电化学催化氧化活性,当肼浓度达到50 mmol/L时,电化学氧化电流密度达到48 mA/cm2,是铂柱电极的3倍.
c.Pt纳米线阵列电极在不同电化学扫描速率下同样具有良好的催化稳定性和耐受性.
致 谢
感谢武汉工程大学分析测试中心张保华老师在SEM分析方面提供的指导.
[1] YU Xingwen,Peter G Pickup. Recent advances in direct formic acid fuel cell [J]. Journal of Power Sources, 2008, 182(1): 124-132.
[2] DU Juan, YUAN Xianxia, CHAO Yajun et al. Development of electro-catalysts for direct methanol fuel cells [J]. Raremetal Materials and Engineering, 2007, 36(7): 1309-1312.
[3] 王琪, 陆兴. 多元醇法合成的Pt2.6Sn1Ru0.4/C用作直接乙醇燃料电池高性能阳极催化剂[J]. 催化学报, 2014, 35(8): 1394-1401.
WANG Qi, LU Xing. Polyol‐synthesized Pt2.6Sn1Ru0.4/C as a high‐performance anode catalyst for direct ethanol fuel cells [J]. Chinese Journal of Catalysis, 2014, 35(8): 1394-1401. (in Chinese)
[4] TANG Yue, CHENG Wenlong. Nanoparticle modified electrode with size- and shape-dependent electrocatalytic activities [J]. Langmuir, 2013, 29(6): 3125-3132.
[5] LIU Jun, CAO Ling. Preparation of AuPt alloy foam films and their superior electrocatalytic activity for the oxidation of formic acid[J]. ACS Appl Mater Interfaces, 2011, 3(3): 3552-3558.
[6] 王宗花, 史国玉. 直接甲醇燃料电池Pt基阳极催化剂的研究进展[J]. 化学学报,2013(71): 1225-1338.
WANG Zong-hua, SHI Guo-yu. Development of direct methanol fuel cell anode catalyst Pt base [J]. Chinese Academy of Sciences, 2013(71): 1225-1238. (in Chinese).
[7] LU Yizhong, CHEN Wei. PdAg alloy nanowires: facile one-step synthesis and high electrocatalytic activity for formic acid oxidation [J]. ACS Catal, 2012, 2, 84-90.
[8] LIU Dong, GUO Qiaohui. PdxCoy Nanoparticle/carbon nanofiber composites with enhanced electrocatalytic properties[J]. ACS Catal,2014, 4, 1825-1829.
[9] Jean Sanabria-Chinchilla, Koichiro Asazawa. Noble metal-free hydrazine fuel cell catalysts: EPOC effect in competing chemical and electrochemical reaction pathways [J]. Am Chem Soc, 2011, 133, 5425-5431.
[10] 于文强, 易清风. Pd修饰的钛电极制备及肼的电氧化[J]. 电池工业, 2011, 16(3): 28-33.
YU Wen-qiang, YI Qing-feng. Preparation of Pd/Ti electrode and the electrocatalytic oxidation of hydrazine on it[J]. Chinese Battery Industry, 2011, 16(3): 28-33. (in Chinese)
[11] GAO Hongcai, WANG Yuxi. Growth of copper nanocubes on graphene paper as free-standing electrodes for direct hydrazine fuel cells[J]. Phys Chem C 2012, 116: 7719-7725.
[12] ZHOU Hongjun, Fu-Ren F Fan. Observation of discrete Au nanoparticle collisions by electrocatalytic amplification: using Pt ultramicroelectrode surface modification [J]. Phys Chem Lett,2010(1): 2671-2674.
[13] Steven E F Kleijn, Beatriz Serrano-Bou. Influence of hydrazine-induced aggregation on the electrochemical detection of platinum nanoparticles [J]. Langmuir, 2013, 29: 2054-2064.
[14] 王学华,李承勇.高度有序AAO孔的结构参数及其分布规律[J].材料工程,2008(10):219-222.
WANG Xue-hua, LI Cheng-yong. Structural parameters and distribution rules of highly ordered AAO pores [J]. Material Engineering, 2008(10): 219-222. (in Chinese)
[15] 郑志祥, 高作宁.亚铁氰化钾电催化氧化L-半胱氨酸的电化学行为研究[J].分析科学学报,2008,24(3):307-310.
ZHENG Zhi-xiang, GAO Zuo-ning. Electrochemical oxidation of L-Cys catalyzed by K4Fe(CN)6at glassy carbon electrode[J]. Journal of Analytical Science, 2008, 24(3): 307-310. (in Chinese)
