等离子诱变选育柠檬酸高产菌
2014-02-27杨建松王德培
刘 燕,杨建松,王 露,王德培
(工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
等离子诱变选育柠檬酸高产菌
刘 燕,杨建松,王 露,王德培
(工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
黑曲霉TN09是1株柠檬酸生产菌株.为了进一步提高柠檬酸的生产水平,利用等离子对柠檬酸生产菌黑曲霉TN09进行了诱变.诱变后的孢子悬液涂布玉米液化液平板,35℃培养至72h测量透明圈直径,以酸解透明圈直径大于2.2cm、菌落直径大于0.5cm、其比值大于4.8的菌落作为初筛柠檬酸菌株,然后进行摇瓶复筛获得了1株遗传性能稳定的高产菌,与出发菌株(产酸12.46g/dL)相比产酸增幅达到8.67%.
黑曲霉;柠檬酸;等离子诱变
柠檬酸是一种重要的有机酸,在食品、医药、化工等领域应用十分广泛,也是世界上以液体深层发酵方法生产的产量最大的有机酸,2012年世界年产量约为180万吨.我国是柠檬酸主要生产国,年产量为107万吨,占世界总产量的61%左右[1–5].
等离子体是大量相互作用的但仍处于非束缚状态下的带电粒子组成的宏观体系,是与固态、液态、气态处于同一层次上的物质的第四态.等离子是电离气体,这些物质能与生物体内的生物大分子(酶或DNA)相互作用,从而引起生物体的死亡或突变.等离子作为一种物理诱变手段,具有快速、低温、操作简便、无毒性以及诱变效果好等优点,将等离子体应用于微生物诱变育种还是一个崭新的技术[6].
考虑到柠檬酸生产菌种经过几十年的诱变已经对传统诱变产生一定的抗性,所以采用了新型诱变方法——等离子诱变,希望获得产酸高、转化率高、能耗低、生产成本低的柠檬酸生产菌株.本文的实验结果对提高柠檬酸的产量与质量、增强我国柠檬酸国际市场竞争力、促进柠檬酸行业的发展有着重要的参考价值.
1 材料与方法
1.1 菌种
黑曲霉(Aspergillus niger)TN09,本实验室保存.
1.2 原料及其预处理
马铃薯、玉米粉均由山东日照鲁信金禾生化有限公司提供.
玉米液化液制备:玉米粉与水以1∶4的比例混合,搅拌均匀后加热到70℃,加入耐高温的α–淀粉酶(0.5kg/t),保温10min后加热到90℃保温4~5h,碘检不变色,趁热经两层纱布过滤.滤清液冷却后加水调整总糖到要求的浓度[7–8].
1.3 仪器设备
ARTP室温等离子诱变系统(atmospheric and room temperature plasma,ARTP),北京思清源生物科技有限公司;G6型迅数全自动菌落分析仪,杭州迅数科技有限公司;JNOECXS212201型显微镜,Olympus公司.
1.4 培养基
PDA斜面培养基(g/L):马铃薯的煮汁200,葡萄糖20,琼脂粉20,121℃灭菌20min.
PDA平板培养基(g/L):马铃薯的煮汁200,葡萄糖20,琼脂粉15~20,121℃灭菌20min.
玉米液化液平板(g/L):总糖为6%的玉米液化液,MgSO4·7H2O 1.5,K2HPO43.6,琼脂粉20,121℃灭菌20min;
液体发酵培养基(g/L):总糖为18%的玉米液化液121℃灭菌20min.
1.5 培养方法
斜面培养:35℃培养7,d.
摇瓶培养:500mL三角瓶中装入50mL玉米液化液培养液,121℃灭菌20min,采用活菌计数法接入活孢子浓度为5×104mL–1,摇床转速330r/min,35℃振荡培养72h.
1.6 诱变方法
1.6.1 菌种活化
将黑曲霉TN09接入斜面培养基中,置于35℃恒温培养箱中培养7,d,斜面培养基上长满孢子.
1.6.2 样品载片制备
将黑曲霉TN09的新鲜孢子制成孢子悬液后分散均匀,用生理盐水调节孢子悬液浓度至105~106mL–1.取10µL孢子悬液,将其滴加在灭菌冷却后的载玻片上.
1.6.3 等离子诱变过程
将载物台上的载片放置区域紫外灭菌30min.将制得的样品载片置于载台上,使载片与射流出口的距离为2mm;打开工作气体阀门,工作气体即放电气体为氦气;打开外加电源,外加200V、13.56MHz的射频电压,此时射流温度为室温.样品进行辐照,辐照时间为80~180s.
1.7 筛选方法
1.7.1 初筛
将经诱变后的孢子用无菌水洗下,涂布于玉米液化液培养基,培养72h后测量透明圈直径.满足酸解透明圈直径大于2.2cm、菌落直径大于0.5cm、其比值大于4.8的菌落作为初筛柠檬酸菌株,把这些菌落转接到斜面培养基上进一步筛选.
1.7.2 复筛
从初筛得到的斜面菌株上挑取适量的黑曲霉制备孢子悬液,接入活孢子浓度为5×104mL–1,接种于总糖为18%的玉米发酵液中.500mL三角瓶中装入50mL培养液,35℃、300r/min振荡培养72h,并称量上摇瓶质量m1、下摇瓶质量m2,每株菌设置3个平行度,产酸值取3个平行的平均值.
1.8 分析方法
1.8.1 菌落分析仪观察
利用全自动菌落分析仪计算菌落直径、透明圈直径及其直径比例.
1.8.2 活菌计数
从PDA斜面上挑取菌块至50mL带有玻璃珠的无菌水中,振荡1h使孢子分散.准确量取1mL菌液,稀释104倍.准确量取0.5mL稀释菌液,涂布玉米液化液平板上,每个斜面涂布3个平行.将平板放置于生化培养箱,35℃培养24h,通过全自动菌落分析仪计数取平均值.
1.8.3 黑曲霉菌丝球形态的观察
在发酵结束时,将发酵液置于显微镜下放大10倍观察黑曲霉菌丝球的形态.
1.8.4 酸度测定
发酵液经纱布过滤后取1mL置于250mL三角瓶中,用0.142,9mol/L NaOH滴定,0.5%酚酞指示剂2滴,以标准溶液滴至淡粉红色,读取消耗NaOH标准溶液的体积为V,则总酸含量按照式(1)计算,实际产酸(g/dL)按照式(2)计算.

式中:Y 为总酸含量,以一水柠檬酸计量(g/dL);c为NaOH标准溶液物质的量浓度(mol/L);V为NaOH标准溶液消耗体积(mL)[9–10].
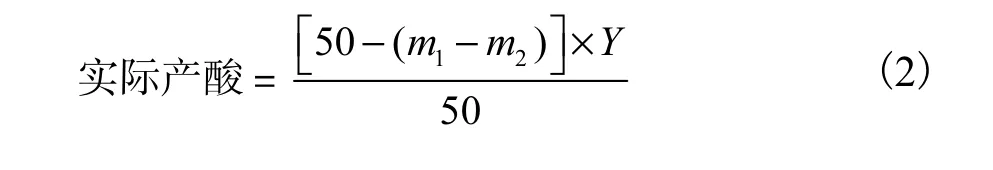
1.8.5 致死率、突变率和诱变菌株产酸增幅的计算
致死率、正突变率、负突变率和诱变菌株产酸增幅分别按照式(3)—式(6)进行计算.

式中:正突变的菌落数为透明圈直径与菌落直径比值、透明圈直径均大于出发菌落的透明圈直径与菌落直径比值、透明圈直径的菌落数;负突变的菌落数为透明圈直径与菌落直径比值、透明圈直径均小于出发菌落的透明圈直径与菌落直径比值、透明圈直径的菌落数[10].
2 结果与讨论
2.1 玉米液化液平板筛选方法的确定
2.1.1 玉米液化液培养基中柠檬酸质量分数与透明圈大小的关系
在玉米液化液培养基的牛津杯孔洞内各加50µL质量分数为2%、4%、6%、8%、10%、12%的柠檬酸溶液,8h后观察,可以明显看到由于柠檬酸扩散所形成的酸解透明圈,如图1所示.

图1 在玉米液化液培养基中不同质量分数柠檬酸形成的透明圈Fig. 1 Transparent circle of different concentrations of citric acid formed in the liquid medium of the liquefied corn
平板于35℃扩散一定时间,测定形成透明圈的直径,计算半径平方,分别对玉米液化液培养基中柠檬酸质量分数与透明圈直径、柠檬酸质量分数与透明圈半径平方的关系作线性关系图(图2),线性相关系数R2分别为0.902和0.929,均大于0.9,表明具有较好的线性关系.

图2 玉米液化液培养基中柠檬酸质量分数与透明圈直径或半径平方的线性关系Fig. 2Linear relationship between the citric acid concentration in the liquid medium of the liquefied corn and the diameter of the transparent circle or radius squared
由图1和图2可知,在玉米液化液培养基中,柠檬酸浓度与培养基中形成的酸解透明圈的直径和半径的平方均可形成较好的线性关系,而且酸解透明圈清晰可见,不需显色剂即可准确测量,因此玉米液化液培养基可用于产酸筛选.
2.1.2 黑曲霉TN09在玉米液化液培养基中的生长状况
将黑曲霉TN09菌株制作孢子悬液,经稀释分别涂布于多个玉米液化液培养基上,每个平板控制菌落数在30个以内,从24 h开始进行观察并记录菌落直径和透明圈直径,记录50个菌落,结果如图3所示.

图3 黑曲霉TN09在玉米液化液培养基中生长情况Fig. 3Growth of Aspergillus Niger TN09 in the liquid medium of the liquefied corn
从图3可看出:随着时间的增加,黑曲霉TN09菌落直径和透明圈直径不断增加.在36 h时黑曲霉TN09产酸并形成透明圈,并随时间增加其酸解透明圈直径变大;在48 h时酸解透明圈直径为0.8~0.85 cm,菌落直径为0.2~0.3 cm,其比值为3.0~4.0;72 h时酸解透明圈直径为2.0~2.2 cm,菌落直径为0.45~0.5 cm,其比值为4.4~4.8,透明圈直径与菌落直径比值达到最大.因此,可在诱变后培养至72 h测量透明圈直径,以酸解透明圈直径大于2.2 cm、菌落直径大于0.5 cm、其比值大于4.8的菌落作为初筛柠檬酸菌株.
2.2 诱变育种
2.2.1 等离子诱变时间的确定
诱变时间的选择往往以致死率和正突变率为依据:若致死率太高,易产生负突变;若致死率太低,则突变较低.为了确定等离子的诱变时间,对80、100、120、140、160、180 s等离子诱变时间的孢子致死率进行了测定,并通过玉米液化液平板透明圈方法计算正负突变率,结果如图4所示.

图4 黑曲霉TN09诱变致死率和正突变率Fig. 4 Curve of the mutagenized death rate and positive mutant rate of Aspergillus niger TN09
由图4可以看出,以中性活性粒子作为作用粒子的等离子射流辐照待诱变微生物,黑曲霉孢子致死率随着等离子诱变时间的延长而增加,但在160 s时,致死率有略微下降,诱变时间在140~160s正突变率较大,在160 s时正突变率达到最大,因此选取160 s为诱变时间.
2.2.2 摇瓶复筛产酸
通过玉米液化液平板初筛得到51株菌,将其进行摇瓶产酸实验,产酸增幅较大的前10株菌产酸结果及其玉米液化液平板初筛所对应的透明圈与菌落直径比值见表1.
51株菌中,摇瓶产酸值大于出发菌株TN09的菌株共47株,占总数的92.16%,验证了玉米液化液平板筛选方法的可行性;产酸值大于对照的菌株诱变时间在140~160s的菌株共43株,占总数的84.31%,其中诱变时间为160 s的有31株.将产酸增幅大于5%的14株菌再次进行摇瓶产酸实验,最终得到产酸增幅大于7%的两株高产菌TN160s-D-3和TN120s-D-1,其产酸增幅分别为8.67%和7.22%.由于柠檬酸原始生产菌株是经过多次诱变的菌株,对各种诱变手段已具有较高的耐受性,虽然等离子诱变是新型的物理诱变手段,但诱变后产酸增幅也不是过于明显.

表1 突变株发酵产酸结果Tab. 1 Yield of citric acid through mutation
2.3 遗传稳定性
为了确保筛选到的高产菌的遗传稳定性,对TN160s-D-3和TN120s-D-1进行了遗传稳定性考察,每代实验过程:高产菌株单菌落—斜面培养—摇瓶发酵测柠檬酸产量.将得到的两株遗传稳定性较好的高产菌株TN160s-D-3和TN120s-D-1共传10代,第2、4、6、8、10代摇瓶发酵,测定结果如图5所示.

图5 遗传稳定性Fig. 5 Genetic stability of the mutants
由图5可知,突变得到的菌株TN160s-D-3遗传稳定性比较好.菌株TN160s-D-3在平板培养基上菌落紧凑,边缘整齐,气生菌丝短,孢子粗壮,颜色为黑褐色,无退化现象.显微镜观察TN160s-D-3在玉米液化液摇瓶中菌球紧凑,为优良的筛选菌.而TN120s-D-1产酸量则不断下降,遗传稳定性很差,平板上的菌落形态逐渐发散,有恢复野生型的迹象.
3 结 论
采用等离子诱变方法对柠檬酸企业生产使用的出发菌株进行诱变.在此过程中,建立玉米液化液平板初筛方法.该方法排除了以往加指示剂观察透明圈对菌落生长的影响,获得了1株比对照菌提高8.67%且遗传性稳定的高产酸菌株TN160s-D-3,并且确定了等离子最佳诱变时间为160 s.由此为进一步的诱变育种工作提供了初筛方法和理论依据,这种诱变方法也可供其他微生物诱变育种时借鉴.
[1] 王博彦,金其荣. 发酵有机酸生产与应用手册[M]. 北京:中国轻工业出版社,2000.
[2] 金其荣,张继民,徐勤. 有机酸发酵工艺学[M]. 北京:中国轻工业出版社,1989.
[3] 王旭,禹邦超,贺占魁. 柠檬酸发酵生产概述[J]. 高等函授学报:自然科学版,1997,11(2):41-48.
[4] Nierman W C,Pain A,Anderson M J,et al. Genomic sequence of the pathogenic and allergenic filamentous fungus Aspergillus fumigatus[J]. Nature,2005,438 (7071):1151-1156.
[5] Fillinger S,Chaveroche M K,van Dijck P,et al. Trehalose is required for the acquisition of tolerance to a variety of stresses in the filamentous fungus Aspergillus nidulans[J]. Microbiology,2001,147(7):1851-1862.
[6] 邢新会,王立言,赵洪新,等. 一种利用等离子体对微生物进行诱变育种的方法:中国,200810116220.5[P]. 2010–01–13.
[7] 陈小真,陈惠萍,郭杰炎. 玉米粉原料的柠檬酸发酵初步研究[J]. 工业微生物,2000,30(1):47–49.
[8] 朱亨政. 淀粉原料直接发酵生产柠檬酸[J]. 工业微生物,1990,20(4):20–24.
[9] 潘涛,周剑,虞龙. 离子注入诱变技术在柠檬酸高产菌选育中的应用[J]. 化学与生物工程,2005(3):42-44.
[10] 李文革,彭玲,刘宣承.60Co-γ射线诱变柠檬酸产生菌黑曲霉Co9-6的研究[J]. 激光生物学,1994,3(3):509–512.
责任编辑:郎婧
Breeding Aspergillus niger for Citric Acid through Plasma Mutation
LIU Yan,YANG Jiansong,WANG Lu,WANG Depei
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Aspergillus niger TN09,is a citric acid producing strain. In order to further improve the production of citric acid,citric acid production fungus Aspergillus niger TN09,was mutagenesised by plasma. The spore suspension after mutagenesis,which was cultured 72h at 35℃,was spread on the liquid medium of the liquefied corn. Then the diameter of the transparent circle was measured. It is considered as citric screening strains if the diameter of the transparent circle of the colony was greater than 2.2cm,the diameter of the colony was greater than 0.5cm,and the ratio was greater than 4.8,coloneis. A highyielding strain was obtained through shake flask rescreening. The new strain has genetic stability and the citric acid yield increased by 8.67% compared with that of the original strain(yield of citric acid 12.46g/dL).
Aspergillus niger;citric acid;plasma mutation;
TS201.3
A
1672-6510(2014)01-0016-04
10.13364/j.issn.1672-6510.2014.01.004
2013–07–11;
2013–10–21
国家高技术研究发展计划“863计划”资助项目(2011AA02A205)
刘 燕(1987—),女,河南人,硕士研究生;通信作者:王德培,教授,wangdp@tust.edu.cn.
