Nocardia canicruria BF313催化甾体9α-羟基化发酵工艺优化
2014-02-27魏长龙赵树欣史吉平张保国
魏长龙,赵树欣,王 珊,史吉平,张保国,*
(1.天津科技大学生物工程学院,天津300457;2.中国科学院上海高等研究院,上海201210)
Nocardia canicruria BF313催化甾体9α-羟基化发酵工艺优化
魏长龙1,2,赵树欣1,王 珊1,2,史吉平2,张保国2,*
(1.天津科技大学生物工程学院,天津300457;2.中国科学院上海高等研究院,上海201210)
应用微生物转化的方法,以Nocardia canicruria BF313作为实验菌株,雄烯二酮为底物,研究了生物法制备9α-羟基雄烯二酮的新工艺。实验考察了转化培养基成分、投料方式、初始pH等因素对微生物转化生成9α-羟基雄烯二酮的影响。最终确定的发酵培养基为:15g/L葡萄糖,2g/L蛋白胨,5g/L酵母粉,1.5g/L硫酸亚铁。灭菌前调pH为7.0,以4%的接种量接种,预培养16h后以拟结晶方式投加底物,经过48h的转化,在投料浓度为10g/L情况下,底物转化率可高达97.2%,在投料浓度20g/L情况下,底物转化率也可达82.7%,投料浓度高于国际水平10g/L,具有极好的产业化前景。
微生物转化,雄甾-4-烯-3,17-双酮,9α-羟基化,发酵条件,优化
甾体药物作为仅次于抗生素的第二大药物,人们对其的需求量不断增加[1]。目前,以生物转化方法催化合成甾体药物越来越受到重视,相较于传统化学合成方法,生物转化具有产率高、专一性强、条件较温和且环境友好等多种优势,使其逐渐成为医药工业合成甾体药物的先进技术手段[1-4]。雄烯二酮全称雄甾-4-烯-3,17-二酮(Androstenedione,4-AD)是合成甾体激素类药物的关键中间体,其可由植物甾醇经微生物降解得到,常被用于制备内分泌激素、避孕药及心血管药物等,在其甾体母核上引入羟基后可大大增强其抗炎活性[2-3]。9α-羟基雄烯二酮(9α-OH-AD)是一种甾体工业化生产中的关键中间产物,在甾体工业化生产中起着重要作用。利用9α-OHAD作为前体物可以合成氢化可的松、17α-OH黄体酮、依普利酮、β米松、地塞米松、可的松等多种重要的甾体原料药,具有重要的商业价值[5]。目前,国内对9α-OH-AD的合成都是从4-AD出发,通过多步化学合成得到,反应过程中存在着化学工艺过程复杂、步骤繁琐、累积产率低、产物成本高、底物消耗大等一系列问题。微生物转化是指利用微生物细胞对有机化合物某一特定部位(基团)的作用,使它转变为结构上相类似的另一种化合物[2]。近年来,利用微生物对不同甾体类化合物的转化技术得到充分发展并在工业上得到广泛应用[4]。而利用微生物转化生产9α-OH-AD的内容在国内外却鲜有报道。本研究通过微生物转化方法,以Nocardia canicruria BF313作为实验菌种,4-AD为底物,通过对培养条件和转化条件的优化最终大大提高了转化效率,为进一步工业化生产奠定了良好的基础。
1 材料与方法
1.1 材料与仪器
Nocardia canicruria BF313 本研究室自主筛选后鉴定保存;雄烯二酮 HPLC纯度99.45%,常州佳尔科药业集团;酵母膏、麦芽浸膏、葡萄糖、可溶性淀粉、蛋白胨、酵母粉等有机碳氮源 上海生工生物工程有限公司;KH2PO4、MgSO4、(NH4)2SO4、KNO3、甲醇、乙醇等化学试剂 均为分析纯,国药集团(上海)化学试剂有限公司;平板培养基 酵母膏4g,麦芽浸膏10g,葡萄糖4g,琼脂2%,定容到1L,pH 7.0;种子培养基 酵母膏4g,麦芽浸膏10g,葡萄糖4g,定容到1L,pH 7.0;初始转化培养基 葡萄糖10g/L,蛋白胨5g/L,KH2PO42.5g/L,MgSO41.5g/L,pH7.0。
RID-10A/SPD-20A型高效液相色谱仪 日本SHIMADZU;PB-10型pH计 德国Sartorius;BSA 224SCW型电子天平 德国Sartorius;DU730型紫外分光光度计 德国Beckman;BX51型显微镜 日本OLYMPUS;ZHWY-2102C型恒温培养振荡器 上海智城分析仪器制造有限公;KS-RD-1型熔点测试仪 东莞市金石检测仪器有限公司;Bruker AMX-400型核磁共振仪、Bruker maxis UHR-TOF型质谱仪 德国Brucker公司。
1.2 微生物培养及初始甾体转化条件
种子培养:平板划线培养菌株,于30℃恒温培养箱中培养30h后,挑取单克隆接种于种子培养基中,30℃,200r/m in摇床中培养24h。初始甾体转化条件:在250m L挡板瓶中装液50m L,调初始pH为7.0,随后以8%的接种量接入种子液,放置于30℃,200r/m in的摇床中预培养24h后,投加甲醇溶解的浓度为10g/L的底物4-AD进行发酵转化。基于上述反应条件对培养基各成分进行优化,每隔12h取样测定甾体转化率。
1.3 发酵优化方法
1.3.1 培养基优化 参考文献[6]的方法。投加4-AD浓度:10g/L。碳源优化:分别以10g/L的葡萄糖、麦芽糖、可溶性淀粉、蔗糖、甘露糖替代初始转化培养基中的葡萄糖,其他初始培养基成分不变,以初始转化条件进行摇瓶发酵。氮源优化:分别以5g/L的蛋白胨、玉米干粉、酵母粉、黄豆粉、(NH4)2SO4、KNO3替代初始转化培养基中的蛋白胨,其他初始培养基成分不变,以初始转化条件进行摇瓶发酵。金属离子优化:分别以1.5g/L的硫酸镁、硫酸锰、硫酸亚铁、硫酸铜、氯化钙、氯化钴替代初始转化培养基中的硫酸镁,其他初始培养基成分不变,以初始转化条件进行摇瓶发酵。正交实验[7]:以甾体转化率作为判定指标,选取优化好的培养基成分葡萄糖、酵母粉、蛋白胨、硫酸亚铁四种因素并以三种不同浓度为水平进行L9(34)正交实验,正交实验各因子水平如表1所示。

表1 因子与水平Table 1 Factors and levels of orthogonal test
1.3.2 发酵条件优化 投加4-AD浓度:20g/L。初始pH优化:利用氢氧化钠将最优培养基的初始pH调节为5.0、5.5、6.0、6.5、7.0、7.5、8.0,其他初始转化条件不变,观察随pH升高甾体转化率的变化情况。接种量优化:分别以2%、4%、8%、12%、16%的接种量将种子液接种到最优培养基中,其他初始转化条件不变,进行摇瓶发酵。预培养时间优化:以优化好的接种量接种到最优培养基中,分别预培养4、8、12、16、20、24h后投料,投料前取样测定其生物量,其他初始转化条件不变,观察不同预培养时间点生物量与甾体转化率的对应关系。投料方式优化:分别以底物干粉、溶解于有机溶剂(甲醇、DMSO、乙醇、吐温80)及拟结晶(方法见参考文献[8]实验方法)等方式投料,其他初始转化条件不变,探究不同投料方式对转化率的影响。
1.3.3 菌种转化能力验证 利用优化好的培养基、发酵条件分别投加10、15、20、25g/L的4-AD,测定其在不同时间点转化率的变化情况。
1.4 测定方法
1.4.1 菌体生物量的测定 采用Beckman Coulter分光光度计,以无菌发酵培养液OD600值作为对照,在0~ 24h间每隔4h的测定菌液的OD600值,以OD600值来表示菌体在此时刻的生物量。
1.4.2 甾体转化率的测定 采用薄层层析(TLC)检测法。将底物4-AD,经结构鉴定后的产物9α-OH-AD标品及转化后的样品在硅胶预制板上点样,展开剂为体积比4∶1的苯丙酮,254nm紫外灯下显色。高效液相色谱(HPLC)检测法:采用C18反相层析柱(Agilent Extend-C18,4.6mm×250mm,5μm);流动相为70%甲醇:30%水(v/v),流速为1.0m L/m in;柱温为32℃;紫外检测波长为254nm;进样体积为20μL。甾体转化率的计算如下:甾体转化率(%)=(产物9α-OH-AD峰面积/投加底物4-AD峰面积)×100。
1.4.3 产物结构的鉴定 将发酵液用乙酸乙酯反复萃取三次,取乙酸乙酯层置于旋转蒸发仪内除去溶剂,再经冰甲醇重结晶后采用熔点、NMR和质谱鉴定产物化学结构[9]。熔点测定:取产物晶体适量放入铝皿中利用熔点测试仪KS-RD-1测定其熔点,升温速率为3℃/m in,升温范围为25~250℃。NMR参数:以CDCl3为溶剂,TMS为内标,观测频率为400.13MHz,实验温度为300.4K。质谱条件:电离方式EI,电离能量70eV,连接管温度280℃,扫描范围70~1000m/z;进样量1.0μL。
1.5 数据处理
本实验数据采用SPSS 13.0处理软件分析,正交实验中甾体转化率的表示方式为±s,n=3。
2 结果与分析
2.1 Nocardia canicruria BF313转化能力的薄层初筛
薄层层析结果见图1,通过样品与标品位置的比照,可判断有无副产物产生,根据斑点大小及颜色深浅可定性判定其转化情况。由图1可知,转化体系是比较专一的,几乎无其他副产物的产生。

图1 甾体底物及产物薄层层析(TLC)检测结果Fig.1 The results of substrate and product by thin layer chromatography(TLC)
2.2 发酵培养基各成分的优化
2.2.1 最佳碳源的优化 碳源可以为微生物生长代谢提供细胞碳架,是微生物生长及转化甾体的物质基础及能量来源。由实验结果(图2)可知,五种碳源均可被诺卡式菌利用来生长及转化底物,但从效果来看,经过48h的转化,葡萄糖作为碳源的转化率为57.7%,远高于其他碳源,故选择葡萄糖为最优碳源。
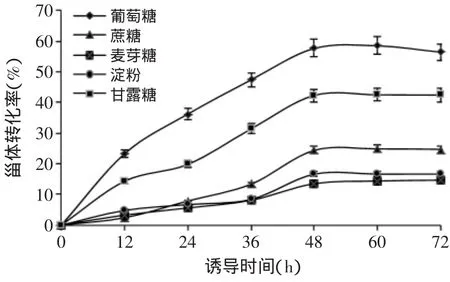
图2 不同碳源对甾体转化率的影响Fig.2 Effect of different carbon sources on steroids’transformation
2.2.2 最佳氮源的优化 氮源作为构成生物体的蛋白质、核酸及其他氮素化合物的材料,是微生物细胞生长及生命活动所必不可少的。由实验结果(图3)可知,有机氮源的转化效果要远好于无机氮源,四种有机氮源中,酵母粉作为氮源的转化率最高,48h内达到61.3%,另外蛋白胨作为生长因子可促进菌体的生长,所以选择酵母粉和蛋白胨(质量比1∶1)为培养基的氮源。
2.2.3 最佳金属离子的优化 据文献报道[10],金属二价阳离子的存在可大幅影响甾体的转化率,这可能是由于金属离子激发了电子的传递,促进或抑制了分子酶间的相互作用,从而影响了酶对底物的催化。由实验结果(图4)可知,与Mg2+相比,Fe2+、Ca2+促进了底物的转化,而Co2+、Cu2+则大幅降低了转化率,其中Fe2+的转化效果最好,故选择硫酸亚铁作为培养基金属离子来源。

图3 不同氮源对甾体转化率的影响Fig.3 Effectof different nitrogen sources on steroids’transformation
2.2.4培养基各成分配比的正交实验 通过对各实验因子极差分析(表2)可以得出,对实验结果影响最大的为葡萄糖,影响最小的为硫酸亚铁。最终得到的最优培养基为A3B1C2D2,即葡萄糖15g/L,蛋白胨2g/L,酵母粉5g/L,硫酸亚铁1.5g/L,磷酸二氢钾2.5g/L。以此培养基发酵转化4-AD,48h后甾体转化率达到93.2%,高于正交实验其他方案及初始培养基。
2.3 发酵反应条件优化
2.3.1 最适初始pH的优化 pH可通过影响菌体胞内酶的活性显著影响微生物对底物的转化,由图5可以看出,初始pH 6.5~7.5为微生物转化的最适范围,其中pH为7.0时转化率最高,故确定培养基的初始pH为7.0。

图5 不同初始pH对甾体转化率的影响Fig.5 Effectof different initial pH value on steroids’transformation

表2 正交实验结果及最优方案Table 2 Orthogonal test results and the optimal case
2.3.2 最佳接种量的优化 接种量的不同可显著影响微生物胞内酶对甾体的催化,接种量过低使得菌体生长点不足,从而导致用于转化的酶量不足;反之接种量过高,则会导致酶活力降低,同样抑制转化率的提高。由图6可知,接种量为4%时甾体转化率达到68.6%,为最适宜的菌液接种量。
2.3.3 微生物预培养时间优化 在微生物的不同生长时期投料,由于菌体酶活力及酶数量的不同,从而显著影响微生物对甾体的转化。从图7可以看出,预培养16h时,菌体生物量经过对数期的迅猛增加达到最高值,菌体酶数量与酶活力到达最适平衡点,此时甾体转化率最高。
2.3.4 底物投料方式的优化 甾体物质不溶于水,需先溶于其他溶剂后在投料有利于底物进入菌体细胞内完成转化。由图8可知,以干粉作为对照,其他投料方式均明显提高了转化效果,其中以最优的拟结晶方式投料后,底物转化率提升最快为82.7%。

图8 投料方式不同对甾体转化率的影响Fig.8 Effect of different feed mode on steroids’transformation
2.4 菌种转化能力验证及发酵过程中转化率变化规律
由图9各曲线变化趋势可知,甾体转化率达到一个最高值后随孵化时间的增加略有下降且浓度越高其达到最高值所需的孵化时间也越长,最终得出的菌种转化能力为:4-AD浓度为10g/L和15g/L时基本可实现完全转化,分别达到97.2%及95.3%,浓度达到20g/L时转化率也达82.7%,均体现出很高的转化能力。
3 结论与讨论
实验筛选了碳氮源、金属离子等培养基成分,并利用正交实验对培养基进行了优化,优化了初始pH,接种量以及预培养时间等培养条件,并对已报道过的多种投料方式的优劣进行了验证,最终获得最适的培养基组成及最佳的培养条件。其中对金属离子的筛选进一步论证了不同离子对转化酶运行机制的影响,有助于抑制微生物对产物降解方面的研究。
Optim ization of submerged fermentation condition for 9α-hydroxylation of Steroid catalyzed by Nocardia canicruria BF313
WEIChang-long1,2,ZHAO Shu-xin1,WANG Shan1,2,SHIJi-ping2,ZHANG Bao-guo2,*
(1.College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China;2.Shanghai Advanced Research Institute,Chinese Academy of Sciences,Shanghai201210,China)
Screened the fermentation med ium for 9α-hyd roxylation of and rostened ione catalyzed by Nocard ia canic ruria BF313,and the reaction conditions,such as feeding mode,the initialpH were op tim ized,the fermentation medium was finalized:15g/L g lucose,2g/L pep tone,5g/L yeast extract,1.5g/L FeSO4.Ad justed to pH7.0 before sterilization,then inoculated w ith 4%of the inoculum,added the substrate w ith Pseudo-crystallo mode after 16h p re-culture.48h after conversion,the substrate conversion rate was 97.2%when the concentration of the feed ing was 10g/L.Under the feeding concentration 20g/L,the substrate conversion rate could reach 82.7%. Conversion efficiency wasmuch higher than the international level,so the industrial p rospects would be great.
m icrobial transformation;and rostenedione;9α-hyd roxylation;fermentation cond ition;op tim ization
Q939.97
B
1002-0306(2014)18-0320-05
10.13386/j.issn1002-0306.2014.18.063
2014-01-03 *通讯联系人
魏长龙(1987-),男,硕士研究生,研究方向:甾体药物微生物转化。
国家自然科学基金项目(41106125)。
