罗非鱼皮胶原蛋白肽亚铁螯合修饰及螯合物性质的研究
2014-02-27杨成涛孙丽平庄永亮
段 秀,杨成涛,孙 云,孙丽平,庄永亮
(昆明理工大学化学工程学院食品科学研究中心,云南昆明650500)
罗非鱼皮胶原蛋白肽亚铁螯合修饰及螯合物性质的研究
段 秀,杨成涛,孙 云,孙丽平*,庄永亮
(昆明理工大学化学工程学院食品科学研究中心,云南昆明650500)
以罗非鱼皮为原料制备胶原蛋白肽(TSGP),胶原蛋白肽与亚铁盐进行螯合反应,对TSGP亚铁螯合物的理化性质及功能特性进行研究。实验优化得出最佳螯合反应条件是m多肽∶mFeCl2·4H2O=500∶1,pH为6.0,反应时间50min,温度35℃。通过荧光光谱、紫外光谱和红外光谱测定发现Fe2+与TSGP的羧基与氨基均可发生配位反应。抗氧化活性测定实验表明,螯合物具有较强的清除DPPH自由基和ABTS+自由基的能力。
罗非鱼皮,胶原蛋白肽,亚铁螯合物,结构,抗氧化
罗非鱼(tilapia)属于鲈形目丽鱼科罗非鱼属,是世界上重要的淡水养殖鱼类。在过去的几年中,罗非鱼的生产量稳步增长,并已成为领先出口的水产品之一。
据报道,罗非鱼皮胶原蛋白占鱼皮干重的70%,国内外对于鱼类胶原多肽进行了大量研究,发现其具有良好的生物活性,如抗氧化活性[1]、降血压活性[2]、抗肿瘤活性[3]以及免疫调节[4]等。此外,鱼皮胶原蛋白活性肽与金属离子如铁、锌、钙等也有很好的螯合活性[5-7]。研究表明,蛋白酶将食品蛋白质水解成肽段,其中有些具有广泛的生理活性,但同时大量肽段没有生物学活性,这些肽段经过一定修饰后具有意想不到的活性[8]。选择合适的蛋白酶水解这些多肽链,并进行适当的修饰,可制备出具有各种生理功能的生物活性肽。近年来随着科学研究的深入,各种修饰生物活性肽不断被发现。
本论文以罗非鱼皮为研究对象,使用中性蛋白酶进行水解,再将制备的罗非鱼皮胶原蛋白肽(TSGP)亚铁螯合修饰,然后对所得TSGP亚铁螯合物进行理化性质及功能性质分析,为TSGP亚铁螯合物的分离、鉴定奠定基础。
1 材料与方法
1.1 材料与仪器
罗非鱼皮 由昆明新海洋食品公司提供;中性蛋白酶(≥6万活力单位) 购买于杰能科国际公司;其他所用试剂 均为分析纯。
AL204型电子天平 梅特勒-托利多仪器(上海)有限公司;DHG9140型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;SB5200D型超声波清洗机 宁波新芝生物科技股份有限公司;KW 1000DC型数显恒温水浴锅 金坛市科析仪器有限公司;FE20实验室pH计 梅特勒-托利多仪器有限公司;HJ-2磁力加热搅拌器 国华电器有限公司;TDL-40B型离心机 上海安亭科学仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;真空冷冻干燥机 南京载智自动化设备有限公司;TU-1901紫外可见分光光度计 北京普析通用仪器有限责任公司;RF-5310PC荧光分光光度计 日本岛津公司;TENSOR27-红外光谱仪 德国布鲁克公司。
1.2 实验方法
1.2.1 鱼皮胶原蛋白提取 热水提取法[1]:鱼皮解冻后,清洗干净并沥干,然后用7倍体积的0.2%氢氧化钠溶液浸泡并不断搅动,40m in后用流动水冲洗至中性;再用7倍体积的0.2%硫酸溶液浸泡并不断搅动,40min后用流动水冲洗至中性;最后将鱼皮加10倍蒸馏水匀浆,用45℃热水恒温提取12h,离心(5000r/m in,20m in)所得上清液即为胶原蛋白,冷冻干燥后备用。
1.2.2 TSGP的制备 用磷酸盐缓冲液配制10mg/m L的胶原蛋白液,用中性蛋白酶进行水解,酶解条件为pH 7,酶用量5%,温度45℃,时间3h。酶解完成后,95℃灭酶15min,离心收集上清液,即得TSGP。浓缩、冻干后,于-20℃冻存备用。
1.2.3 TSGP亚铁螯合物的制备 设计四因素三水平正交实验,因素水平见表1。以亚铁螯合率为指标,通过极差分析,得出最佳工艺条件。
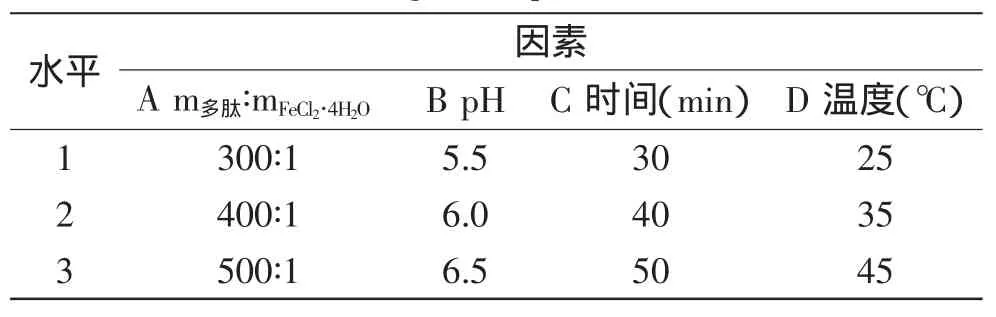
表1 TSGP亚铁螯合物制备正交实验设计因素水平表Table 1 Factors and levels of TSGP iron-chelating orthogonal experiment
1.2.4 水解度(DH)的测定 根据赵新淮等的方法进行测定[9]。
1.2.5 亚铁螯合活性测定 参照Park等[10]的方法稍作修改,将样品pH调至5.5,取3m L加入0.1m L 2mmol/L FeCl2·4H2O,5min后,再加入0.2m L 5mmol/L菲洛嗪(ferrozine),室温下放置10m in,在562nm处测定吸光值。螯合率计算公式如下:
螯合率(%)=[(A0-(A1-A2))/A0]×100
其中A0:磷酸盐缓冲液(pH 5.5)+FeCl2·4H2O+菲洛嗪;A1:样品+FeCl2·4H2O+菲洛嗪;A2:样品+FeCl2· 4H2O+水。
1.2.6 TSGP氨基酸组成及含量测定 采用高效液相色谱的方法测定。
1.2.7 TSGP亚铁螯合物的定性检测 定性检测:Na2S法[11]。
1.2.8 组成成分测定 水分的测定:直接干燥法;多肽的测定:凯氏定氮法;铁含量的测定:邻菲罗琳比色法。
1.2.9 TSGP亚铁螯合物的结构表征
1.2.9.1 荧光光谱分析 所有实验均在常温下进行,5m in后,分别对样品及样品与FeCl2·4H2O的混合物,在激发波长为289nm,发射波长310~400nm范围内,每隔1nm进行光谱扫描。时间光谱扫描中,激发波长为289nm,发射波长为371nm,每分钟扫描一次。
1.2.9.2 紫外扫描分析 将TSGP以及TSGP亚铁螯合物配成一定浓度的水溶液,在190~400nm范围内进行紫外扫描。
1.2.9.3 红外光谱分析 TSGP和TSGP亚铁螯合物干燥后,分别取适量固体样品和少量干燥的溴化钾放入玛瑙研钵中,在红外灯下充分研磨后,压至透明薄片,用红外光谱仪测定其400~4000nm的红外图谱。
1.2.10 抗氧化活性的测定 根据文献[1]测定1,1-二苯基-2-苦肼基(DPPH)自由基清除活性及羟自由基(·OH)清除活性[1],根据文献[12]测定2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基清除活性,根据文献[13]测定血浆铁还原能力(ferric reduction ability plasma assay,FRAP)[13]。
2 结果与讨论
2.1 胶原蛋白提取
用凯式定氮法测得罗非鱼皮中的蛋白质含量为26.71%±0.26%。而经热水提取后的所得的胶原蛋白约占鱼皮总重的18.19%,提取率达到了68.10%。
2.2 TSGP的制备
按照1.2.2所述的条件对鱼皮胶原蛋白进行水解,所得TSGP水解度为12.35%±0.07%。
对TSGP的氨基酸组成进行分析,结果如表2所示,其中Gly所占比例最大,TSGP氨基酸组成中,每1000个氨基酸残基含脯氨酸为272.58个,符合胶原蛋白氨基酸的组成特点。
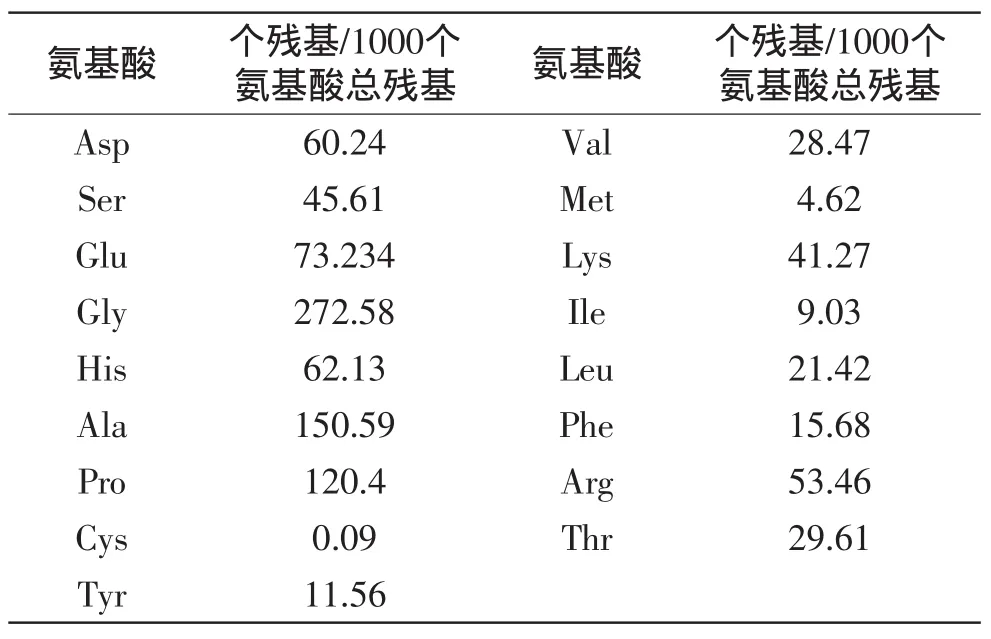
表2 TSGP氨基酸组成及含量分析Table 2 The analysis of TSGP amino acid composition and content
2.3 TSGP亚铁螯合物的制备
通过前期TSGP亚铁螯合单因素实验结果[1],选定螯合条件:m多肽∶mFeCl2·4H2O=400∶1,pH为6.0,反应时间40min,温度35℃。以此为基础设计正交实验,对TSGP亚铁螯合物的制备进行优化。由表3分析可知,对实验结果的影响主次顺序为B>A>D>C,即pH对TSGH与亚铁螯合的影响最大,其次是m多肽∶mFeCl2·4H2O,影响最小的是时间,最佳螯合条件为A3B2C3D2m多肽∶mFeCl2·4H2O= 500∶1,pH为6.0,反应时间50m in,温度35℃,利用上述螯合条件进行验证实验,平行测定3次,亚铁螯合率达到99.00%。高于表3其他实验组别的螯合率。
肽的螯合活性与分子量、结构、氨基酸组成以及立体结构有关。TSGP的水解度为12.35%,因此,TSGP的平均分子量在890u左右[14],适合金属离子的螯合。研究表明,天冬氨酸(Asp)和谷氨酸(Glu)的羧基有利于肽与金属离子结合,丝氨酸的羟基和巯基可能有助于铁螯合作用,此外,丝氨酸的磷酸化可以为带正的金属如铁,钙和锌创建合适的螯合位点[15]。TSGP中Asp,Glu和Ser含量相对较高,这可能是TSGP具有较高的亚铁螯合活性的原因之一。
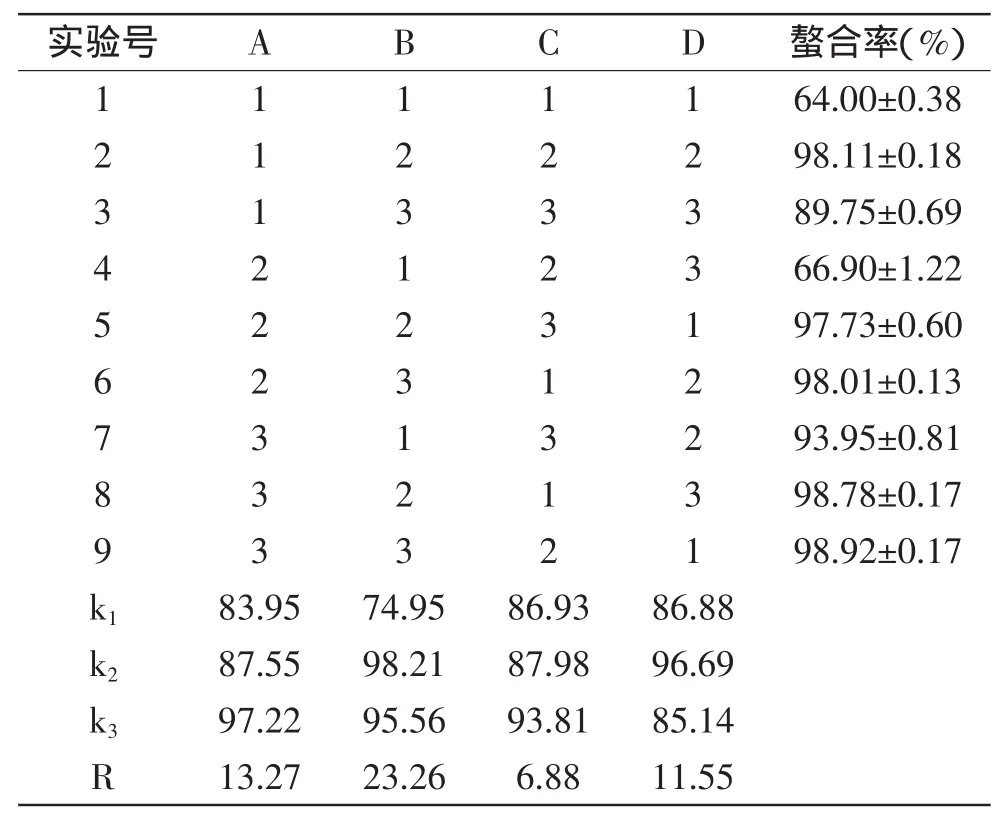
表3 TSGP亚铁螯合正交实验结果Table 3 The orthogonal test results of iron-TSGP chelating
2.4 TSGP亚铁螯合物的表征
2.4.1 TSGP和TSGP亚铁螯合物成分分析 由表4可知,在定性检测TSGP亚铁螯合的过程中,其各个步骤的实验现象符合多肽螯合物的定性检测现象。所以可以确定本实验制备的产品是以多肽螯合物的形式存在的。
由表5可看出,制备的TSGP亚铁螯合物中主要成分是多肽和铁,二者质量百分数分别为60.7%和10.24%,但是其中还有较多的钠盐的存在,这主要是由于酶解时使用磷酸盐缓冲液配制胶原蛋白液及调节pH时加入的NaOH或HCI所致,在后续研究中可以通过透析、超滤等方法进一步纯化产品。

表5 TSGP和TSGP亚铁螯合物成分分析Table 5 The componentanalysis of TSGP andiron-TSGP chelate
2.4.2 荧光光谱图分析 TSGP和TSGP亚铁螯合物的荧光光谱测定见图1。图1(a)显示了在激发波长289nm时,不同反应时间的荧光发射光谱图,从图中可以看出,随时间的变化,发射光谱有略微红移的现象,由图1(b)可以看出10m in之前荧光强度衰减明显,10min之后的变化不明显。在蛋白质折叠/展开研究中,荧光强度下降是肽折叠的一个典型指标。根据荧光动力学(图1b),肽折叠伴随TSGP亚铁螯合的全部过程。金属离子是蛋白质和多肽折叠的关键,尤其是对于短肽,其在水溶液中不具有热力学稳定的结构[5]。
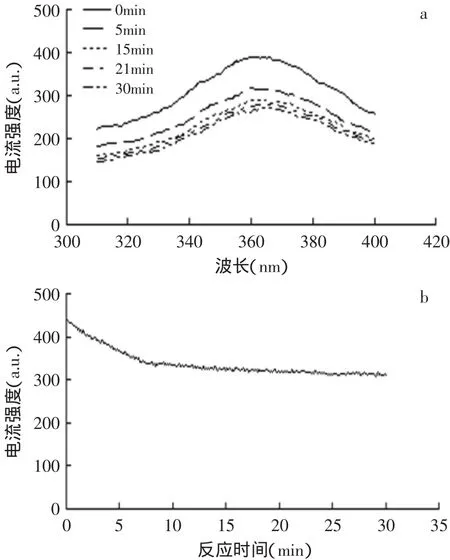
图1 TSGH亚铁螯合荧光光谱图Fig.1 The fluorescence emission spectra of the iron-TSGP chelating
2.4.3 紫外扫描分析 如图2所示,TSGP和TSGP亚铁螯合物最大紫外吸收峰对应波长分别为213nm和205nm,最大吸收峰发生位移。螯合物的生成会使其配位体对光吸收性能发生改变,这是TSGP和铁结合后相应原子的价电子跃迁不同的反映,证明了它们之间发生了螯合反应[7]。
2.4.4 红外光谱分析 如图3所示,对TSGP的红外光谱(A),在特征区,—NH2的吸收峰在3448cm-1;在指纹区,C=O的吸收峰在1652cm-1,-COO-的吸收峰在1407cm-1。TSGP亚铁螯合物红外光谱图(B),在特征区,—NH2的吸收峰移动到了3413cm-1,发生了变化,说明螯合物中的—NH2键发生了化学反应;在指纹区,C=O的吸收峰红移至1660cm-1,-COO-的吸收峰移至1402cm-1,可见,-COO-键也发生了的化学反应,表明氨基和羧基均参与了亚铁的螯合反应。特别地,对于螯合物,在1100cm-1左右出现了的(PtNH2)单吸收峰变成双吸收峰,也证明Fe2+与-NH2有较强结合。由红外吸收峰的偏移或变化进一步证实TSGP和Fe2+之间形成了螯合物[7]。

表4 TSGP亚铁螯合物定性检测结果Table 4 The qualitative test results of iron-TSGP chelate
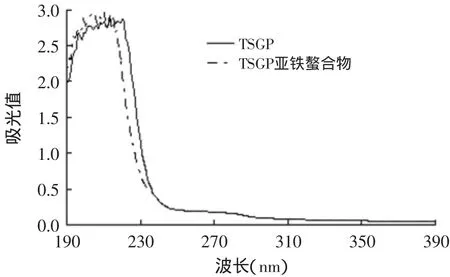
图2 TSGP和TSGP亚铁螯合肽的紫外吸收曲线Fig.2 Ultravioletabsorption curve of TSGP and iron-TSGP chelate
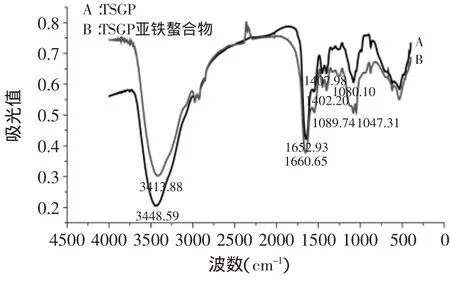
图3 TSGP和TSGP亚铁螯合肽的红外光谱对比分析Fig.3 Infrared spectrum analysis of TSGP and iron-TSGP chelate
2.4.5 抗氧化活性测定 由表6可以看出,除羟自由基清除活性外,螯合物DPPH自由基清除活性、ABTS+自由基清除活性、FRAP都明显优于TSGP,螯合物羟自由基清除活性较弱,可能是因为在过渡金属离子(Fe2+)存在的条件下,超氧阴离子和过氧化氢可以产生羟自由基,使得螯合物对羟自由基的清除活性弱于TSGP。
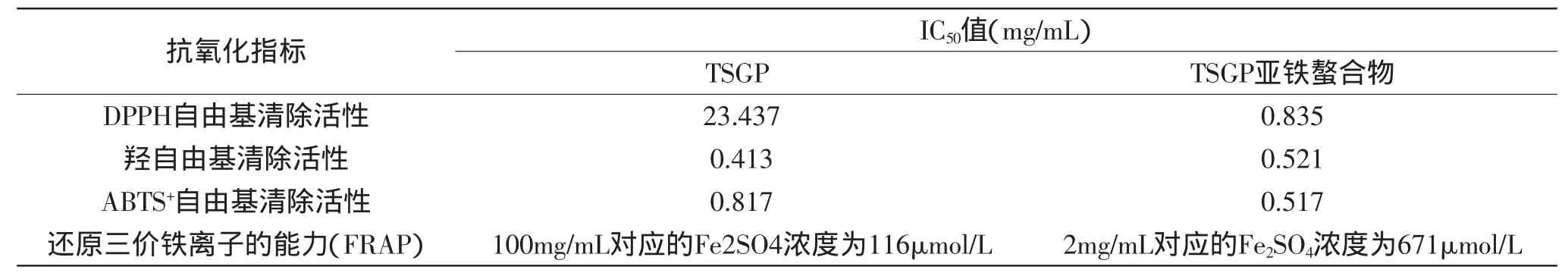
表6 TSGP和TSGP亚铁螯合物抗氧化活性的比较Table 6 The comparison of antioxidantactivity of TSGP and iron-TSGP chelate
3 结论
通过正交实验优化得出TSGP最佳螯合反应条件为m多肽∶mFeCl2·4H2O=500∶1,pH为5.5,反应时间50m in,温度35℃。通过荧光光谱、紫外光谱和红外光谱等手段对TSGP亚铁螯合物的结构进行研究,证实Fe2+和TSGP的羧基与氨基均发生配位反应,TSGP和Fe2+形成了螯合物。通过对TSGP亚铁螯合物的抗氧化活性进行分析,发现除羟自由基清除活性外,螯合物DPPH自由基清除活性、ABTS+自由基清除活性、FRAP都明显优于TSGP,说明TSGP亚铁螯合物可作为一种潜在的抗氧化剂。
[1]Zhang Yufeng,Duan Xiu,Zhuang Yongliang.Purification and characterization of novel antioxidant peptides from enzymatic hydrolysates of tilapia(Oreochromis niloticus)skin gelatin[J]. Peptides,2012,38(1):13-21.
[2]Raghavan Sivakumar,Kristinsson Hordur G.ACE-inhibitory activity of tilapia protein hydrolysates[J].Food Chemistry,2009,117(4):582-588.
[3]王静凤,王奕,崔凤霞,等.鱿鱼皮胶原蛋白多肽对B16黑素瘤细胞黑素合成的影响[J].中国药理学通报,2007,23(9):1181-1184.
[4]Ravallec-PléRozenn,Wormhoudt Alain Van.Secretagogue activities in cod(<i>Gadusmorhua</i>)and shrimp(<i>Penaeus aztecus</i>)extractsand alcalase hydrolysates determined in AR4-2J pancreatic tumour cells[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2003,134(4):669-679.
[5]Wu Haohao,Liu Zunying,Zhao Yuanhui,et al.Enzymatic preparation and characterization of iron-chelating peptides from anchovy(Engraulis japonicus)muscle protein[J].Food Research International,2012,48(2):435-441.
[6]赵洪雷,徐永霞,杨杰,等.低值鱼小肽螯合锌的制备工艺研究[J].食品科技,2009,34(9):117-119.
[7]夏光华,申铉日,酒志强.罗非鱼皮胶原蛋白小肽螯合钙的制备、鉴定及抗氧化研究[J].食品科技,2013,38(6):242-246.
[8]王琳芳,杨克恭.蛋白质与核酸[M].北京:北京医科大学、中国协和医科大学联合出版社,1999:1-18.
[9赵新淮,冯志彪.大豆蛋白水解物水解度测定的研究[J].东北农业大学学报,1995,26(2):178-180.
[10]Eun Young Park,Hiroko Imazu,Yasuki Matsumura,et al. Effects of Peptide Fractionswith Different Isoelectric Points from Wheat Gluten Hydrolysates on Lipid Oxidation in Pork Meat Patties[J].Journal of Agricultural and Food Chemistry,2012,60(30):7483-7488.
[11]吴茹怡,曾里,曾凡骏.复合氨基酸螯合物鉴定方法的研究[J].食品科技,2006(3):104-110.
[12]夏光华,申铉日,蔡锦红.三酶法制备罗非鱼鱼皮胶原蛋白抗氧化肽及活性研究[J].食品科学,2012,33(23):175-179.
[13]陈力宏,董英,陆炳,等.酶法制备蚕茧层抗氧化活性肽的工艺条件研究[J].食品研究与开发,2013,34(6):5-10.
[14]张宇昊,王强.Alcalase酶水解花生蛋白制备花生短肽的研究[J].农业工程学报,2007,23(4):258-262.
[15]Lidong Guo,Hu Hou,Bafang Li,et al.Preparation,isolation and identification of iron-chelating peptides derived from Alaska pollock skin[J].Process Biochemistry,2013,48(5-6):988-993.
Preparation,characterization and antioxidant activity of tilapia skin collagen polypeptides chelated iron
DUAN Xiu,YANG Cheng-tao,SUN Yun,SUN Li-ping*,ZHUANG Yong-liang
(Research Centre of Food Engineering,College of Chemistry and Engineering,Kunming University of Science and Technology,Kunming 650500,China)
Tilap ia skin collagen polypep tides(TSGP)was p repared and chelated by iron.The physical,chem ical and functional p roperties of the chelate were characterized.The op timum parameters of chelating as follows:mpolypeptides∶mFeCl2·4H2O=500∶1,pH6.0,reaction time 50m in,temperature 35℃.The formation of iron-TSGP chelate was confirmed by the Ultraviolet spectrum and Infrared spectroscopy,and found that the carboxyl and am ino group of TSGP bounded w ith iron.In add ition,chelate had a strong radical scavenging activities of DPPH·and ABTS+·.
tilap ia skin;TSGP;chelate;structure;antioxidantactivity
TS201.1
A
1002-0306(2014)18-0157-05
10.13386/j.issn1002-0306.2014.18.025
2013-11-07 *通讯联系人
段秀(1990-),女,硕士研究生,研究方向:食品营养与安全。
国家自然科学基金项目(31101392)。
