电镀污泥中铬的无害化处理及动力学分析
2014-02-26余训民黄雯琦
余训民,黄雯琦,庄 田
(武汉工程大学环境与城市建设学院,湖北 武汉 430074)
0 引 言
铬是人体必须的元素之一,在糖代谢及脂代谢过程中起到了重要的作用.铬广泛分布于地壳中,其存在的氧化态一般从二价到六价.土壤岩石中存在的微量铬,一般为三价形式,由于工业因素,六价铬也作为一种氧化态广泛存在[1].人体利用的铬通常为三价,大量摄入六价铬会带来致癌、致突变等不良影响,美国疾病控制中心毒害物质及疾病登记署在2007~2011年均将六价铬列为前20位优先监测的物质之一.
由于电镀工业是我国的重要加工业,电镀铬广泛分布在各个行业中,含铬电镀污泥作为电镀废水处理的最终产物,若处置不当,可能引起地表水、土壤、地下水污染的二次污染,甚至危及生物链,造成严重的生态污染.随着电镀工业的发展,电镀污泥的公害问题日趋严重,电镀污泥无害化、资源化一直是环保科研的热点[2-4].铬本身是一种不可再生资源,而且我国的铬资源短缺,因此,从电镀污泥中回收铬具有重要意义[5-6].
根据实际情况,某表面处理工业园废水处理选用化学沉淀法降低废水中的重金属浓度,直至达标排放,将化学沉淀法产生大量的污泥进行浓缩.笔者以鄂州表面处理工业园电镀废水处理后含铬污泥为主要研究对象,探究其浸出和沉淀的最佳条件及其反应动力学.
1 实验部分
1.1 试剂与仪器
1.1.1 试剂 硫酸(开封东大化工有限公司试剂厂);氢氧化钠(天津市博迪化工有限公司);无水碳酸钠(天津市密欧化学试剂有限公司);重铬酸钾(天津市博迪化工有限公司);焦亚硫酸钠(天津市密欧化学试剂有限公司);高锰酸钾(天津市博迪化工有限公司);亚硝酸钠(天津市福晨化学试剂厂);二苯碳酰二肼(国药集团化学试剂有限公司);丙酮(江苏强盛化工有限公司);磷酸(开封东大化工有限公司试剂厂);尿素(天津市博迪化工有限公司).试剂均为市售分析纯.
1.1.2 仪器 722E可见分光光度计; SHB-Ⅲ循环水式多用真空泵;A-13箱式电阻炉;TAS-986 ICP-AES等离子体电耦发射光谱仪;DZF-6020真空干燥箱;电子天平;DF-101B集热式磁力搅拌器;TGL-16G离心机;PHS-25型 pH酸度计.
1.2 实验步骤
含铬污泥中回收铬元素实验步骤如下:①将污泥放入干燥箱进行干燥;②将干燥后的污泥研磨至0.150 mm;③采用X-射线能谱仪(SEM-EDS)对污泥粉末进行物相分析;④采用H2SO4溶液浸出污泥粉末中的重金属,探讨5种因素:固液比;搅拌速度,r/min;浸出时间,min;反应温度,℃;硫酸体积分数,%,经实验选取适宜的浸出条件;⑤将浸出液抽滤,使浸出液与浸出残渣分离;⑥采用黄钠铁矾法除铁,过滤后用焦亚硫酸钠(Na2S2O5)还原六价铬离子;⑦然后用NaOH溶液调节浸出液pH值,使铬、镍、锌重金属离子分步分离.
2 结果及分析
2.1 物相分析
采用X-射线能谱仪(SEM-DES)分析物相,结果见表1.
从表1可知,该污泥中Cr元素含量远高于其它元素,因此,从该污泥提取Cr元素并将其进行资源化利用具有重要意义.
2.2 浸出影响因素分析
采用4因素(固液比;搅拌速度,r/min;浸出时间,min;硫酸体积分数,%)3水平正交实验探讨含重金属污泥中铬的浸出效果,正交实验结果见表2.确定对铬浸出效果影响因素顺序为:硫酸体积分数>搅拌速度>浸出时间>固液比.
影响铬元素浸出效果的因素有:固液比、搅拌速率、浸出时间、浸出温度、浸出剂体积分数.故采用单因素实验对硫酸的浸出工艺条件进行优化探索结果,见图1~图4.
分别称取2 g污泥至20 mL、24 mL、28 mL、32 mL、36 mL、40 mL硫酸溶液,选用酸体积分数为10%的硫酸、温度为25 ℃、浸出时间为30 min、转速为600 r/min的条件下进行浸出.固液比对污泥中铬的浸出率的影响见图1.
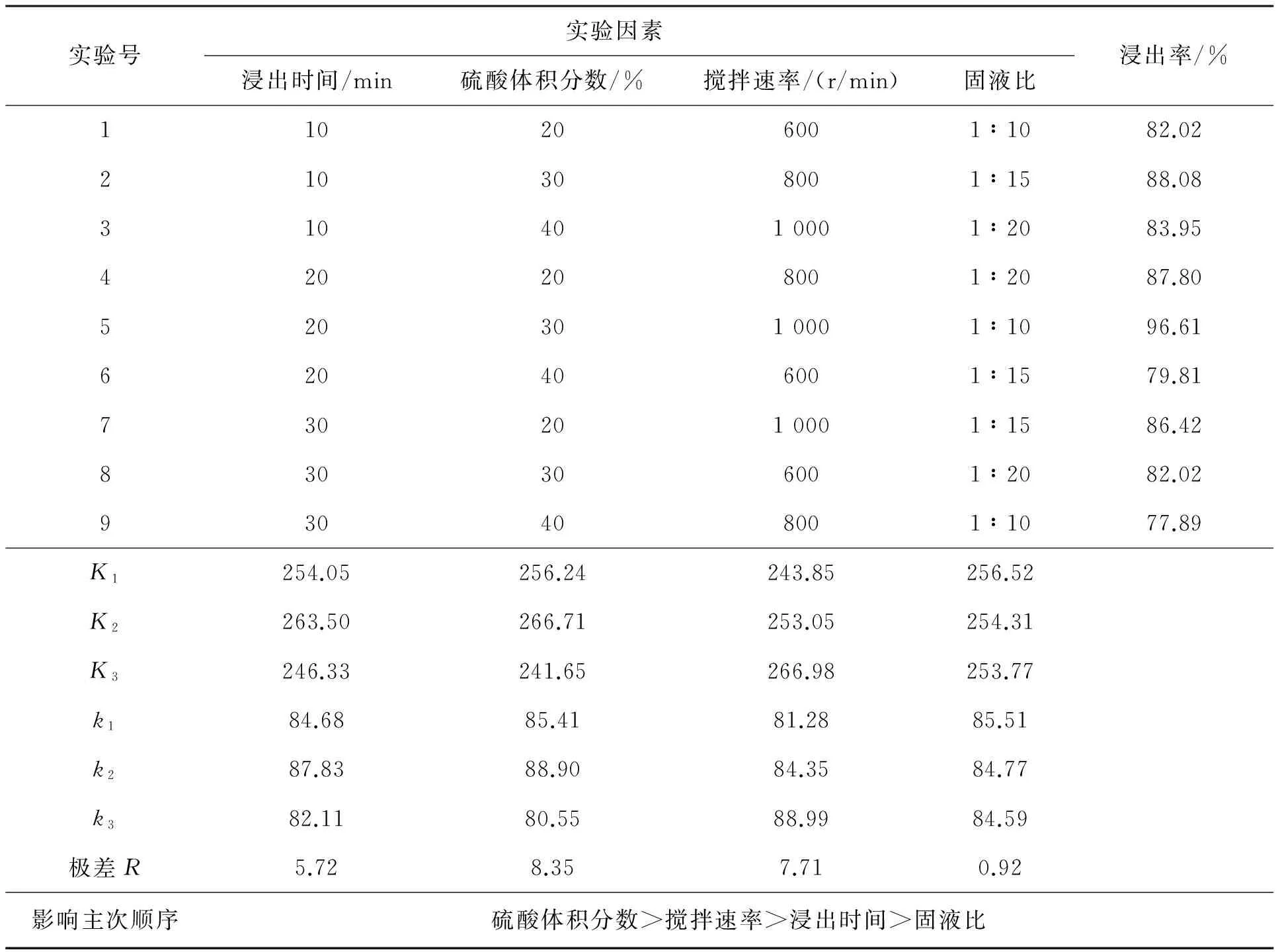
表2 硫酸浸出正交实验及浸出的极差分析Table 2 The leaching orthogonal of sulfuric acid and the range analysis

图1 固液比对铬元素浸出率的影响Fig.1 Effect of solid-liquid on chromium leaching rate
由图1可知,当铬的固液比为1∶15时,铬的浸出率达到最大值,其中浸出率为80.33%.浸出过程中的固液比对重金属的浸出有一定的影响.固液比过小会增大泥浆黏度,不利于浸出剂的扩散,阻碍反应的进行,增大固液比可以降低反应过程中泥浆黏度,改善扩散条件.但是固液比过大浸出率反而有所下降.此外,从实际应用考虑,固液比过大不仅会增大试剂的耗量,还会降低设备的处理能力.因此,本实验选取固液比为1∶15.
分别称取2 g污泥至30 mL硫酸溶液中,选用酸体积分数为10%的硫酸、温度为25 ℃、浸出时间为5 min 、10 min 、15 min 、20 min 、25 min 、30 min,转速为600 r/min的条件下进行浸出.浸出时间对污泥中铬的浸出率的影响见图2.

图2 浸出时间对铬元素浸出率的影响Fig.2 Effect of time on leaching rate of chromium
由图2可知,当浸出时间在20 min之前,浸出率随浸出时间的延长而增大,浸出时间为20 min时,铬的浸出率达到最大值,其浸出率为85.26%,此后随着浸出时间的延长,浸出率基本不变.这是由于20 min以前,污泥中的重金属盐一直与硫酸反应,到达20 min时,重金属盐已完全与硫酸反应,浸出率不随时间的延长而增大.因此,本实验选取浸出时间为20 min.
分别称取2 g污泥至30 mL硫酸溶液中,选用酸体积分数为10%的硫酸、浸出时间为20 min、温度为20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃,转速为600 r/min的条件下进行浸出.浸出温度对污泥中铬的浸出率的影响见图3.

图3 浸出温度对铬元素浸出率的影响Fig.3 Effect of temperature on leaching rate of chromium
由图3可知,当铬的浸出温度为35 ℃时,铬的浸出率达到最大值,其浸出率为85.87%.这是由于随着温度的升高,分子活性增强,导致反应加剧,且该反应本身为放热反应,反应时放出的热量也会导致反应加剧.但是由曲线变化趋势可知,温度对浸出效果影响不大,可能因为反应本身放出的热量大大超过实验设置温度,反应放出的热量已经足以使浸出反应中浸出率达到最大.因此在实际应用中,本实验选择浸出温度为25 ℃.
分别称取2 g污泥至30 mL硫酸溶液中,选用酸体积分数为10%、20%、25%、30%、35%、40%的硫酸、浸出时间为20 min、温度为25 ℃,转速为600 r/min的条件下进行浸出.硫酸体积分数对污泥中铬的浸出率的影响见图4.

图4 硫酸体积分数对铬元素浸出率的影响Fig.4 Effect of acid concentration on leaching rate of chromium
由图4可知,当硫酸体积分数为30%时,铬的浸出率达到最大值,其浸出率为95.17%.这是由于酸体积分数小于30%时,浸出剂提供的氢离子不足以将污泥中的重金属离子完全浸出,当酸体积分数为30%时,浸出剂提供的氢离子刚好可以将重金属离子完全浸出,当酸体积分数超过30%时,浸出剂中氢离子过量.因此,本实验选取硫酸体积分数为30%.
分别称取2 g污泥至30 mL硫酸溶液中,选用酸体积分数为30%的硫酸、浸出时间为20 min、温度为25 ℃,转速为500 r/min、600 r/min、700 r/min、800 r/min、900 r/min、1 000 r/min的条件下进行浸出.搅拌速率对污泥中铬的浸出率的影响见图5.

图5 搅拌速率对铬元素浸出率的影响Fig.5 Effect of mixing speed on leaching rate of chromium
由图5可知,当搅拌速率为800 r/min时,铬的浸出率达到最大值,其浸出率为99.02%.这是由于随着搅拌速率的增大,污泥中重金属离子与浸出剂硫酸接触越充分,使浸出反应进行的更加彻底,从而改善扩散条件.但是从图5曲线变化趋势可知,反应速率过大浸出率会有所降低.因此,本实验选取最佳搅拌速率为800 r/min.
通过上述浸铬实验影响因素的探讨,得出铬的最佳浸出条件为:固液比为1∶15,浸出时间为20 min,浸出温度为25 ℃,硫酸体积分数为30%,搅拌速率为800 r/min.
分别称取2 g、6 g、10 g、14 g、18 g、20 g污泥加入30 mL、90 mL、150 mL、210 mL、270 mL、300 mL硫酸溶液中,在浸出时间为20 min、浸出温度为25 ℃、硫酸体积分数为30%、搅拌速率为800 r/min条件下进行放大实验.在相同条件下,选择不同质量的污泥且保证固液比相同,具体浸出情况见图6.

图6 最佳浸出条件下放大试验Fig.6 The optimum leaching conditions amplification test
由图6可知,在浸出实验放大10倍的情况下,浸出率依然保持在98%以上,该浸出的适宜条件对实际应用具有一定的参考价值.
2.3 分步沉淀实验分析
不同的金属元素的氢氧化物的浓度积Ksp不同,所以可以调节pH来将元素沉淀下来.表3列出了部分难溶金属氢氧化物在不同浓度下沉淀的pH值.
若直接采用化学沉淀法分步沉淀金属离子,当Fe离子沉淀完全后,生成的Fe(OH)3属于胶体,会吸附Cr、Ni、Zn离子,达不到分步分离重金属的目的.因此,需先用高锰酸钾将Fe2+全部氧化为Fe3+后再采取黄钠铁矾法除去Fe元素.同时在pH值为3~4时投加焦亚硫酸钠,使六价铬还原为三价铬.然后用NaOH溶液调节浸出液的pH值,当pH值约为5.6时,将溶液过滤,得到Cr(OH)3

表3 部分难溶金属氢氧化物在不同浓度下沉淀的pH值Table 3 Some insoluble metal hydroxides precipitation at different concentrations of pH
沉淀,将滤液留下待用.将滤液与NaOH溶液反应,开始产生沉淀,沉淀为Ni(OH)2和Zn(OH)2混合沉淀物,继续加入过量NaOH溶液,Zn(OH)2则与NaOH反应生成两性氧化物Na2ZnO溶于水中,则可以分离出Ni(OH)2沉淀和Na2ZnO溶液,此时,Cr、Ni、Zn离子分步分离完毕.重金属沉淀处理效果见表4.
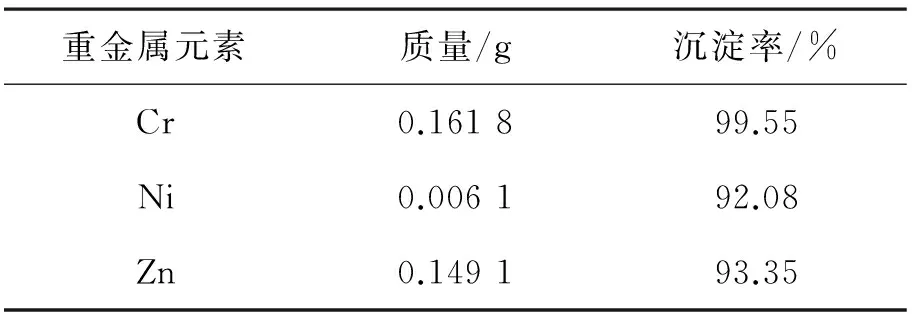
表4 重金属沉淀处理效果Table 4 Heavy metal precipitation effect
2.4 反应动力学研究
取污泥2 g,加入体积分数分别为2%、4%、6%、8%的H2SO4溶液,反应温度25 ℃.铬的浸出率与反应时间的关系见图7.

图7 不同硫酸体积分数下铬浸出率与反应时间的关系Fig.7 Relationship between chromium leaching rate and reaction time under different concentrationof sulfuric acid
由图7可知,上述线性方程斜率,即铬的溶解速率(v)分别为:4.8×10-3g/(mL·min)、5.1×10-3g/(mL·min)、4.9×10-4g/(mL·min)、4.8×10-3g/(mL·min),且当硫酸体积分数为4%时铬的溶解速率最大.
以硫酸浓度负对数作为横坐标,以铬溶解速率的负对数lnv作为纵坐标作图,实验结果见图8.
由图8可知,该直线的斜率为0.941.因此,硫酸对铬溶解速率的反应级数近似为1,其动力学方程为:
(1)

图8 硫酸浓度负对数与铬溶解速率负对数的关系Fig.8 Relationship between the negative logarithm of sulfuric acid concentration and the negative logarithm of chromium dissolution rate
取污泥2g,加入4%的H2SO4溶液,反应温度分别为20 ℃、25 ℃、30 ℃、35 ℃.铬的浸出率与反应时间的关系见图9.

图9 不同温度下铬浸出率与反应时间的关系Fig.9 Relationship between chromium leaching rate and reaction time at different temperatures
由图9可知,上述线性方程斜率,即铬的溶解速率(v)分别为:4.9×10-3g/(mL·min)、5.1×10-3g/(mL·min)、5.2×10-4g/(mL·min)、4.8×10-3g/(mL·min),且温度为30 ℃时铬的溶解速率最大.
以热力学温度的倒数作为横坐标,以铬溶解速率的负对数lnv作为纵坐标作图,实验结果见图10.

图10 铬溶解速率负对数与热力学温度倒数的关系Fig.10 Relationship between the negative logarithm of chromium dissolution rate and reciprocal of thermodynamic temperature
由图10可知,该直线的斜率为544.18,截距为3.460 6.
根据化学反应速率方程表达式及阿伦尼乌斯公式
(2)
(3)
通过联立上述两个方程,并对方程两边取负对数得到:
(4)
图11中直线的截距为-lnA-αln[H2SO4],斜率为Ea/R,R=8.315 J/(mol·K).由此可以计算出反应活化能Ea=4.52 kJ/mol,积分常数A等于0.053 2.根据上述实验数据,最终得到该电镀污泥用硫酸浸铬的反应速率常数为k=0.053 2e-4.52/RT.
3 结 语
本文针对电镀污泥的特点,采用酸浸方法和分步沉淀法提取浸出液中的多种重金属,尤其是铬元素,得出最佳浸出工艺条件及动力学方程.
a.实验选择用硫酸作为浸出剂,得出最佳浸出条件为:浸出温度25 ℃、固液比1∶15、浸出时间20 min搅拌速率800 r/min、硫酸体积分数为30%时,铬的浸出率达到最高.采用正交试验法,确定对铬浸出效果影响因素顺序为:硫酸体积分数>搅拌速度>浸出时间>固液比.
b.电镀污泥的浸铬实验的浸出动力学研究结果表明:硫酸作为浸出剂的反应级数为1,反应的速率常数为:k=0.053 2e-4.52/RT.
致 谢
武汉工程大学测试中心及鄂州电镀工业园的工作人员给予了配合和支持,在此向他们表示最衷心的感谢!
[1] 陈志蓉,张庆生.六价铬的危害性评价及其检测回顾[J].中国药事,2012,26(7):683-688. CHEN Zhi-rong,ZHANG Qing-sheng.Review the safty evaluation and detection of six valence chromium[J].Chinese Pharmaceutical Affairs,2012,26(7):683-688.(in Chinese)
[2] 杨加定.电镀污泥中铜、镍、铬、锌的回收利用研究[J].化学工程与装备,2008(6):138-142,132. YANG Jia-ding.Study on recovery of copper,nickel,chromium,zinc in electroplating sludge[J].Chemical Engineering & Equipment,2008(6):138-142,132.(in Chinese)
[3] 唱鹤鸣,丁建东,高鹏.pH值对电镀废水及污泥中重金属回收的影响[J].南通大学学报:自然科学版,2012,11(4):46-49. CHANG He-ming,DING Jian-dong,GAO Peng.Effect of pH on the recovery of the heavy metals in electroplating wastewater and sludge[J].Journal of Nantong University:Natural Science Edition.2012,11(4):46-49.(in Chinese)
[4] 郭茂新,孙培德,楼菊青.钠化氧化法回收电镀污泥中铬的试验研究[J].环境科学与技术,2009,32(7):50-53. GUO Mao-xin,SUN Pei-de,LOU Ju-qing.Experimental study on the recovery of chromium from electroplating sludge by sodium oxidation method[J].Environmental Science & Technology,2009,32(7):50-53.(in Chinese)
[5] 李雪飞.电镀污泥中铬的分离工艺研究[D].武汉:华中科技大学,2006. LI Xue-fei.Study on separation of chromium from electroplating sludge[D].Wuhan:Huazhong University of Science and Technology.2006.(in Chinese)
[6] 陈可,石太宏,王卓超,等.电镀污泥中铬的回收及其资源化研究进展[J].电镀与涂饰, 2007,26(5):43-46. CHEN Ke,SHI Tai-hong,WANG Zhuo-chao,et al.Research progress of recovery and utilization of chromium from electroplating sludge[J].Electro-plating & Finishing,2007,26(5):43-46.(in Chinese)
