甘氨酸镧(Ⅲ)配合物与牛血清白蛋白的相互作用研究
2014-02-26郭文静刘晓侠邓凡政
郭文静 刘晓侠 邓凡政
(淮北师范大学 化学与材料科学学院, 安徽 淮北 235000)
0 引言
近年来,研究证实稀土氨基酸配合物具有杀菌、消炎、抗凝血和降血糖等作用,稀土与核酸配位后对维护核酸构型稳定性有重要作用[1]。血清白蛋白对许多外源性和内源性的物质具有转运和存储的功能,是血浆中重要且含量最丰富的载体蛋白质,能维持正常的血浆渗透压,是血液缓冲剂。人们对血清白蛋白与各种物质的相互作用展开了大量的研究工作,其中研究稀土金属离子对血清白蛋白的作用机理以及对血清白蛋白结构的影响等方面已成为生物无机化学的一个重要课题。因此研究稀土氨基酸配合物与血清白蛋白相互作用,对于了解稀土离子在人体内的代谢过程以及生物效应的作用机理意义重大。
1 实验部分
1.1 主要仪器与试剂
X射线衍射仪D8 Advance(德国,bruker);傅立叶红外光谱仪NEXUS670(美国尼高力仪器公司);FP-8300荧光分光光度计(日本分光株式会社);pHSJ-3CT型酸度计(上海今迈仪器仪表有限公司);XW-80A型漩涡混合器(江苏海门市麒麟医用仪器厂)。
牛血清白蛋白(BSA)溶液(10-4mol/L):4 ℃冰箱中保存;氧化镧,固体;甘氨酸,固体;NaCl溶液(0.5 mol/L);伯瑞坦-罗宾森(B-R)缓冲溶液(pH=7.4)。所用实验用水为超纯水,试剂为分析纯。
1.2 实验步骤
准确称取一定量灼烧后的氧化镧,用硝酸(1+1)溶解,制备硝酸镧溶液。按甘氨酸与硝酸镧摩尔比为3∶1,称取甘氨酸放入硝酸镧溶液的烧杯中,在70 ℃的水浴中搅拌7 h,室温冷却,二次重结晶后置于干燥器中干燥至恒重。可制得配合物La(NO3)3·(Gly)3·H2O[2]。
在比色管中加入0.5 mL BSA,2.0 mL的B-R缓冲溶液,2.0 mL的NaCl溶液,不同体积的配合物,用水定容到10.0 mL,混匀静置30 min。荧光扫描的范围为290~500 nm,在此范围内测定荧光光谱。
2 结果与讨论
2.1 甘氨酸镧配合物红外光谱
图1.1和1.2分别为甘氨酸及配合物红外光谱图(FT-IR),由图中可以得出甘氨酸中的NH3+和COO-基团所具有的特征峰在配合物中仍然保留,但峰的位置有较大的位移,甘氨酸中NH3+的伸缩振动(2 904 cm-1)、反对称弯曲振动(1 594 cm-1),COO-的对称伸缩振动(1 410 cm-1)、反对称伸缩振动(1 522 cm-1),而配合物中NH3+的伸缩振动(3 185 cm-1)、反对称弯曲振动(1 476 cm-1),COO-的对称伸缩振动消失、反对称伸缩振动(1 603 cm-1)。说明了甘氨酸中NH3+,COO-基团参与了配位。
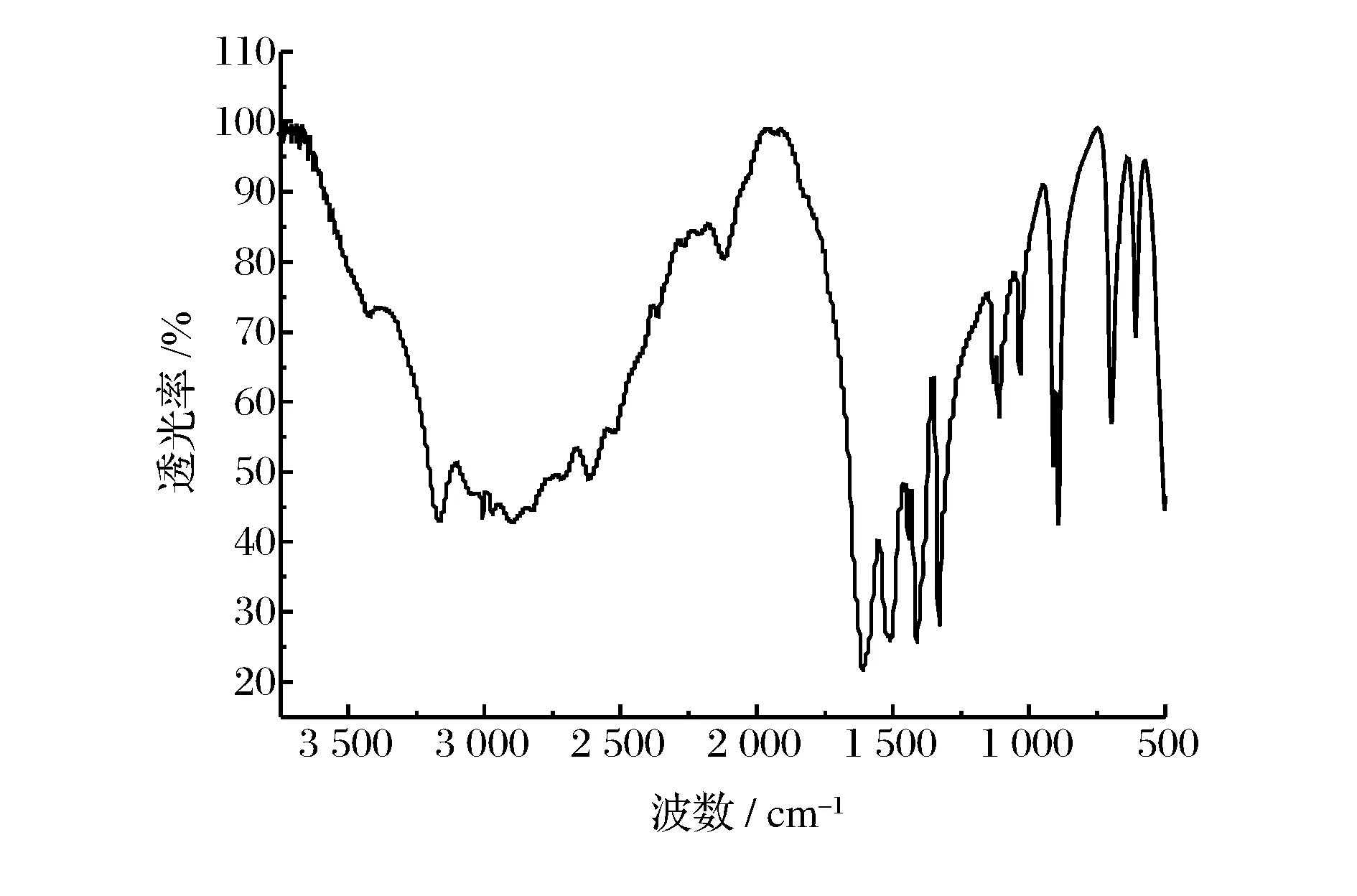
图1.1 Gly的FT-IR光谱图 Figure 1.1 FT-IR spectrum of Gly.

图1.2 La(NO3)3·(Gly)3·H2O的FT-IR光谱图Figure 1.2 FT-IR spectrum of La(NO3)3·(Gly)3·H2O.
2.2 甘氨酸镧配合物X射线衍射
由图2.1和2.2表明,甘氨酸衍射峰位置及强度与配合物的衍射峰位置及强度有很大的差异,因此说明这些配合物是新生成的化合物,而不是甘氨酸与硝酸镧的混合物。

图2.1 Gly的XRD图谱 Figure 2.1 XRD spectrum of Gly.

图2.2 La(NO3)3·(Gly)3·H2O的XRD 图谱.Figure 2.2 XRD spectrum of La(NO3)3·(Gly)3·H2O.
2.3 甘氨酸镧配合物对蛋白质的荧光猝灭类型
BSA中酪氨酸、苯丙氨酸和色氨酸等氨基酸残基的存在具有内源性荧光,加入甘氨酸镧(Ⅲ)配合物后BSA的荧光强度明显降低,出现荧光猝灭现象,表明BSA与甘氨酸镧(Ⅲ)配合物存在相互作用。控制BSA的含量,不断的增加甘氨酸镧(Ⅲ)配合物的浓度,由图3可见,BSA的荧光强度有规律降低。对于动态猝灭,其机理过程符合Stem-Volmer方程(1)[3]。
F0/F=1+Kqτ0[Q]=1+Ksv[Q]
(1)
其中F0是没有猝灭剂的荧光强度,F是加入猝灭剂的荧光强度;[Q]是猝灭剂的浓度;Kq是双分子猝灭速率常数,单位为L/(mol·s);Ksv为Stern-Volmer方程的猝灭常数,是双分子猝灭的速率常数和单分子衰变的速率常数的比;τ0是没有加入猝灭剂时侯生物大分子的平均荧光寿命。以F0/F对[Q]作图,求得不同温度下的Ksv见表1。可以看出随温度升高,Ksv减小,对于动态猝灭而言,升高温度将加剧电子转移及增加有效碰撞,温度的升高使猝灭常数变大[4]。又根据式Kq=Ksv/τ0求出的猝灭速率常数Kq,不同种类猝灭剂对于生物大分子的最大扩散碰撞猝灭速率常数是2.0×1010L/(mol·s),从表1中数据知甘氨酸镧(Ⅲ)配合物对于 BSA的猝灭速率常数全大于最大扩散碰撞猝灭速率常数,这可以证明猝灭是形成了复合物所引起的静态猝灭,而不是动态猝灭。

图3 荧光猝灭光谱图Figure 3 Fluorescence quenching spectra.CBSA=0.5×10-6 mol/L;C配合物(1~11)=0,0.3,0.6,0.9,1.2,1.5,1.8,2.1,2.4,2.7,3.0(×10-3 mol/L)
对于静态猝灭Lineweaver-Burk方程[5]为最常用方程(2),此式指出了F,[Q],Kb,n之间的关系。
lg[(F0-F)/F]=lgKb+nlg[Q]
(2)
用lg[(F0-F)/F]对lg[Q]作图,通过斜率和截距可以计算出Kb与n列于表1中。由数据可知甘氨酸镧(Ⅲ)配合物与蛋白质分子有很强烈的相互作用,且甘氨酸镧(Ⅲ)配合物与蛋白质分子间存在1~2个结合位点。
2.4 甘氨酸镧配合物与牛血清白蛋白的作用力类型
通常生物大分子和药物分子的相互作用力类型包含静电引力,范德华力,疏水作用力,氢键等。由蛋白质和甘氨酸镧配合物之间反应前后的热力学参数熵变ΔS和焓变ΔH的相对大小来判断两者的主要作用力类型。根据Klotz等总结的规律[6],当反应的焓变ΔH>0、熵变ΔS>0时,反应为吸热过程,分子间的结合力主要来自于疏水作用力;当反应的焓变ΔH<0、熵变ΔS>0时,反应为放热过程,分子间的结合力主要为静电力;当反应的熵变ΔS<0、焓变ΔH<0的时侯,反应为放热过程,分子之间的相互作用力类型为范德华力与氢键。当温度变化不大的时候,蛋白质与配合物结合反应的焓变ΔH可以视为常数。由甘氨酸镧(Ⅲ)配合物与BSA的结合常数Kb并结合公式(4)求得反应的吉布斯自由能变ΔG,根据方程式(3)和(5)计算出反应焓变ΔH和熵变ΔS,有关热力学数据见表1。不同温度下都有ΔG<0,可以推断出配合物与BSA的结合反应 自发过程。ΔH>0,ΔS>0则甘氨酸镧(Ⅲ)配合物与BSA分子间的作用力主要为疏水作用力。
(3)
ΔG=-RTlnKb
(4)
ΔG=ΔH-TΔS
(5)
2.5 配合物对牛血清白蛋白构象的影响
由Δλ=15 nm所作出的同步荧光光谱仅表现酪氨酸残基的荧光,而Δλ=60 nm所作出的同步荧光光谱仅显示出色氨酸残基的荧光[7]。由于残基所在的微环境发生变化会影响蛋白质的最大发射波长,所以蛋白质构象的改变可以通过发射波长的变化来判断。如果最大发射峰出现蓝移说明蛋白质中氨基酸残基微环境的疏水性增加,最大发射峰出现红移则说明蛋白质中氨基酸残基微环境极性增加。固定BSA的浓度不变,甘氨酸镧(Ⅲ)配合物的浓度逐渐增加,得到BSA的同步荧光光谱图,见图4。由图可见随甘氨酸镧(Ⅲ)配合物浓度的增大,酪氨酸残基的特征光谱峰没有发生位移,而色氨酸残基的最大发射波长发生了微弱的蓝移,这个结果表明蛋白质中色氨酸残基所在的微环境疏水性增加,蛋白质的构象也因而发生了改变。

表1 La(NO3)3·(Gly)3·H2O与BSA作用的猝灭常数和热力学参数Table 1 Quenching constants and thermodynamic parameters for the interaction betweenLa(NO3)3·(Gly)3·H2O and BSA

图4 配合物对BSA同步荧光光谱的影响Figure 4 Effect of La(NO3)3·(Gly)3·H2O on synchronous fluorescence spectra of BSA.CBSA=5×10-6 mol/L;C配合物(1~11)=0,0.3,0.6,0.9,1.2,1.5,1.8,2.1,2.4,2.7,3.0(×10-3 mol/L)
3 结论
红外光谱表明甘氨酸中NH3+,COO-基团参与了与镧(Ⅲ)配位,X射线衍射分析进一步说明配合物是新生成的化合物。利用荧光光谱法获得甘氨酸镧(Ⅲ)配合物与BSA相互作用引起BSA荧光猝灭,且属于静态猝灭。热力学计算结果表明甘氨酸镧(Ⅲ)配合物和BSA相互作用是自发进行的及两者之间相互作用力主要为疏水作用力。由同步荧光光谱图可知甘氨酸镧(Ⅲ)配合物使得BSA的构象发生了变化,色氨酸残基所在微环境的疏水性增强。
[1] 刘湘虎.稀土元素对动物及人的影响[J].中国畜牧兽医,2008,35(8):158-159.
[2] 何地平,韩维和,刁琳琳.稀土甘氨酸配合物的制备及表征[J].陕西师范大学学报,2011,39(1):45-48.
[3] 马贵斌,高飞,任斌知.荧光法研究药物分子与人血清白蛋白的结合作用[J].化学学报,1995,53(12):1193-1197.
[4] 赵锦,王志,吴秋华.应用荧光光谱法和紫外光谱法研究士的宁与牛血清白蛋白的相互作用[J].药学学报,2006,41(7):666-670.
[5] 杨曼曼,杨频,张立伟.荧光法研究咖啡酸类药物与白蛋白的作用[J].科学通报,1994,39(1):31-35.
[6] KOWSKA A S.Interaction of drugs with bovine and human serum albumin[J].J Mol Struct,2002,614:227-232.
[7] Yang P,Yang MM,Yang BS.The fluorescence enhancement and the action between donor and acceptor[J].Chin J Chem ,1996,14(2):109-113.
