地塞米松和利多卡因抑制舒芬太尼全麻诱导时诱发呛咳的临床疗效观察
2014-02-25王锦媛侯清武马玉英
王锦媛,侯清武,马玉英
舒芬太尼自1974年合成以来,因脂溶性强、用药后血流动力学稳定等优点,多用于心血管、神经外科、产科等手术麻醉过程以及术后镇痛。与芬太尼相似的是,全麻诱导时舒芬太尼亦诱发呛咳。对印度人群的研究发现,其呛咳发生率为15.8%[1];沈锦春等[2]采用等效剂量芬太尼、舒芬太尼、雷米芬太尼分别于5 s内匀速推注的方法,观察到呛咳的发生率分别为33.3%、30.5%和54.3%。舒芬太尼诱导时出现的呛咳反应呈短暂、爆发性,对于伴有脑疝、颅内动脉瘤、开放性眼创伤、气胸患者不容忽视[3]。本研究通过对比地塞米松和利多卡因降低全麻诱导时舒芬太尼诱发呛咳的疗效,探讨舒芬太尼诱发呛咳的可能机制。

表1 3组患者一般资料比较
注:ASA=美国麻醉医师协会;*为χ2值
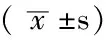
表3 3组患者不同时间点MAP和HR比较
注:T0=给药时刻,T1=给药后3 min,T2=插管后1 min,T3=插管后3 min,MAP=血压,HR=心率
1 资料与方法
1.1 一般资料 选取2013年1—8月在新疆石河子大学第一附属医院择期行舒芬太尼诱导全麻手术患者120例,其中男51例,女69例。入选标准:择期手术的全身麻醉患者,年龄35~65岁,美国麻醉医师协会(ASA)分级Ⅰ~Ⅱ级。排除标准:BMI≥30 kg/m2者;吸烟史者;急性上呼吸道感染者;使用激素及支气管扩张药者;气道高反应疾病者;口服血管紧张素转化酶抑制剂(ACEI)类高血压者;肝肾功能障碍者;术前需放置胃管者。采用随机数字表法分为3组,对照组(Ⅰ组)、地塞米松组(Ⅱ组)、利多卡因组(Ⅲ组),每组40例。
1.2 方法 患者术前均无特殊用药。入室后开放左手背静脉通路,监测心电图、无创血压、脉搏、血氧饱和度和呼吸。Ⅰ组静脉注射0.9%氯化钠溶液5 ml;Ⅱ组静脉注射地塞米松(天津金耀集团有限公司,湖北天药药业股份有限公司)5 mg;Ⅲ组静脉注射利多卡因(上海禾丰制药有限公司)0.5 mg/kg,总量均为5 ml,5 s内注射完毕。Ⅰ组、Ⅲ组均在给药2 min后,Ⅱ组在给药10 min后,开始全麻诱导。给药顺序分别为咪达唑仑(江苏恩华药业股份有限公司)0.06 mg/kg注射时间10 s;舒芬太尼(宜昌人福药业有限公司)0.5 μg/kg,注射时间10 s;丙泊酚(西安力邦制药有限公司)2.0 mg/kg,注射时间15 s;顺式阿曲库铵(江苏恒瑞医药股份有限公司)0.15 mg/kg,注射时间5 s。
1.3 观察指标及呛咳程度定义 静脉推注舒芬太尼后,记录呛咳发生的次数,对严重程度分级(按照呛咳出现次数分为轻、中、重三度。轻度:1~2次/min;中度:3~4次/min;重度:5次/min或以上)。分别记录给药时(T0)、给药后3 min(T1)、插管后1 min(T2)、插管后3 min(T3)各时间点患者的血压(MAP)和心率(HR)。

2 结果
2.1 一般资料比较 3组患者间性别、年龄、ASA分级、BMI比较,差异无统计学意义(P>0.05,见表1)。
2.2 呛咳程度比较 与Ⅰ组比较,Ⅱ组、Ⅲ组呛咳反应严重程度降低(P<0.05);Ⅱ组与Ⅲ组的呛咳反应严重程度比较,差异无统计学意义(P>0.05,见表2)。
2.3 不同时间点MAP和HR的比较 3组患者在给予舒芬太尼发生呛咳前、后均可见MAP、HR出现波动。比较3组组间MAP、HR变化,差异无统计学意义(P>0.05)。每组各时间点MAP、HR比较,差异有统计学意义(P<0.05,见表3)。
3 讨论
舒芬太尼作为芬太尼衍生物,具有镇痛作用强、起效快、持续时间短等特点[4-11],但其在全麻诱导时诱发的呛咳反应亦得到麻醉医生关注。经多项研究发现,舒芬太尼诱发呛咳后可导致MAP、HR升高,血流动力学出现波动,对于伴有颅内压高、眼内压高、肺大疱患者,可能增加其手术麻醉过程的风险[12-14]。
本研究中地塞米松组和利多卡因组与对照组相比呛咳反应严重程度降低,两组患者均未发生重度呛咳,说明地塞米松和利多卡因可有效降低舒芬太尼诱发的呛咳反应。3组组内各时间点MAP、HR均有波动,但是所有入选患者未出现任何不良反应。
地塞米松预防呛咳的发生机制可能是其在中枢与外周同时抑制5-羟色胺(5-HT)的产生与释放,改变血-脑脊液屏障对5-HT的通透性,降低血液中作用于大脑化学催吐感受区的5-HT浓度,从而预防呛咳的发生[15]。本研究中地塞米松组仍有10%(4/40)的患者发生呛咳反应,推测其原因可能是:首先,本研究选取的舒芬太尼剂量偏大(0.5 μg/kg),而地塞米松用量为经验性应用,可能不足以完全抑制该剂量下舒芬太尼诱发的呛咳;其次,地塞米松为长效制剂,通过静脉注射给药,待药物作用到靶器官时其浓度偏低,本试验提前10 min经静脉给药,尚存在未达到药物起效高峰的可能。本研究中利多卡因在体内作用时间(在全麻诱导前3 min经静脉注射)可能未充分到达作用高峰;另外,利多卡因只是通过中枢或外周的化学性刺激抑制舒芬太尼诱发呛咳反应发生,阿片类药物诱发呛咳反应的机制存在多种可能,利多卡因的抑制机制相对单一,故尚不能完全抑制舒芬太尼诱发的呛咳。
表2 3组患者呛咳反应严重程度的比较(例)
Table2 Comparison of severe degrees of coughing response in three groups patients

组别例数呛咳发生情况无 轻度 中度 重度Ⅰ组4024853Ⅱ组4036220Ⅲ组4035320H值6876P值0032
目前,舒芬太尼诱发呛咳机制有以下几种推测:(1)阿片受体的二元论:阿片类药物具有镇咳作用,经试验发现,阿片类药物作用于脑干咳嗽中枢的阿片受体发挥止咳作用[16]。在全麻诱导时阿片类药物需用镇痛剂量,此剂量要大于抑制咳嗽所需的阿片类药物[17],故推测舒芬太尼可能激活咳嗽中枢某些受体导致呛咳发生。(2)感受器学说:喉部和气管、支气管树中的快速适应性肺牵张感受器(RARs)是咳嗽反射的初级感觉通路。全麻诱导时感受舒芬太尼这种化学性刺激产生神经冲动,经迷走神经传入脑干,再经迷走神经内运动纤维传出,形成呛咳反射[18]。肺和支气管上的C类神经纤维感受器兴奋时可引起呛咳。研究发现,C类神经纤维感受器既可以释放激肽激活RARs,诱发呛咳反应;又可以引发神经源性炎性反应,作用于中枢门控机制而抑制咳嗽反射[19]。两者相互作用的机制复杂,可能取决于C类神经纤维感受器、RARs被激活、中枢门控机制抑制咳嗽三者之间的平衡[20]。(3)枸橼酸:枸橼酸具有很强的致咳作用。体外实验表明,枸橼酸通过C类神经纤维传导,可能引发呛咳[21]。另有研究发现,枸橼酸可刺激喉部和上呼吸道的RARs,触发外周组织中的初级神经元末梢释放速激肽,引发呛咳[22]。
国内外医师采用不同方式,如添加辅助药物或改变给药方式抑制舒芬太尼诱发呛咳的发生,但只能降低其发生率,尚不能完全抑制。而且添加辅助药物可能增加药物不良反应的发生,故存在一定风险。而本研究选用地塞米松和利多卡因的剂量安全[23],故为临床应用提供依据。
本研究样本量小、分组不够细致,导致研究结果存在差异;地塞米松剂量的选择有待进一步精确。如加大样本量,进行多中心、双盲研究将为临床选药提供参考依据。
对于舒芬太尼在全麻诱导时诱发的呛咳反应仍是国内外学者的研究热点。各种方法不能完全抑制其诱发的呛咳反应并存在争议。阿片类药物诱发呛咳的发生机制还需要进一步研究,为临床选取科学、方便、有效的干预手段提供依据,降低不良事件的发生率。
1 Agarwal A,Gautam S,Nath SS,et al.Comparison of the incidence and severity of cough induced by sufentanil and fentanyl:a prospective,randomized,double-blind study[J].Anaesthesia,2007,62(12):1230-1232.
2 沈锦春,杨建军,郭海峰,等.等效剂量芬太尼、舒芬太尼和雷米芬太尼诱发呛咳的比较[J].临床麻醉学杂志,2010,26(9):753-755.
3 Sun S,Huang SQ.Effects of pretreatment with a small dose of dexmedetomidine on sufentanil-induced cough during anesthetic induction [J].J Anesth,2013,27(1):25-28.
4 徐露,李元海.舒芬太尼的药理作用和临床应用研究进展[J].安徽医药,2011,15(3):375-377.
5 靳红绪,张同军,孙学飞,等.地佐辛复合舒芬太尼用于恶性肿瘤根治术后静脉自控镇痛的临床研究[J].中国全科医学,2013,16(1):264.
6 马红梅.不同浓度舒芬太尼用于腹式子宫切除术后静脉自控镇痛的临床观察[J].中国煤炭工业医学杂志,2012,15(3):354-357.
7 范滢萍.舒芬太尼复合丙泊酚在无痛人流术中的应用[J].中国煤炭工业医学杂志,2012,15(3):371-372.
8 梁勇升,唐培佳.舒芬太尼在无痛胃镜检查中预防丙泊酚注射痛的应用[J].海南医学院学报,2010,16(3):362-363.
9 侯春燕,田国刚.舒芬太尼在蛛网膜下腔麻醉的应用[J].海南医学院学报,2010,16(4):534-536.
10 宋志鸿,石缨,薛晓东,等.胃部手术患者丙泊酚靶控输注复合舒芬太尼或芬太尼麻醉的效果比较[J].疑难病杂志,2011,10(2):86.
11 张玉杰,张丽伟,戚小航,等.舒芬太尼和芬太尼在高龄患者麻醉诱导气管插管中的临床观察[J].疑难病杂志,2011,10(6):462.
12 李凯,刘岩,朱志华,等.不同给药方法对舒芬太尼呛咳反应的影响[J].中国医药科学,2011,1(18):84-86.
13 李商庚,厉小丽,叶永青,等.不同给药顺序对舒芬太尼麻醉诱导时呛咳的影响[J].中国医药学杂志,2012,32(7):542-543.
14 孟镇镇,张林,王世端,等.地佐辛预防舒芬太尼诱发患者全麻诱导期呛咳反应的可行性研究[J].现代生物医学进展,2013,13(10):1911-1913.
15 Haji A,Kimura S,Ohi Y.A model of the central regulatory system for cough reflex[J].Biol Pharm Bull,2013,36(4):501-508.
16 Reitan JA,Stengert KB,Wymore ML,et al.Central vagal control of fentanyl -induced bradycardia during halothane anesthesia[J].Anesth Analg,1978,57(1):31-36.
17 张瑞冬,陈锡明,陈煜.芬太尼诱发呛咳的机制、影响因素和预防[J].国际麻醉学与复苏杂志,2006,27(6):369-372.
18 Widdicombe JG.Neurophysiology of the cough reflex [J].Eur Respir J,1995,8(7):1193-1202.
19 Spina D,Page CP.Regulating cough through modulation of sensory nerve function in theairways[J].Pulm Pharmacol Ther,2013,26(5):486-490.
20 Fox AJ,Barnes PJ,Urban L,et al.An invitro study of the properties of single vagal afferents innervating guinea-pig airways[J].J Physiol,1993,469(1):21-35.
21 Yemen TA.Small doses of sufentanil will produce violent coughing in young children[J].Anesthesiology,1998,89(1):271-272.
22 韩潮,黄绍强.不同药物对芬太尼呛咳反应的抑制作用[J].复旦学报:医学版,2007,34(1):135-138.
23 Pandey CK,Raza M,Ranjan R,et al.Intravenous lidocaine 0.5mg/kg effectively suppresses fentanyl-induced cough[J].Can J Anesth,2005,52(2):172-175.
